应用流式细胞Index Sorting技术研究小鼠胚胎生血内皮细胞
倪艳丽,李昀桥 ,兰雨,刘兵
1.军事科学院 军事医学研究院,北京 100071;2.解放军总医院 第五医学中心,北京 100071;3.暨南大学 基础医学院,广东 广州 510632
造血干细胞(hematopoietic stem cell,HSC)具有自我更新和多向分化的潜能,持续不断产生机体所需的各类血细胞。小鼠胚胎发育早期,第一波原始造血起源于胚胎期第7.25 d(E7.25)卵黄囊区域的造血祖细胞,其快速产生有核原始红细胞、巨核细胞和巨噬细胞等多种功能细胞。紧随其后,E8.25的卵黄囊血管产生了第二波短暂的永久造血祖细胞——红髓系祖细胞(erythro-my⁃eloid progenitor,EMP)。EMP 可迁移至小鼠胎肝,并具有分化为成熟红细胞、巨核细胞、巨噬细胞、中性粒细胞和肥大细胞的能力。卵黄囊产生的原始造血细胞对于小鼠胚胎期的生存不可或缺,并极大地贡献了成体时期不同组织中的驻留型免疫细胞[1]。直至E10.5,第三波最为重要的定向造血以产生第一个具有长期重建成体造血系统潜能的HSC 为标志。HSC 可起源于胚胎体多个血管部位,包括主动脉-性腺-中肾(aorta-gonadmesonephros,AGM)区、头部、胎盘和卵黄囊[2-3]。研究显示,AGM 区是HSC 生成的最主要位点,其产生的HSC 迁移至胎肝扩增,并于新生后归巢骨髓,贡献着机体终生造血活动。
造血干祖细胞的起源一直是造血发育研究的热点。利用小鼠内皮示踪研究策略,发现EMP群体起源于卵黄囊血管中的少部分内皮细胞,同时HSC 也起源于主动脉血管中的少量内皮细胞,提示内皮细胞是造血祖细胞的前体[4-5]。2010年,Traver 和Robin 研究团队分别通过实时成像技术更直观地发现AGM 区主动脉腹侧的一群特化的血管内皮细胞以出芽的形式形成含有造血干祖细胞的造血簇,因此该过程被称为内皮-造血转化(endothelial to haematopoietic transition,EHT),这部分特化的内皮细胞被定义为生血内皮细胞(hemogenic endothelial cell,HEC)[6-7]。直至最近,de Bruijn 和Dzierzak 团队分别利用Runx1+23GFP和Ly6a-GFP 小鼠模型标记并分离生血HEC,并初步尝试揭示其分化规律及分子特征[8-9]。然而迄今仍无有效的表面分子进行HEC的有效富集,使得相关研究停滞不前。
我们研究团队采用单细胞孵育诱导移植策略结合细胞表面标志CD201的特异性高表达,首次实现了EHT 过程中关键细胞群体——HSC 前体的高效捕获,并在单细胞水平揭示了其分子表达规律,为精准富集和研究生血内皮群体提供了重要的范式[10]。在此基础上,本研究拟采用流式Index Sorting 新技术鉴定小鼠胚胎HEC的表面标志分子表达特征,并结合体外孵育实验及免疫组化染色技术验证HEC的造血分化潜能。
1 材料和方法
1.1 材料
C57BL 纯品系小鼠购自斯贝福生物有限公司,动物质量合格证号SCXK(京)2016-0002,饲养在军事医学研究院实验动物中心,饲养条件为无特异性病原菌环境(specific pathogen free,SPF),实验动物饲养设施合格证号为SYXK(军)2012-0021。
小鼠 FACS 抗体 CD31(MEC13.3)、CD43(S7)均购自 BD Biosciences 公司;CD41(MWReg30)、CD45(30-F11)、Kit(2B8)和 CD47(miap301)均购自eBioscience 公司;7-氨基放线菌素D(7-amino-actinomycin D,7-AAD)购自Invitrogen 公司;重组人血管内皮生长因子(rhVEGF-165)、小鼠干细胞生长因子(SCF)均购自Peprotech 公司;L-谷氨酰胺、胰蛋白酶、IMDM 培养基均购自Hyclone 公司;Ⅰ型胶原酶、牛血清白蛋(BSA)、转铁蛋白均购自Sigma 公司;巯基乙醇购自Gibco 公司;胰岛素购自Macgene 公司;台式高速离心机(Eppendorf 5804R)购自Eppendorf 公司;细胞培养箱(Thermo Forma K3111)购自 Thermo 公司;解剖镜(Leica S8APOLZ)购自莱卡公司;48 孔培养板/培养皿(Costar)、流式细胞仪购自BD 公司。
1.2 小鼠AGM区组织解剖
雄鼠与雌鼠合笼后,次日中午雌鼠阴道口检出精栓记为E0.5,d10(体节数为30~34 个)时解剖取出小鼠胚胎,在解剖镜下分离胚胎组织;孕鼠取出孕囊后,从两侧子宫角用镊子撕开,剥离胎盘,获得由卵黄囊包裹的胚胎;截去脐血管与卵黄血管后,从胚胎体的上下肢芽间截断背脊侧,去除原肠后获得含有胚胎AGM 区的组织,随后轻轻钝性分离AGM 区。
1.3 单细胞悬液制备
1.3.1 AGM 组织消化 0.1%的Ⅰ型胶原酶于37℃消化25 min,用含10%血清的IMDM 培养基中和,4℃、310 r/min 离心6 min,弃上清后重悬获得单细胞悬液。
1.3.2 流式分析和分选 将单细胞化后的细胞用含2%血清的PBS 清洗1 次,按照抗体说明书推荐量添加抗体,4℃混悬孵育抗体30 min。用含2%血清的PBS 洗1 次,标记7-AAD,室温孵育5 min,加入一定体积的含1%牛血清白蛋白(BSA)的PBS 稀释细胞溶液后,流式细胞仪分析或分选。
1.4 OP9-DL1基质细胞共孵育
OP9-DL1 细胞提前 24 h 铺到 48 孔板,分选之前更换加入含15%胎牛血清(FBS)、1% BSA、10 mg/mL 胰岛素、200 mg/mL 转铁蛋白、10-4mol/L 巯基乙醇、2 mmol/L L-谷氨酰胺、100 U/mL 青霉素、100 μg/mL 链霉素、100 ng/mL rhVEGF-165 和50 ng/mL SCF的IMEM 溶液,流式细胞仪分选单个目的细胞至铺好OP9-DL1 细胞的48 孔板中,置于CO2培养箱于37℃孵育7 d,显微镜下观察并拍照记录。
1.5 免疫组化染色
单细胞与OP9-DL1 细胞孵育7 d 后弃上清,用适量2%多聚甲醛溶液室温固定细胞15~20 min。①内皮细胞染色:固定后PBS 清洗1 次,孵育CD31 一抗4℃过夜,次日回收一抗,孵育辣根过氧化物酶二抗标记30 min,之后用DAB 显色(蓝色);②造血细胞染色:内皮染色后PBS 清洗3次,孵育CD45 一抗4℃过夜,次日回收一抗,孵育辣根过氧化物酶二抗标记30 min,之后用DAB 显色(棕色)。显微镜下分别统计具有造血和内皮潜能的孔数,采集照片。
1.6 统计学分析
流式细胞分析数据使用Flowjo7.6.1 软件处理,统计学数据采用Graphpad 软件处理。
2 结果
2.1 单细胞Index Sorting原理及使用
流式细胞Index Sorting 技术是一种全新的单细胞分选模式,在分离单细胞的同时,可以读取并存储每个细胞的所有蛋白荧光表达值和细胞散射参数特征。结合单细胞的功能实验数据或单细胞组学数据,借助强大的计算机存储和分析能力,可追溯分析每个目的细胞所独有的特征参数[11]。该技术的优势在于:①同时记录高达数十种细胞特征参数,在数百万细胞中可精准定位单个目的细胞,重复性好;②对于探索免疫表型未知的细胞群体具有极强的应用价值。
与以往单细胞分选技术相比,Index Sorting 技术较为完美地将单细胞流式分选、单细胞功能验证和单细胞组学有效结合在一起,使之成为一整套研究方案。目前单细胞Index sorting 技术较多应用于造血和免疫系统研究,而在其他研究领域应用才刚刚开始[12]。
本研究中,我们首先对BD ArialⅡ流式细胞仪进行软硬件升级改造,使之符合6~384 孔板分选操作的需求。BD ArialⅡ加装单细胞分选硬件模块的同时,升级操作至DIVA8 版本,同时扩展相应的计算机存储空间和内存以保证流式软件流畅运行。结果如图1显示,以48 孔板分选为例,操作界面右下方红框内为Index Sorting 选项,界面下方为分选目的细胞群体门及单细胞分选方式,界面上方显示并记录48 孔中每个细胞的流式特征参数。后续通过每个孔的单细胞体外实验数据结果,可追溯目的细胞所在流式群体门的位置,并直观标记在流式结果图上。
2.2 Kit+内皮细胞具有生血潜能
采用建立的单细胞Index Sorting 新技术,我们计划更精细地分析小鼠E10 AGM 区的HEC 群体。已有研究表明HEC 表达经典的内皮细胞表面分子CD31 和CD144(VE-cadherin),不表达公认的造血表面分子CD45、CD41 和CD43 等。Kit(CD117)作为成体小鼠骨髓造血干祖细胞表面标志,也可用于富集小鼠E11 AGM 区pre-HSC。提示应用 Kit 富集 HEC的可行性[13]。
流式分析表明CD41-CD43-CD45-CD31+Kit+在小鼠E10 AGM 细胞中的比率约为3%(图2A、B)。流式分选单个CD41-CD43-CD45-CD31+Kit+细胞,与基质细胞OP9-DL1 共孵育诱导培养7 d 后进行免疫组化染色,约12%(49/416)的细胞生成CD31+内皮管状结构,约31%(129/416)的细胞可产生CD45+造血细胞簇,提示具有生血潜能(图2C、D)。这部分研究结果同时表明,60%以上的Kit+细胞不具备生血或生内皮功能(图2E),提示仍须进一步探索富集HEC 表面分子。
2.3 表面分子CD47显著富集生血内皮细胞
我们前期研究发现表面分子CD47 部分表达在AGM 区血管内皮细胞及pre-HSC 上,分别通过富集CD47-和CD47+的内皮和pre-HSC,经体外诱导孵育结合小鼠移植实验发现,具有HSC 活性的细胞均富集在CD47+细胞群体中,提示CD47 可进一步用于标记发育阶段更早的HSC 相关群体。例如,在单细胞水平,它是否能识别具有生血潜能的HEC,而近期的研究表明AGM 区的造血祖细胞和HSC 均来源于HEC。
为了证实这一结论,应用流式细胞Index Sorting 技术的可回溯性功能,即在上述分选群体标志的基础上同时标记CD47 分子,后续根据体外孵育培养的结果,可以追溯我们关注的重要细胞群体的CD47 分子的表达情况。分析发现,CD41-CD43-CD45-CD31+Kit+的内皮细胞群体中,约60%的细胞表达CD47。此外,具有生内皮、生血潜能的CD41-CD43-CD45-CD31+Kit+细胞均富集在CD47+的细胞群体(图3A、B)。该结果提示CD47表达可将HEC 群体的精度显著提高1.5 倍(图3B)。

图1 48孔板单细胞Index Sorting分选操作界面
根据体外孵育诱导培养结果,我们进一步发现CD47 阳性的内皮群体中仍有60%以上不具备生内皮或生血能力,表明未来须通过我们已建立的流式细胞Index Sorting 技术继续发掘HEC的新表面标志分子,以进一步提高富集HEC的精度。
3 讨论
生血内皮群体是内皮向造血转化过程中极为重要的关键群体,因其数量极其稀少、命运转化时间窗口短暂、分子表型特征不明等因素,使得目前仍无有效手段去精准定位及富集该类细胞。现有研究提示,胚胎时期AGM 区主动脉血管内皮通过形成造血簇的方式产生造血干细胞的过程中还存在2 类造血干细胞前体。我们前期利用创新的单细胞孵育移植技术结合CD201 分子的特异性高表达,实现了造血干细胞前体高达30%的精度富集,本研究则进一步提供了全新的干细胞发育研究思维和范式。单细胞技术应用和开发中方法学的创新,将极大地推动造血干细胞发育研究领域的进展。因此,本研究建立了单细胞Index Sorting 技术,并探索寻找发育时间更早、表型更不明确的生血内皮群体。
同时,前期积累的大量造血干细胞发育全程的单细胞转录组测序数据,也为进一步发掘并富集出生血内皮群体提供了重要线索,如本研究发现Kit、CD47、CD201 等均能有效富集出具有生血潜能的内皮。这些研究基础将为后续进一步探索生血内皮提供重要的数据支持。综上,我们建立了单细胞Index Sorting 技术,并应用该技术发现具有造血潜能的生血内皮均富集在CD47+的内皮细胞群体中,CD47 分子将生血内皮群体的精度显著富集了1.5 倍以上。
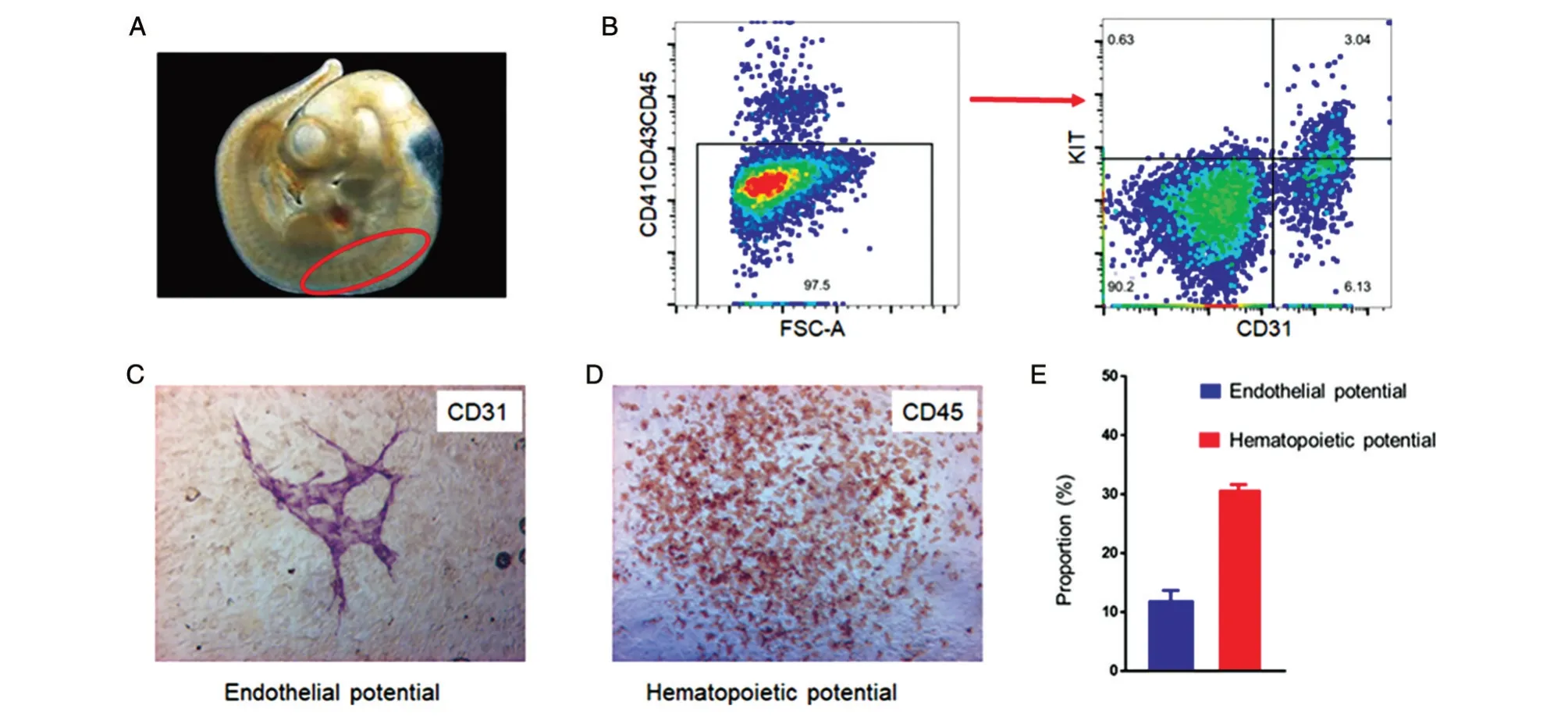
图2 OP9-DL1共培养后48孔板中单个CD41-CD43-CD45-CD31+KIT+细胞的分化潜能

图3 Index Sorting分析CD47富集HEC

