以CuO为氧载体处理市政污泥的化学链燃烧
张永一川
上海海事大学
0 引言
污泥是各级污水处理净化后所产生的含水量为75%~99%的固体或流体状物质,富含大量的有机物,其结构复杂,具有易腐性[1-5]。我国市政污泥具有结构复杂、产量大等特点,其中大多富含有机物成分,易腐蚀、散发恶臭,给环境带来二次污染[6-11]。
化学链燃烧技术(CLC)是目前国际上最具良好发展前景和空间的新型处理技术[12],能抑制氮氧化物和硫化物气体的释放,含碳气体的挥发份(CO、CH4等)燃烧产物仅为CO2和H2O,只需经过简单的冷凝处理和捕获即可得到CO2气体,从而以较少的能源消耗和成本满足污泥的降解处理要求,不仅可以捕捉高浓度的CO2,还可以收集凝结出的水,实现能量的阶梯利用[13-16]。
氧载体与燃料的混合比例不同和制备的方法不同均会对氧载体的性能产生较大影响[17-21]。邓贵先[22]采用赤泥作为氧载体用于甲烷的化学链燃烧;钟思梅[23]将CaO添加到不同酸性环境中制备CaSO4-CaO复合氧载体;肖军[24]在单流化床反应器上,以赤铁矿作为氧载体探究污泥化学链燃烧中氮迁移的转化特性;东南大学的陈倩文[25]以赤铁矿为氧载体提高污泥中碳元素的转化率;田红景[26]在分离CO2时以硫酸钙为氧载体,发现浸渍有微量Fe2O3和NiO的CaSO4复合型载氧体同气体、固体燃料的反应速率加快,反应时间大大缩短,Fe2O3改善氧载体的反应性能方面优于NiO。复合金属氧化物氧载体可有效弥补单金属之间的缺陷,增强反应活性,提高载氧能力,有效抑制高温下焦炭的沉积和烧结现象,在提高反应活性的基础上增强了反应的稳定性[27-29]。
单级反应流化床中,较轻的固体燃料颗粒在燃烧中有可能被带出反应器,导致气体转化、燃料燃烧不完全,燃烧效率降低和实验误差增大。为此,采用双级燃料反应器可有效避免上述问题,并以污泥为基体、CuO为氧载体,研究反应器温度和不同氧载体CuO的质量分数对污泥化学链燃烧的性能影响,采用热重分析和HSC模拟反应器内的气化产物和种类对提高化学链燃烧效率和市政污泥的有效处理提供一定的参考价值。
1 实验
1.1 实验材料及制备
实验选用的基体材料市政污泥由上海市污水处理厂提供,将收集的污泥样品在常温下进行简单的过滤和脱水干燥,一段时间后筛选出合格的污泥样本,污泥颗粒的直径为0.20mm~0.45mm。污泥样品的工业分析、元素分析及灰分析如表1所示。
将本地铝业提供的赤泥干燥蒸发后,磨碎成粉末状,加入比例为1∶1的Cu(NO3)2·3H2O制成饱和溶液并在75℃恒温水浴中加热蒸发;在干燥箱中完全干燥;投入900℃的马弗炉煅烧加热;筛选出100μm~200μm CuO氧载体。氧载体的化学成分分析见表2。其中CuO为反应过程中的活性成分,少量的Fe2O3、AL2O3和SiO2在反应中起到支撑氧载体的作用并提高反应性,防止氧载体积碳,提高氧载体的机械强度。

表1污泥的工业分析和元素分析(质量分数%)
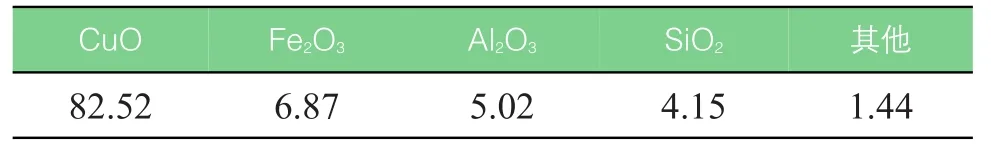
表2 CuO氧载体化学组成成分(质量分数%)
结合市政污泥的元素分析和工业分析确定污泥分子式,污泥中主要有C、H、O、N、和S五种元素。结合样品的含水量,计算表格如图1所示,分子式为:C28.933H52.669N1.054S0.114O5.871(H2O)2.778。
1.2 实验装置及软件
1.2.1双级燃料流化床
实验装置采用双级燃料流化床,反应系统如图2所示。吹入惰性气体吹扫排出装置内空气,检查实验装置气密性,将市政污泥与不同质量分数的CuO混合均匀置于进料装置中,当温度与流量稳定后进行化学链燃烧实验。污泥在一级燃料燃烧反应器中与CuO氧载体发生反应,还原反应过程结束后,空气反应器新氧化的氧载体与未完全转化的燃料和一级燃烧产物在第二级反应器中继续反应,保证了燃料和热解产物中可燃物质的充分反应,并完成一次化学链燃烧中氧载体的循环。

图1 污泥分子式计算表格
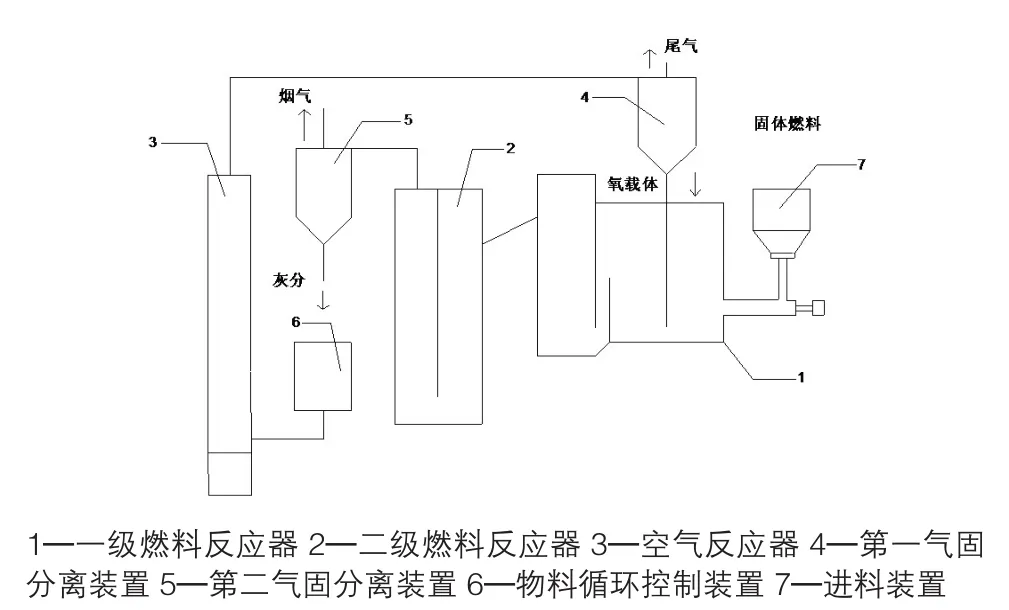
图2 流化床反应系统
1.2.2热重实验
热重分析法使用德国生产的NETZSCH STA 409 C同步热分析仪,升温速率为25℃/min,反应终温是750℃~850℃,反应气氛为纯N2。从室温加热到100℃并恒温,确保样品中的结晶水完全析出,样品完全干燥。然后以温升速率为25℃/min加热到终止温度,持续恒温30min,确保污泥样品与CuO氧载体充分反应,使污泥热解出的挥发份燃烧完全,使反应充分。
1.2.3 HSC热力学模拟
使用HSC Chemistry4.0软件,得到反应过程中物质的变化趋势和百分比含量,从变化趋势和结理论得出CuO不同质量分数以及反应温度对反应产物含量的影响。
2 实验结果与讨论
2.1 数据处理公式及方法
挥发分特性指数

式(1)中,Tmax为挥发分最大释放速度峰值时对应的温度;(dW/dt)max为挥发分最大释放速度峰值;△T1/3为在DTG曲线上对应于(dW/dt)/(dW/dt)max=1/3时的温度区间。
(2)着火温度Ti的确定
着火温度的计算用TG-DTG法确定,即在DTG曲线上,过第二次峰值点作垂线与TG曲线交于一点,过该点作TG曲线的切线,该切线与失重开始时平行线交点所对应的温度定义为着火温度Ti。
(3)CuO与污泥完全反应所需的质量
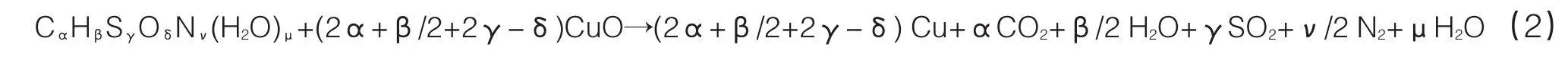

式中的α、β、γ、δ、ν、μ分别是污泥分子式中的C、H、S、O、N和结晶水的个数,根据计算表格已确定分别等于 28.933、52.669、1.054、0.114、5.871和2.778,因此1 000g污泥样品完全反应需要CuO氧载体78.56mol。
2.2 反应温度的影响
在750℃~850℃温度区间内,每隔25℃为一个温度点,分别在反应器内和出口取样,取样后去除惰性气体成分,气体组分质量分数如图3(a)所示。
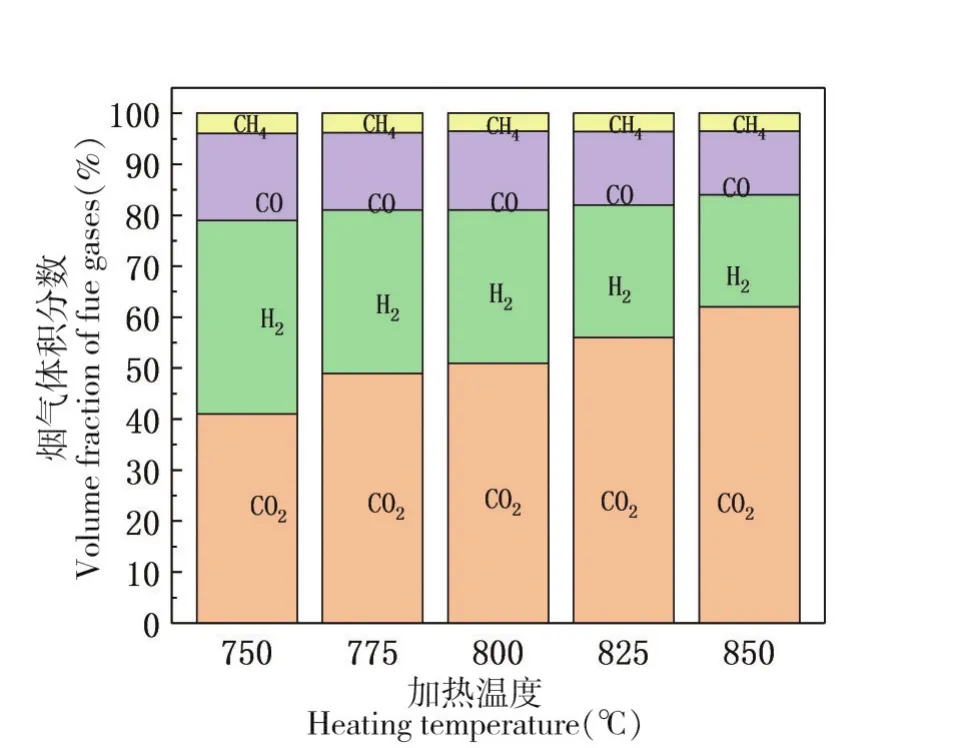
图3 (a)反应器内烟气组分质量分数
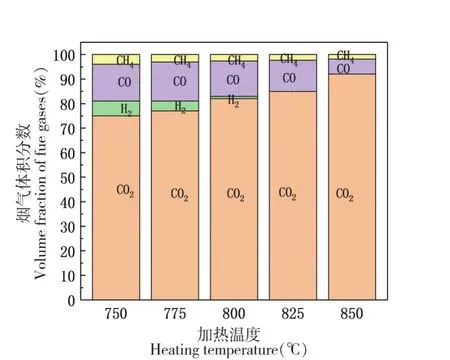
图3 (b)出口烟气组分质量分数
横向对比同一个加热温度,反应器内和出口烟气的浓度组分有很大差异,最直观的是可燃气体H2的质量分数和CO2的质量分数。通过对图3(a)的分析,随着反应温度的升高,CO和H2的质量分数呈下降趋势,CO2的质量分数呈逐渐上升趋势,其中变化趋势最明显的是H2和CO2;CO2的质量分数从41%升高到62%;H2的质量分数从38%下降到22%;CO的质量分数从17%下降到12.5%;CH4的质量分数变化并不明显,随着反应温度的增加CH4仅仅下降了0.5%。对于出口烟气,如图3(b)所示,可燃性气体H2的比重大幅减小,CO2所占比重最大,随着加热温度的升高,CO2的质量分数从75%上升到92%;CO的质量分数从15%下降到6.1%;H2在750℃的加热条件下,质量分数为6%,随着温度的升高,在825℃的出口烟气中已经不存在H2;在850℃的温度下CH4的质量分数下降到了1.9%,对比同温度下的中间抽气中CH4的质量分数下降了1.6%。因此判断CuO氧载体与可燃气体的反应是有先后顺序的,CuO主要参与了H2和CO的化学反应,只有少部分参与到了CH4的反应当中,相对于CO和H2,CH4的反应活化性不高,因此导致无论是中间抽气还是在出口烟气中,CH4的质量分数均变化很小,H2和CO没有直观变化。由此说明在污泥加热裂解的可燃性气体中,CH4的含量远小于H2的含量,CH4仅可由污泥热解产生,而CO和H2在复杂的加热反应中,高温水煤气反应、CO与水蒸气的反应、固定焦炭和CO2的反歧化反应(涉及的反应公式2-5)都会生成CO和H2。由于加热温度没有达到一定值,因此涉及生成CH4的H2与CO反应并不成立。所以在可燃气体的质量分数上CH4远低于CO和H2。无论是气体取样位于反应器中部还是出口处,可燃性气体的质量分数都是呈现下降趋势,稳定气体CO2的含量逐渐上升,说明提高加热温度促进了CuO和污泥的反应;加快了可燃性气体的燃烧。从分子运动学出发,温度越高,分子运动越剧烈,分子间的引力减小,分子的排列会变得散乱,分子间的间隔增大,使分子有足够的空间和位置进行运动。分子运动的速率增加,加剧了分子的运动,提高了可燃性气体与氧载体更多的接触概率并延长了接触时间,提高了污泥热解的效率。由此有效促使污泥的化学链燃烧,减小出口烟气中可燃性气体所占的质量分数,提高了CO2的捕获率和捕获气体中CO2的纯度。

图4显示了碳捕获率和温度变化的关系,可以直观看出碳捕获率随温度的升高而升高,从750℃的97%上升到850℃的99.7%。污泥中含有一定质量的固定碳,加热温度越高,固定焦炭的气化速率越快,此外,提高反应温度除了加快固定焦炭的气化速率,还能提高氧载体的反应活性。双级燃料反应器利用载氧体的催化作用,加快污泥热解的同时,催化气化产物的反应,提高出口烟气中CO2的浓度和碳捕获率。

图4 碳捕获率
2.3 污泥热解TG/DTG分析
在氮气气氛中污泥热解、温升以及TG/DTG曲线如图5(a)和图5(b)所示。
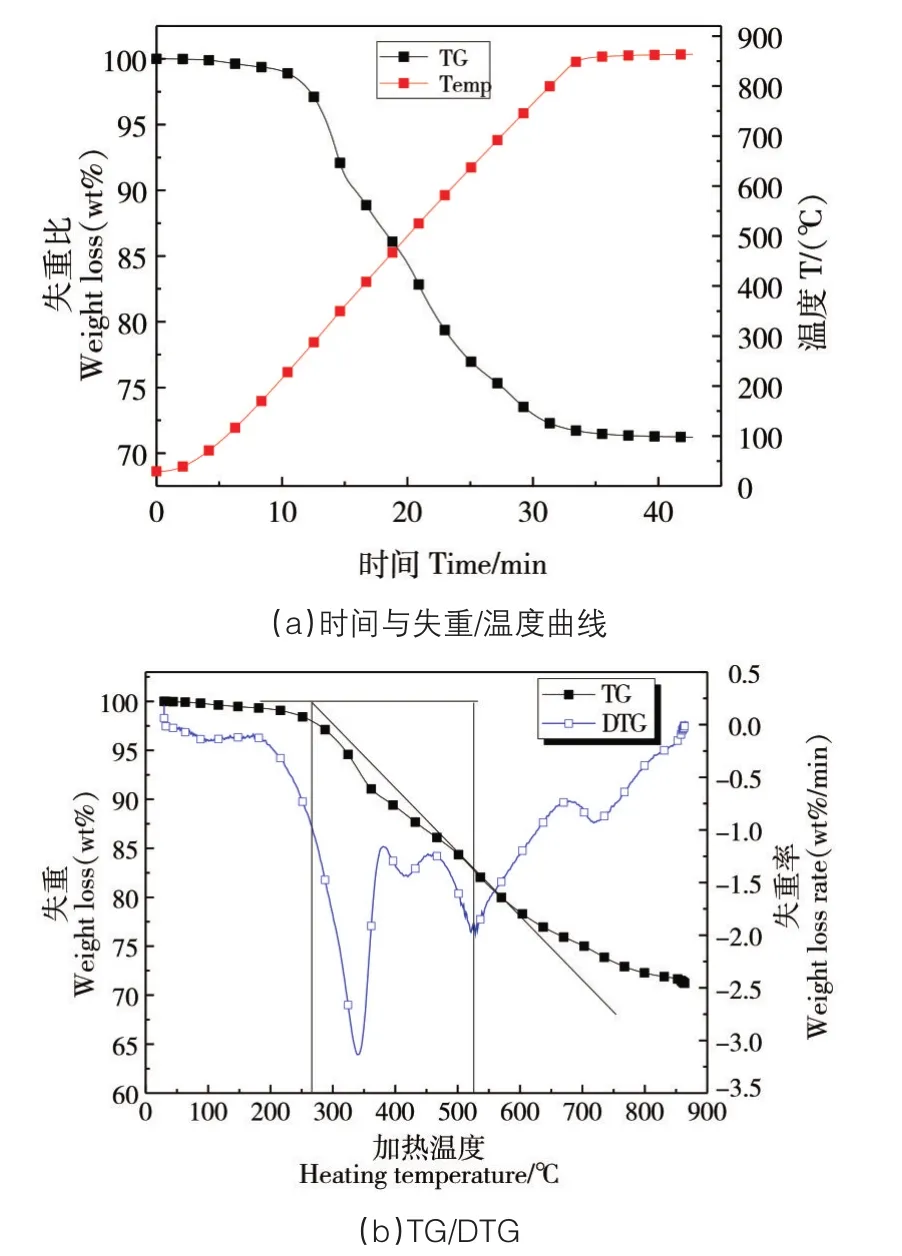
图5 TG/DTG分析图
图5(a)为污泥热解失重和加热温度随时间变化的曲线,图5(b)为污泥热解的DTG/TG曲线对比。反应过程可分为预热干燥、一次热解、二次热解及燃尽4个阶段。预热干燥阶段中,污泥开始失去液态水,随着水分的析出,污泥样品逐渐干燥,TG和DTG曲线相对平稳,说明水分占样品总质量较小,最大失重速率仅为0.0 016wt%/min左右。对应温度340℃出现第一次峰值点,失重速率达到了3.13wt%/min。第一次失重点出现的时间段污泥样品中挥发份析出以及挥发份的裂解,样品中含碳化合物的化学键开始断裂,形成固体产物和气体产物。固体产物主要是固定焦炭,而气体产物以CH4和H2O(g)为主。温度升高到525℃,出现第二次峰值点,最大失重速率为1.95wt%/min,第二次峰值点的出现是随着温度的升高样品中固定碳化学键的进一步断裂,同时,随着反应温度的升高,一次反应生成的CH4、H2O(g)、CO和CO2等相继达到了反应的条件,以固定C和H2O(g)的高温水煤气两步反应,固定C与CO2的反歧化反应生成CO,都会使失重速率第二次升高。随着反应温度上升到850℃,失重速率近乎为0wt%/min,反应结束所剩余的质量基本为污泥中不挥发不反应的灰渣。由于加入氧载体CuO,污泥中自身析出的挥发份之间通过CuO的催化而相互反应,有效促进了污泥的进一步热解,使污泥热解更为完全,且促进了热解产物的相互作用,减少有毒气体产物CO的浓度,提高了碳的捕获率。
根据公式(1)计算挥发分释放特性指数D,其中着火温度的确认方法已经说明,通过图6可以确定着火温度Ti=267.5℃、挥发分最大释放速度(dW/dt)为3.13wt%/min、挥发分最大释放速度峰值时对应的温度Tmax为340℃、ΔT1/3=353.38℃,所以挥发分释放特性指数D=2.6×10-5。挥发分特性指数说明污泥中挥发分含量很高,挥发分析出较为容易,且峰值点失重速率很大,导致着火较为容易、着火温度低,反应开始不久即着火剧烈,有利于污泥样品与氧载体CuO的反应完全,样品燃尽。
2.4 HSC热力学模拟产物变化趋势
由图6可以看出,加入足量的氧载体CuO可以有效地抑制有毒气体CO的排放,含碳的气体产物中CO2的质量分数达到了99.8%,当不加入CuO或加入的CuO质量分数不足时,产物中CO比例较高,且CO2的捕获率很低。说明CuO氧载体可与污泥热解阶段析出的气态产物完全反应,由于反应的活跃性和反应条件不同,污泥样品中的固定焦碳和CuO作用,焦炭被完全消耗,所以产生CO的高温水煤气反应以及反歧化反应都无法进行。足量的CuO有效消耗了产生CO所需的反应物。CuO释放的晶格氧反应活性更高更易于与气化产物接触而促进反应持续快速进行,由于氧载体氧化还原性,令反应活性升高,降低了污泥热解的难度,加快了污泥的气化反应。
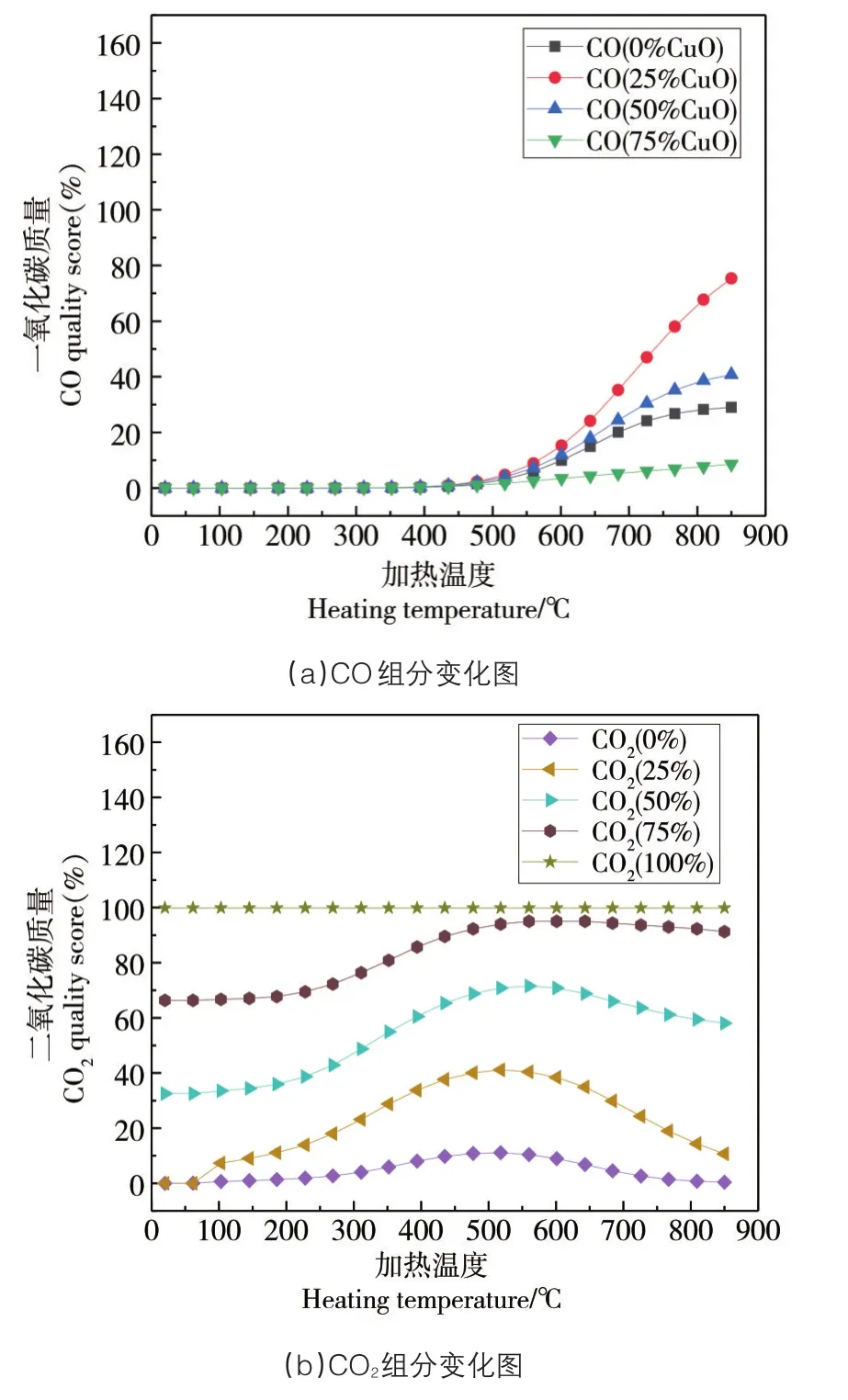
图6 CO和CO2质量分数与加入氧载体CuO质量分数的关系
图7(a)为新鲜氧载体,其质地紧密、结构紧凑、孔隙很少,可能是制备过程中含有的少量Fe2O3和Al2O3熔融导致CuO氧载体整体团聚在一起的原因。图7(b)为850℃反应后的载氧体整体呈现蓬松多孔的结构,孔隙增大、增多,表面有许多凹凸并在内部形成空腔。在化学链燃烧过程中,氧载体释放晶格氧,导致多孔的晶体结构形成少量CuO转化为Cu2O和Cu2S,导致晶相组织结构发生变化。释放晶格氧后的多孔结构有利于还原后的氧载体与氧气的再度结合,迅速形成新的氧载体。

图7 CuO氧载体的SEM表征
3 结论
对 分 子 式 为 C28.933H52.669N1.054S0.114O5.871(H2O)2.778的污泥样品进行化学链燃烧实验研究,以双级燃料反应器为装置,浸渍法制备的CuO为氧载体,热重分析和HSC热力学模拟为方法,探究了反应温度和加入不同质量分数CuO对反应的影响。
(1)反应温度的增加提高了CuO的反应活性,加快了污泥的热解和气化速率,降低了出口烟气可燃性气体(CH4、H2)的质量分数,提高了CO2的捕获率和CO2气体的质量分数,有效促进了气体产物的转化。
(2)基体挥发份初析温度Ts=190℃、挥发份最大释放速度峰值(dW/dt)max=3.13 wt%/min、挥发份最大释放速度峰值所对应的温度Tmax=340℃,样品基体的着火温度Ti=267.5℃,挥发分特性指数D=2.6×10-5,有效降低了污泥样品反应的初始热解温度,且峰值点失重速率很大、着火较为容易、着火温度低、加快反应速率,有利于污泥样品反应完全,加快污泥样品的处理速度。
(3)加入足量氧载体CuO加快了碳转化速率,有效地消耗了产生CO所需的反应物,提高了出口气体中CO2的含量,所占比例高达99.8%。不产生副产物有毒有害气体CO,有利于CO2的捕捉和冷凝水的收集。氧载体反应后的SEM表征显示,氧载体由于释放晶格氧形成了多孔、蓬松、空腔的结构,有利于捕获氧气再次氧化形成新的氧载体,满足氧载体循环利用的原则,具有较好的循环稳定性。

