TAZ促进胃癌中血管生成及相关机制的研究*
白婧如 赵秀兰 孙冉 张丹芳 刘铁菊 张艳辉 董学易 车娜 梁晓辉 程润芬刘爽
胃癌是全球第五大常见癌症,尽管随着诊断与治疗技术的不断提高,胃癌的发病率有所下降,但其总体预后仍较差[1]。肿瘤的新生血管为肿瘤细胞提供丰富的营养,在肿瘤的生长、侵袭、转移中发挥重要作用[2]。内皮依赖性血管是最为“经典”的血管生成模式,很多信号分子参与其形成的调控,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)是较为明确的可以促进其形成的调控因子,而VEGF的分泌又受到多种因子的调控[3-4]。
β-catenin是典型Wnt通路的效应分子,广泛存在于内皮细胞、成纤维细胞等,与多种恶性肿瘤的发生发展密切相关[5]。β-catenin通常定位于细胞膜,参与细胞骨架的形成。在肿瘤细胞中,β-catenin表现为膜表达的缺失,其细胞核的异位表达激活Wnt信号通路,从而入核与不同靶基因结合,在肿瘤中发挥不同作用[6]。多项研究表明,β-catenin在多种肿瘤中可以促进VEGF的分泌,进而促进肿瘤血管生成[7-9]。
TAZ,又称为WWTR1(含有WW结构域的转录调节因子1),作为Hippo信号通路的关键下游效应分子,最初通过其与14-3-3蛋白质相互作用而被发现[10]。近期研究表明,TAZ作为一种转录共激活剂,在多种肿瘤中高度表达,发挥着不同的致癌作用[11-12]。此外,越来越多研究发现TAZ在血管生成中发挥重要作用[13-14]。
目前,TAZ在胃癌中的作用机制尚未明确,关于TAZ与β-catenin在血管生成中作用的研究仍较少。本研究旨在通过分析探讨TAZ在胃癌中的作用机制,为胃癌血管生成方面的研究提供新的见解。
1 材料与方法
1.1 材料
1.1.1 组织标本 收集天津医科大学总医院和天津医科大学肿瘤医院2001年1月至2013年1月经手术切除后送检的胃癌标本150例,所有患者术前均未接受放化疗。
1.1.2 细胞株 人胃癌细胞系MGC803购自中国医学科学院基础研究所,MKN28购自江苏凯基生物技术股份有限公司,HUVEC细胞购自美国ATCC公司,293T细胞购自上海复旦大学中山附属医院。
1.1.3 实验试剂 DMEM、RPMI-1640和Opti-MEM培养基均购自美国Neuronbc公司,胎牛血清(FBS)购自美国Gibco公司。慢病毒包装试剂盒和质粒均购自美国GeneCopoeia公司,TAZ过表达质粒(EXZ0976-Lv201),TAZ过表达对照质粒(EX-NEGLv201),TAZ降表达质粒(HSH017916-LvRH1GP),TAZ降表达对照质粒(CSHCTR001-1-LvRH1GP)均购自美国GeneCopoeia公司。Transwell小室购自美国FALCON公司,Matrigel胶购自美国Invitrogen公司。兔抗人TAZ抗体购自美国Abcam公司,兔抗人βcatenin抗体购自美国Abcam公司,鼠抗人CD34购自北京中山金桥生物技术有限公司,小鼠抗人GAPDH抗体购自美国Santa Cruz公司,二抗购自北京中山金桥生物技术有限公司。
1.2 方法
1.2.1 免疫组织化学法 石蜡包埋,切片,每片厚度5µm。切片经二甲苯脱蜡,无水乙醇脱苯后,用3%甲醇过氧化氢封闭内源性过氧化物酶30 min,之后95%乙醇-80%乙醇-无水逐级脱水,EDTA 9.0抗原修复液微波修复,血清封闭于室温20 min,滴加一抗TAZ(1:200)于4℃孵育过夜。次日用PBS液冲洗3次,滴加兔二抗孵育1 h后,DAB显色15 min,水洗,苏木复染细胞核,水洗,脱水透明,封片。
判定标准:采用Mattern积分法对免疫组织化学染色结果进行评分,每个标本在显微镜(×400)下,随机选取10个视野,分别记录标本的阳性细胞百分比及染色强度。阳性细胞百分比判定规则如下:阳性细胞<25%为0分,25%~50%为1分,51%~75%为2分,>75%为3分。将染色强度按以下标准分为0~3级:无阳性着色为0,浅黄色为1级,黄色为2级,棕黄色为3级。最后通过染色强度与染色范围的乘积确定最终得分,<3为阴性,≥3为阳性。
1.2.2 细胞培养 HUVEC、MGC803、293T及MKN28细胞培养:添加10%FBS、1%双抗(100 U/mL青霉素,100 U/mL链霉素)的DMEM或RPMI-1640培养基。细胞均培养于37℃、5%CO2培养箱中。
1.2.3 细胞转染及建立稳转细胞系 常规方法培养293T细胞后,用含灭活血清培养基继续培养2~3 d,根据慢病毒试剂说明书添加试剂与TAZ上下调质粒,之后待293T细胞中观察到荧光颗粒后,收集病毒液,并做标记。将胃癌细胞传代于6孔板中,用含灭活血清的培养基培养24 h,然后按照转染试剂说明书添加相应试剂及病毒液,12 h后更换普通完全培养基。转染48 h后用荧光倒置显微镜观察转染效率,用嘌呤霉素进行药筛。
1.2.4 共培养及条件培养基的制备 HUVEC与肿瘤细胞共培养实验需要采用条件培养基(conditioned medium CM)。用上述稳定转染的肿瘤细胞在无血清培养基中饥饿培养24 h,然后用5%FBS培养基替代。取其上清液,1 000 r/min离心10 min去除细胞碎片,用0.22µm滤器过滤后即为条件培养基,于4℃保存。
1.2.5 Western blot法检测 将细胞裂解后提取的蛋白等量上样于10%聚丙烯酰胺分离凝胶中电泳,之后湿转90 min于PVDF膜。用含5%脱脂奶粉的TBST室温封闭1 h后,添加抗体TAZ(1:500),β-catenin(1:5 000),GAPDH(1:2 000),4℃孵育过夜。次日待恢复室温后回收一抗,TBST洗膜3次,添加相应二抗孵育1~2 h,洗膜3次后加发光液,避光显影,拍照。应用Image J软件分析蛋白条带。
1.2.6 Transwell迁移实验 实验用无血清培养基制备细胞悬液,并调整细胞密度至1×105个/mL。小室上层内加入200µL细胞悬液,下层内加入500µL含有血清的完全培养基,置于培养箱中培养24 h后用冷甲醇固定20 min,擦除上层细胞后用0.4%结晶紫染色,镜检,计数并统计数据。
1.2.7 三维培养 实验前将培养基与Matrigel胶1:1混合,添加40µL平铺于96孔板,放置培养箱中过夜。次日,消化细胞并重悬至1×105个/mL,将细胞悬液以200µL/孔加入到96孔板内,之后放入培养箱中培养,待显微镜观察成管后拍照计数。
1.2.8 MTT实验 实验按照试剂盒说明书进行,将培养好的96孔板于酶联免疫检测仪上,检测每孔490 nm的吸光值(OD),记录统计。
1.2.9 酶联免疫吸附试验(ELISA) 将转染后的胃癌细胞及其相应的对照组细胞提前无血清饥饿培养后,分别收集上清液,按照ELISA试剂盒说明书按步骤操作,设计3个复孔,最后加入终止液反应30 min后,用酶标仪读取450 nm OD值。
1.3 统计学分析
上述实验均重复3次,采用SPSS 22.0软件进行统计学分析。计量资料分析均采用t检验法,应用Kaplan-Meier法进行生存分析,并用χ2检验统计TAZ与临床病理资料的关系。以P<0.05为差异具有统计学意义。
2 结果
2.1 TAZ在胃癌中的表达
用免疫组织化学法检测TAZ、β-catenin在150例胃癌组织中的表达水平,结果显示TAZ主要表达定位于肿瘤细胞胞核内,β-catenin表达于细胞膜和细胞核中(图1)。150例胃癌组织中TAZ阳性表达率为43%,βcatenin阳性表达率为54.7%。此外,在TAZ阳性组中βcatenin阳性表达率为67.2%,在TAZ的阴性组中βcatenin阳性表达率为32.8%,β-catenin在TAZ阳性组中表达明显高于TAZ阴性组,TAZ的表达与β-catenin具有相关性,差异具有统计学意义(表1)。
通过免疫组织化学法用CD34对内皮细胞进行标记,采用t检验比较高表达TAZ组与低表达TAZ组微血管密度(microvessel density,MVD)计数。结果显示,高表达TAZ组MVD数量明显多于低表达TAZ组,TAZ的表达与MVD具有相关性(图2,P<0.05)。
分析TAZ与150例胃癌患者临床病理资料的关系。结果显示,TAZ的表达与年龄、性别和肿瘤直径大小无关,而与肿瘤分级、TNM分期和远处转移及复发相关(表2)。此外,Kaplan-Meier生存分析结果表明,TAZ表达阳性患者较TAZ阴性患者的生存时间相对较短,差异具有统计学意义(P=0.028,图2)。

图1 免疫组织化学法检测人胃癌组织中TAZ与β-catenin表达情况(×200)

表1 TAZ与β-catenin的相关分析 例

表2 TAZ的表达与胃癌临床病理特征的关系 例
2.2 TAZ促进内皮细胞成管、增殖及迁移的能力
通过对共培养的内皮细胞进行三维培养,结果显示,内皮细胞与TAZ上调的MKN28细胞CM共培养后,成管能力较对照组明显增强,相反,内皮细胞与TAZ下调的MGC803细胞CM共培养后,成管能力较对照组明显减弱。
Transwell迁移实验结果显示,TAZ下调组的内皮细胞迁移数量少于对照组,而在TAZ上调组中,内皮细胞迁移数量明显较对照组增多,差异具有统计学意义(P<0.05,图3)。
MTT实验结果见图4,TAZ上调组较TAZ下调组更有利于内皮细胞的增殖,TAZ上调后,内皮细胞的增殖能力明显增强,而下调肿瘤细胞中TAZ的表达,内皮细胞的增殖能力减弱。

图2 胃癌中TAZ与MVD的关系及生存分析图

图3 TAZ对内皮细胞管道形成能力及迁移能力的影响
2.3 TAZ表达升高增强胃癌细胞中β-catenin的表达
细胞免疫荧光结果显示,在MKN28细胞系中,上调TAZ的表达,β-catenin的表达也随之增强,而在MGC803细胞中,下调TAZ的表达,β-catenin的表达也降低。
Western blot结果与免疫荧光结果相一致,转染TAZ过表达质粒的MKN28细胞,与对照组相比,βcatenin的表达水平上升;转染TAZ降表达质粒的MGC803细胞,β-catenin的表达水平较对照组降低(图5)。
2.4 TAZ表达升高促进VEGF蛋白的表达
通过ELISA法检测MKN28(过表达TAZ或对照)和MGC803(下调TAZ或下调对照)中VEGF蛋白的表达情况。结果显示,MKN28细胞中TAZ的过表达与对照组相比,VEGF表达增加,MGC803中TAZ下调明显抑制了VEGF的表达(图6)。
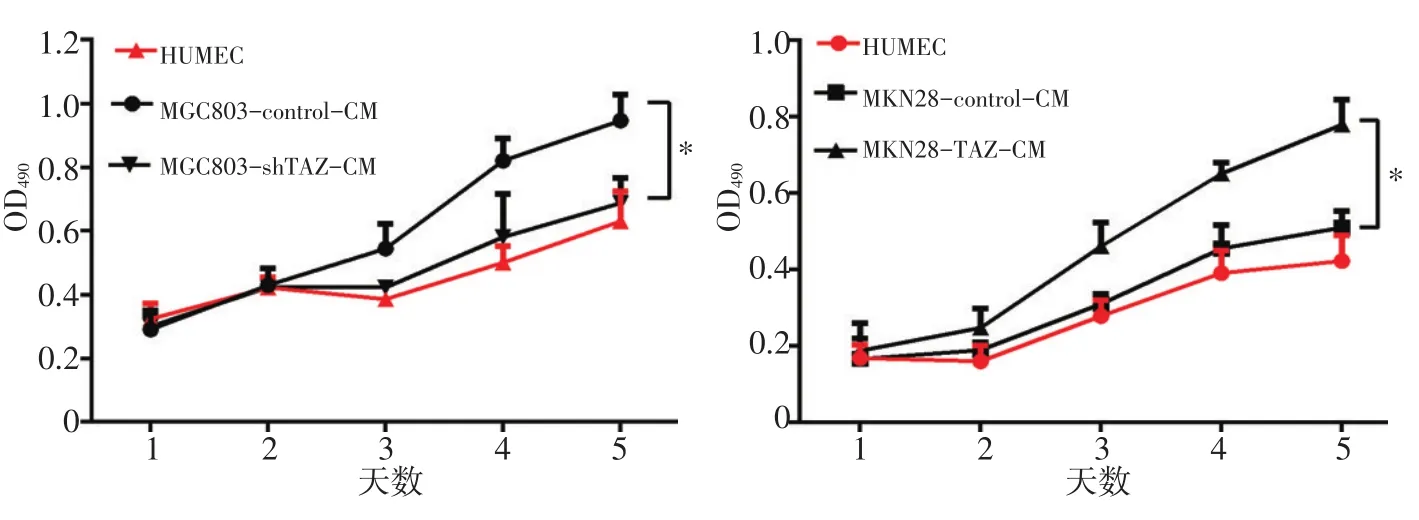
图4 TAZ对内皮细胞增殖能力的影响;

图5 免疫荧光与Western blot检测TAZ与β-catenin的表达变化
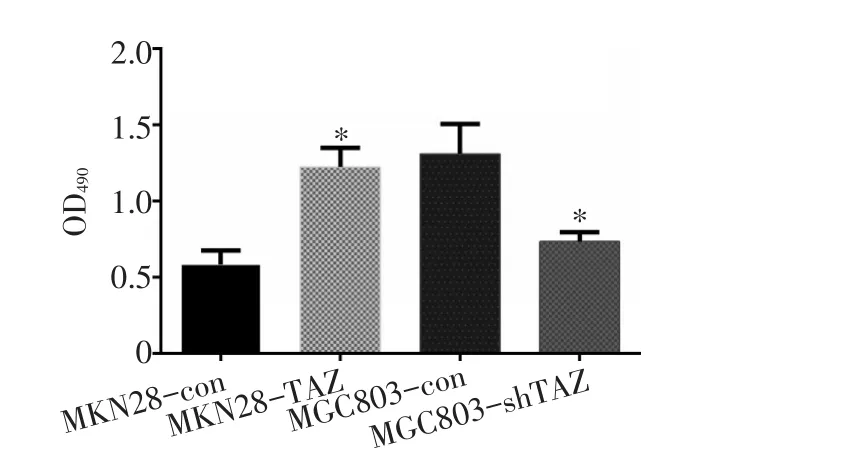
图6 ELISA法对各组肿瘤细胞培养基中VEGF因子检测情况;*:P<0.05
3 讨论
近年来,TAZ被发现在多种肿瘤中表达水平升高,如乳腺癌、肺癌、大肠癌和胶质瘤等,通过多条信号通路途径在不同的肿瘤中发挥着致癌作用。在Hippo通路激活后,TAZ被LATS1/2磷酸化,由此在细胞质中保持静止状态。相反,Hippo通路未激活或由多个内在和细胞外信号抑制其作用时,导致TAZ的去磷酸化和核定位[10,12]。有研究表明,TAZ在乳腺癌中高表达,上调TAZ促进乳腺癌细胞上皮间质转化(epithelial-mesenchymal transition,EMT)、侵袭迁移及增殖等[15]。TAZ通过子宫内膜癌细胞中GAB2的中间体,从而进一步调节PI3K/AKT途径[16]。此外,高表达TAZ被发现存在于非小细胞肺癌中,且与其分化程度差、预后差、生存期短有关[17]。本研究中发现TAZ在胃癌组织中高表达,且与肿瘤分级、转移等相关。
大量研究表明,TAZ在调控血管生成中发挥重要作用[13]。在小鼠的视网膜中敲除YAP/TAZ基因,会导致小鼠视网膜血管发育缺陷[18]。YAP/TAZ还可以通过调节内皮细胞增殖和重排,从而促进新生血管的稳定性[19]。在肿瘤中TAZ通过Hippo、Wnt和GPCR等信号通路对肿瘤的分化、转移、生长和干细胞特性的维持发挥重要作用[20]。本研究通过免疫组织化学法用CD34对内皮进行标记,进行MVD计数。结果显示,TAZ蛋白在胃癌中的表达与MVD相关,提示TAZ可能在胃癌血管生成中发挥作用。在共培养后进行一系列细胞功能实验发现,内皮细胞与TAZ高表达的胃癌细胞共培养后,其成管、增殖和迁移能力得到促进。免疫组织化学法检测发现,在人体胃癌标本中β-catenin表达与TAZ表达具有高度相关性。
多项研究表明,β-catenin为Wnt信号通路中的关键因子并参与基因的调控。TAZ在细胞质中磷酸化状态能抑制Wnt/β-catenin靶基因的表达,而核TAZ脱磷酸化可激活Wnt/β-catenin通路[21]。来自大肠杆菌的脂多糖通过Wnt/β-catenin诱导的TAZ升高刺激人牙周膜干细胞的成骨分化[22]。当Wnt信号通路激活时,β-catenin向胞核内转移,从而与T细胞因子(transcription factor,TCF)等结合发挥作用[5]。活化的β-catenin易位至细胞核并与TCF复合以促进VEGFA的转录,表明Wnt/βcatenin信号传导调节血管形成[8]。此外,有研究表明,在VEGF启动子区域发现有TCF结合元件,进一步表明β-catenin对VEGF的表达存在一定的调控作用[9]。VEGF主要通过与其受体特异性结合,促使内皮细胞内的信号转导,微血管新生,最终形成新的肿瘤血管网[23]。本研究通过Western blot法和免疫荧光检测结果表明,TAZ的上调可以促进胃癌细胞中β-catenin的表达,相反,降表达TAZ后,β-catenin表达随之降低。此外,通过ELISA实验发现,在胃癌细胞系中上调TAZ的表达促进VEGF蛋白的表达。
综合上述,TAZ在胃癌组织中高表达,且TAZ通过与β-catenin的相互作用,促进VEGF的表达,进而促进内皮细胞的增殖和迁移。本研究从人体组织标本与体外细胞实验两部分探讨了TAZ在胃癌血管生成中的作用,证实了TAZ与β-catenin的相关性。此外,本研究对TAZ在胃癌发生发展中的调控作用进行探究,为胃癌血管生成方面的研究提供新的思路与见解。但是肿瘤血管生成是一个综合而复杂的过程,关于TAZ在胃癌中如何调控β-catenin的表达以及相关通路的相互作用亟需进一步的研究。
——一道江苏高考题的奥秘解读和拓展

