油茶籽饼粕多糖的提取工艺优化及结构鉴定
郭玉华 徐云 张雪茹 金日生

摘要[目的]以油茶籽饼粕为原料,优化油茶籽饼粕多糖提取工艺,并对纯化后的多糖进行结构鉴定。[方法]根据单因素试验结果,以超声时间10、15、20min;料液比1∶15、1∶20、1∶25;浸提温度50、60、70℃;浸提时间60、90、120min为影响因素,多糖得率为指标,通过正交试验设计优化提取工艺。粗多糖经脱色,脱蛋白处理后,再经过DEAE-52纤维素阴离子交换树脂纯化,并对纯化多糖组分进行紫外光谱和高效液相色谱分析。[结果]超声时间10min,料液比1∶20,浸提温度60℃,浸提时间120min为最佳工艺条件,此条件下油茶籽饼粕多糖的平均得率16.76%。粗多糖经脱色、脱蛋白、纤维素阴离子交换树脂柱层析得到纯化组分CCP。紫外光谱表明CCP为较纯的均一多糖组分,高效液相色谱表明CCP的单糖组成为甘露糖和葡萄糖,其物质的量比为:1.91∶1.00。同时还含有少量的鼠李糖。[结论]该工艺优化合理,多糖的结构得到了初步的确证。研究为油茶籽饼粕多糖的后续理化活性分析、结构表征提供了理论依据。
关键词油茶籽饼粕;多糖;工艺优化;分离纯化;结构鉴定
中图分类号TS201.2文献标识码A
文章编号0517-6611(2019)01-0167-04
doi:10.3969/j.issn.0517-6611.2019.01.050
开放科学(资源服务)标识码(OSID):
油茶与油棕、油橄榄和椰子并称为世界四大木本食用油料植物。它生长在中国南方亚热带地区的高山及丘陵地带,是中国特有的一种纯天然高级油料。主要集中在浙江、江西、河南、湖南、广西、安徽等地[1]。油茶籽粕为油茶籽榨取茶油后的饼粕,含有30%~50%的糖类物质[2]。茶籽粕中还含有茶皂素、茶籽蛋白等,它们都是化工、轻工、食品、饲料工业产品等的原料[3],具有很高的综合利用价值。
目前,对于多糖的提取方法主要是水体醇沉法,再以超声[4]、微波[5]、酶法[6]等辅助提取,以提高多糖的得率和提取效率。超声波辅助提取法可快速高效地从植物中提取有效成分,已应用于白及多糖[7]、红腰豆多糖[8]等多种植物多糖的提取。多糖具有抗氧化[9]、增强免疫[10]、降血糖[11]等多种生物活性,其纯度及结构对多糖的活性有显著的影响[12]。目前,对于油茶籽饼粕多糖的分离纯化及结构鉴定鲜有报道。作为油茶产业链的下游产物,从废物再利用的角度出发,从中提取多糖有利于加深油茶的开发利用,进一步提高其应用价值和经济价值。该试验利用正交試验法对油茶籽饼粕多糖的超声波提取条件进行优化,并对其进行分离纯化及其结构表征,以为油茶籽饼粕资源的深度开发利用提供理论基础。
1.1材料与试剂
1.1.1试验材料。油茶籽饼粕:源自安徽省金寨县大别山。单糖标准品,DEAE-52纤维素阴离子交换树脂:Sigma公司;考马斯亮蓝染料,浓硫酸,磷酸二氢钠,磷酸氢二钠均为分析纯,国药试剂有限公司生产。
1.1.2试验仪器。亚荣RE-5286A电动升降旋转蒸发仪(上海圣科仪器设备有限公司);TG16-WS/TG16WS台式高速离心机(湖南湘仪离心机仪器有限公司);FD-B10N-50冷冻干燥机(冠森生物科技有限公司);752N紫外可见分光光度计(上海精科分析仪有限公司);Nexus型傅里叶红外变换光谱仪(美国Thermonecolet公司);Aglient1100高效液相色谱仪(美国Aglient公司)。
1.2油茶籽饼粕总多糖的提取油茶籽饼粕→粉碎→过筛(40目)→按一定料液比加蒸馏水→超声预处理→水浴浸提→离心取上清(4000r/min,10min)→浓缩至上清液体积的1/5→4倍上清液体积的无水乙醇沉淀→4℃冰箱沉淀过夜→离心(4000r/min,10min)→收集沉淀→冷冻干燥→得油茶籽饼粕多糖,收集备用。
1.3测定方法
以苯酚-硫酸比色法[13]绘制葡萄糖标准曲线,总糖质量浓度(C)与吸光度(A)之间的回归方程为Y=7.452C+0.002(R2=0.997)。将水体醇沉法得到的粗多糖溶于一定体积的蒸馏水中,并进行稀释,在495nm处测定溶液的吸光度,按照回归方程计算溶液的质量浓度,并按下式计算多糖得率:
T(%)=V×C×N/M0
式中,T为多糖得率;V为粗多糖溶液的体积;N为稀释倍数;C为多糖质量浓度;M0为油茶籽饼粕粉末的质量。
1.4提取单因素试验
取10g油茶籽饼粕粉末,固定料液比1∶10,浸提温度40℃,浸提时间30min,分别在超声时间为5、10、15、20、25min的条件下测定油茶籽饼粕粗多糖的得率。固定超声时间5min,浸提温度40℃,浸提时间30min,分别在料液比1∶10、1∶15、1∶20、1∶25、1∶30的条件下测定油茶籽饼粕粗多糖的得率。固定超声时间5min,料液比1∶10,浸提时间30min,分别在浸提温度40、50、60、70、80℃的条件下测定油茶籽饼粕粗多糖的得率。固定超声时间5min,料液比1∶10,浸提温度40℃,分别在浸提时间30、60、90、120、150min的条件下测定油茶籽饼粕粗多糖的得率。
1.5提取正交试验设计
试验设计超声时间、料液比、浸提温度、浸提时间四因素,每个因素设计3个水平,具体试验设计见表1。
1.6油茶籽饼粕粗多糖的分离纯化
1.6.1粗多糖前处理。
取冷冻干燥后的多糖适量,溶于水中,以Sevag法脱蛋白[14-15],10%过氧化氢脱色后[16],在经3500Da透析袋流动水透析48h,收集透析液,冷冻干燥后备用。
1.6.2DEAE纤维素阴离子树脂的活化。取25gDEAE于烧杯中,加入250mL蒸馏水,用磁力搅拌器搅拌均匀,静置浸泡24h。将蒸馏水抽干,溶胀树脂置于烧杯中,加入0.5mol/LHCl溶液,搅拌,静置浸泡1.5h,抽干后用蒸馏水反复洗涤至中性。再将溶胀树脂置于烧杯中加入0.5mol/LNaOH溶液,搅拌,静置浸泡1.5h,抽干后用蒸馏水反复洗涤至中性,待用。
47卷1期郭玉华等油茶籽饼粕多糖的提取工艺优化及结构鉴定
1.6.3装柱与平衡。将层析柱洗净固定于铁架台上,加入1/3体积的去离子水,将抽干的树脂加入少量蒸馏水,超声搅拌均匀后,迅速倒入层析柱中,直至树脂填满层析柱2/3左右,停止装柱,并打开下部旋钮,调整流速。保持柱子表面平整,以4倍柱体积的蒸馏水平衡后,关闭下部旋钮,待用。
1.6.4上样与纯化。
将多糖液缓慢加入平衡好的DEAE-52纤维素阴离子交换树脂柱中(2.4cm×40cm),小心防止打乱上层平整的树脂表层,上样量为200mg。用0.3mol/LNaCl洗脱,每10mL接1管,洗脱60管。每管用苯酚硫酸法检测并记录溶液在495nm处的吸光度,然后以吸光度为纵坐标,洗脱体积为横坐标作洗脱曲线。合并吸光度峰值附近的洗脱液,冷冻干燥,得到精制多糖组分,并命名为CCP。
1.7CCP的紫外光谱扫描
称取适量的油茶籽饼粕多糖CCP溶于蒸馏水中,制成5mg/mL多糖液,于190~800nm处进行紫外光谱扫描。
1.8CCP的单糖组成分析
1.8.1混合单糖标准品的衍生。分别取100μL的混合单糖标准溶液,与100μL的0.3mol/LNaOH溶液,置于1mL的具塞试管中,加入100μL0.5mol/L的1-苯基-3-甲基-5-吡唑酮(PMP)甲醇溶液后涡漩混匀。在80℃水浴反应120min,冷却至室温;加100μL0.3mol/LHCl溶液中和。再加入1mL积氯仿,萃取3次,以除去未反应的PMP,将下层水相用0.45μm滤膜过滤后,供HPLC进样分析[17-19]。
1.8.2样品制备。
吸取100μL0.2mg/mL的CCP溶液于具塞试管中,加入100μL4mol/L三氟乙酸(TFA),充氮封管,114℃油浴2h;冷却后加200mL甲醇,并用氮气吹干。重复3次,加入100μL蒸馏水溶解用氮气吹干的水解多糖,并置于10mL具塞试管中,备用。然后按照1.8.1的衍生方法进行处理。
色谱条件:色谱柱ZORBAXEclipseXBD-C18250mm×4.6mm5μm;流动相:0.2mmol/L磷酸盐缓冲液(pH=6.7)-乙腈(体积比83∶17);柱温:30℃;检测波长250nm;流速为1mL/min;进样体积20μL[17]。
2结果与分析
2.1提取单因素试验
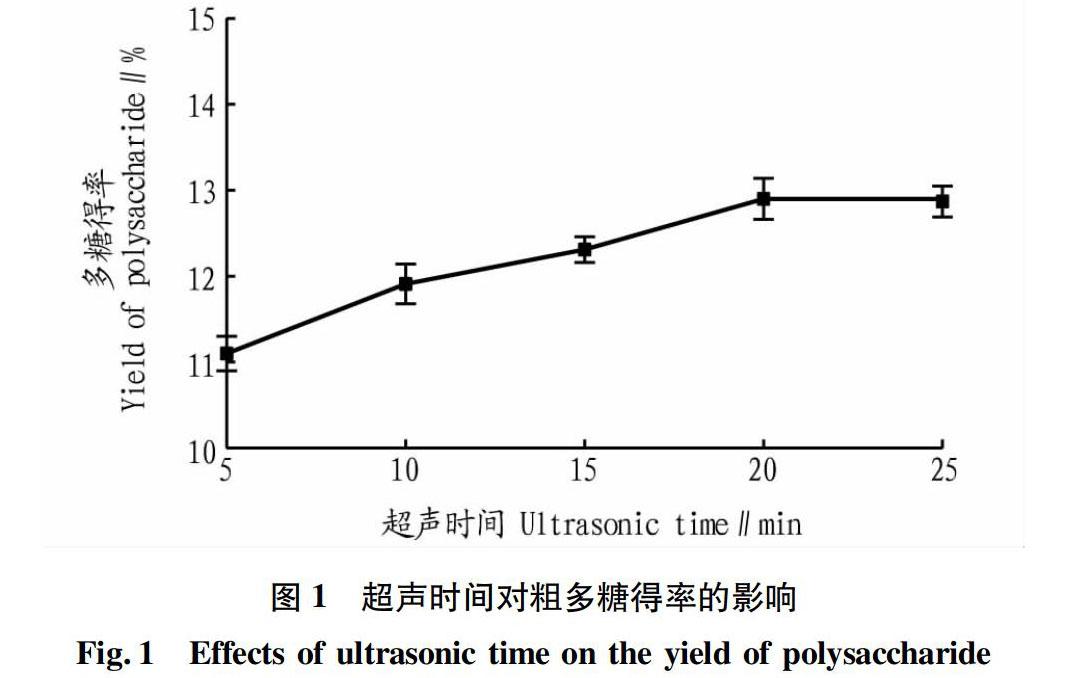
由图1可知,随着超声时间的增加,多糖的得率不断提高,当超声时间增加到20min时,多糖的得率达到最高,之后随着时间的增加,多糖得率上升并不明显。故选择超声时间20min作为适宜的处理时间,并选择10、15、20min作为正交试验的3个水平。
由图2可知,随着料液比例的增加,多糖的得率呈现先快速上升后趋于平缓的趋势,比例为1∶25时多糖的得率达到最高之后不再增加。故选择料液比例为1∶25时作为适宜的提取比例,并把料液比1∶15、1∶20、1∶25作为正交试验的3个水平。
由图3可知,随着浸提温度的不断升高,多糖的提取率不断增大,当浸提温度达到70℃时,多糖的得率达到最高水平并趋于平稳,但是浸提温度为60和70℃时,多糖的提取率差异很小。故从经济和效率的角度考虑,以60℃作为适宜的浸提温度,并把50、60、70℃作为正交试验的3个水平。
由图4可知,随着浸提时间的不断增加,多糖的得率不断提高,当浸提时间达到120min时,多糖得率达到较高水平,并趋于平稳。故把浸提时间120min作为适宜的提取时间,并以60、90、120min作为正交试验的3个水平。
2.2提取正交试验结果与分析
由表2、表3可以看出,各影响因素的极差与显著性得出的结果基本一致。多糖得率影响因素的大小顺序为C>B>D>A,即浸提温度>料液比>浸提时间>超声时间。B、C和D3个因素对提取多糖得率均有较显著的影响。其中浸提温度对多糖得率的影响最大,一般来说温度越高提取率越高,因为温度越高,分子运动加快,渗透、溶解、扩散速度加快,因而提取率提高[19]。但温度过高,会破坏有效物质的活性,增加杂质的含量。超声波可以起到破壁的作用,一定程度上促进目标物质的溶出,但试验结果表明,过长的超声时间并不能持续促进多糖的提取率提高。因此,超声时间不宜过长。故综合考虑,最终确定最佳提取工艺条件为A1B2C2D3,即超声时间10min,料液比1∶20,浸提温度60℃,浸提时间120min。按照此组合进行3次平行验证试验得知,油茶籽饼粕多糖的平均得率为16.76%。高于表中的任意組合,因此认为该工艺优化合理,稳定可行。
2.3油茶籽饼粕多糖的分离纯化及鉴定DEAE-纤维素(二乙氨乙基纤维素,Dicthylaminoethyl)在纤维素上结合了带正电荷的阳离子,可与带负电荷的阴离子进行交换,交换剂对多糖和无机阴离子均有交换吸附的能力,两者同时存在于一个色谱过程中[20]。一般采用一定离子浓度的洗脱液和DEAE-纤维素交换剂洗脱达到分离多糖的目的。图5为纤维素DEAE-52交换树脂对油茶籽饼粕粗多糖的分级洗脱曲线。洗脱液为0.3mol/LNaCl溶液,收集尖峰及附近几管洗脱液,冷冻干燥并命名为CCP。
由图6可知,195nm左右处具有糖类物质特征吸收峰[21]。其在260、280、420nm处并无显著的吸收峰,已知的核酸、蛋白质、多肽的吸收峰值分别是260、280、420nm[22]。说明所提取纯化的多糖组分CCP较纯,几乎不含有蛋白质核酸和多肽类杂质。
糖类化合物一般常采用衍生化方法使其形成具有紫外或荧光吸收的衍生物来提高其在HPLC检测中的灵敏度。已成功用于多糖化合物的单糖组成分析[23]。图7为标准单糖的高效液相色谱图,对比图7,从图8可以看出,PMP柱前衍生法高效液相色谱分析可知,多糖组分CCP其单糖组成为甘露糖、葡萄糖以及极少量的鼠李糖。测定结果与已知的报道大体一致。
3结论
试验选取超声时间、料液比、浸提温度和浸提时间4个因素,根据单因素试验结果进行正交试验设计,通过直观分析和方差分析优选工艺参数,结果表明,油茶籽饼粕多糖提取工艺优化合理,得到的最佳优化工艺参数为超声时间10min,料液比1∶20,浸提温度60℃,浸提时间120min。在此条件下多糖的平均得率为16.76%。试验为油茶籽饼粕多糖提取提供了行之有效的方法。油茶籽饼粕多糖经过DEAE-52纤维素阴离子交换柱层析得到纯化组分CCP,梯度洗脱是多糖纯化的主要手段之一,该试验选取0.3mol/LNaCl作为洗脱剂,进一步研究可以扩大NaCl的浓度范围,以期获得油茶籽饼粕中不同洗脱多糖组分。紫外和高效液相分析表明,在CCP为较纯的均一多糖,其单糖组成较为单一,含有甘露糖和葡萄糖,其物质的量比为1.91∶1.00。同时还含有极少量的鼠李糖。研究为开发利用油茶籽饼粕多糖提供了理论基础。然而关于油茶籽饼粕多糖的进一步结构表征还有待于更加深入的研究。
参考文献
[1]姚小华,王开良,罗细芳,等.我国油茶产业化现状及发展思路[J].林业科技开发,2005,19(1):3-6.
[2]刘小如,张丽美,胡蒋宁,等.油茶粕多糖的分级纯化及结构研究[J].食品科学,2013,34(23):96-102.
[3]王元凤,俞兰,魏新林.从油茶饼粕中提取油茶籽多糖和茶皂素的工艺研究[J].食品工业,2008(6):29-32.
[4]郭华,刁全平,张博,等.杨树口蘑多糖的超声波辅助提取工艺及其抗氧化活性[J].食品工业科技,2018(5):180-184.
[5]王胜男,赵玲玲,张红运,等.提取方法对大豆种皮多糖乳化能力的影响[J].中国食品学报,2018,18(1):154-161.
[6]吴宪玲,于晓红,刘涛,等.响应面法优化西洋参多糖的酶解辅助提取工艺[J].食品工业,2016,37(1):118-122.
[7]蔡锦源,梁莹,吴庆华,等.白及多糖的提取工艺及其生物活性研究[J].食品工业,2018(1):45-49.
[8]黎英,陈雪梅,严月萍,等.超声波辅助酶法提取红腰豆多糖工艺优化[J].农业工程学报,2015,31(15):293-301.
[9]CHENY,XIEMY,NIESP,etal.Purification,compositionanalysisandantioxidantactivityofapolysaccharidefromthefruitingbodiesofGanodermaatrum[J].Foodchemistry,2008,107(1):231-241.
[10]LIUY,GONGGP,SUNYJ,etal.Isolation,structuralcharacterization,andimmunologicalactivityofapolysaccharideLRLP4-AfromtheleavesofLyciumruthenicum[J].Journalofcarbohydratechemistry,2016,35(1):40-56.
[11]ZHENGYF,ZHANGS,WANGQ,etal.Characterizationandhypoglycemicactivityofaβ-pyranpolysaccharidesfrombambooshoot(LelebaoldhamiNakal)shells[J].Carbohydratepolymers,2016,144:438-446.
[12]赵雪竹,刘洋,王艳萍,等.原料纯度对白及多糖疏水改性反应取代度的影响[J].药学实践杂志,2015,33(3):221-225.
[13]王文洁,唐炜,俞玲娜,等.蒽酮-硫酸法与苯酚-硫酸法测定凉粉草多糖的比较[J].食品科技,2017(9):274-279.
[14]王琳炜,欧阳臻,张碧娟,等.霍山铁皮石斛多糖的脱蛋白工艺及结构分析[J].食品科学,2017,38(12):164-170.
[15]赵艳,王白娟,杨青松,等.红雪茶多糖过氧化氢脱色工艺优化[J].南方农业学报,2016,47(5):710-714.
[16]戴军,朱松,汤坚,等.PMP柱前衍生高效液相色谱法分析杜氏鹽藻多糖的单糖组成[J].分析测试学报,2007,26(2):206-210.
[17]李薇,夏晴,孙成荣,等.柱前衍生(PMP)-HPLC法测定不同品种甘草多糖中单糖组成[J].辽宁中医药大学学报,2014,16(1):56-58.
[18]王向红,吉爽爽,生庆海,等.柱前衍生高效液相色谱法检测8种枣水溶性多糖的单糖组成[J].中国食品学报,2014,14(9):257-262.
[19]魏晓蕊.桑叶中1-脱氧野尻霉素的提取纯化及其降血糖活性的研究[D].扬州:扬州大学,2012.
[20]王强,李盛钰,杨帆,等.玉竹中性多糖的分离纯化及单糖组成分析[J].食品科学,2010,31(15):100-102.
[21]宋学伟,任磊,韩泳平,等.大花红景天多糖RCPS分离纯化及单糖组成分析[J].光谱学与光谱分析,2008,28(3):642-644.
[22]施君君.牡丹籽粕多糖理化特性及抗氧化、抗肿瘤功能研究[D].合肥:合肥工业大学,2017:12-13.
[23]林华娟,田晓春,秦小明,等.金花茶多糖单一成分的化学结构特征解析[J].食品科学,2013,34(3):141-146.

