茂兰喀斯特森林自然保护区凋落叶分解动态
窦百强, 容 丽, 俞国松, 李 恒
(1.贵州师范大学 地理与环境科学学院, 贵州 贵阳 550001;2.中国科学院 地球化学研究所 环境地球化学国家重点实验室, 贵州 贵阳 550081)
森林凋落物,也称枯落物或有机碎屑,是指生态系统内由地上植物组分产生并归还到地表,作为分解者的物质和能量来源,借以维持生态系统功能的所有有机物质的总称[1-3]。其在维持土壤肥力、水土保持和促进森林生态系统养分循环等方面具有重要意义。凋落物分解是森林生态系统生物地球化学循环的重要组成部分,也是陆地生态系统初级生产力的重要物质来源,其分解速度的快慢也在很大程度上决定了森林生态系统的土壤肥力状况以及林分生产力的高低[4-5]。西南喀斯特地区是中国生态系统较为脆弱的一个地区,喀斯特森林植被所处的生境条件大多比较恶劣,基岩裸露率高,土层浅薄,养分物质总量低,对植物生长要求较高,因而凋落叶的分解对喀斯特森林生态系统物质循环和能量转换具有重要意义,对维持喀斯特森林生态系统的功能具有不可替代的作用。近年来,有关喀斯特森林凋落物的研究已有不少学者进行了报道,魏鲁明等[6]、钱正敏等[7]对茂兰喀斯特森林凋落物量动态进行了研究,俞国松等[8]、熊红福等[9]研究了喀斯特地区不同演替群落的凋落物量、组成特征和月动态变化,朱双燕等[10]、曾昭霞等[11]和卢晓强等[12]先后分析了喀斯特区原生林和次生林凋落物养分归还特征,但针对喀斯特森林不同树种凋落叶间养分循环特征的研究尚不多见,主要为对喀斯特区森林凋落叶生态化学计量特征的研究[13-14]。为此,本文拟通过对茂兰喀斯特森林保护区内典型常绿落叶阔叶混交林进行为期18个月的凋落叶分解动态研究,探讨喀斯特森林生态系统中凋落叶,特别是分别对常绿及落叶成分的失重率和干重残留率动态变化以及分解速率进行探讨,同时初步分析凋落叶养分释放特征,旨在为阐明喀斯特森林生态系统凋落叶物质循环特征及生物地球化学过程提供科学依据。
1 研究区与样地环境概况
研究区位于贵州省南部荔波县境内的茂兰喀斯特森林自然保护区内,处于贵州高原南部向广西丘陵平原过渡的斜坡地带,地理位置25°09′20″—25°20′50″N,107°52′10″—108°45′40″E。整个保护区呈东北—西南走向,区内地形以高原山地为主,为典型的喀斯特地貌,最高海拔1 078.6 m,最低海拔430 m,平均海拔500~800 m。年平均气温18.3 ℃,1月平均气温8.3 ℃,7月平均气温26.4 ℃,年平均积温6 210.8 ℃,全年日照时数1 272.8 h,日照百分率29%;年降水量为1 752.5 mm,雨季集中在5—10月,年平均相对湿度为70%左右,属中亚热带季风湿润气候。区内土壤以黑色石灰土为主,富钙和富盐基化,pH值为7.5~8.0,有机质和全氮含量特别丰富。土层浅薄且不连续,地面岩石裸露,持水量较低,地表水缺乏,临时性干旱频繁[7]。
试验样地位于茂兰保护区西北部拉桥缓冲区,为典型喀斯特常绿落叶阔叶混交林,样地内土层浅薄,生境类型主要为土面、石面、石沟和石缝,坡体下部受少量人为干扰。坡脚主要分布有:天仙果(Ficuserecta)、巴东荚迷(Viburnumhenryi)、香叶树(Linderacommunis)、长梗罗伞(Brassaiopsisglomerulatavar.longipedicellata)、小叶栾树(Boniodendronminus)、光皮梾木(Swidawilsoniana)、滇青冈(Cyclobalanopsisglaucoides)、牛耳枫(Daphniphyllumcalycinum)等植物。圆果化香树(Platycaryalongipes)、短萼海桐(Pittosporumbrevicalyx)、小果润楠(Machilusmicrocarpa)、青檀(Pteroceltistatarinowii)、光叶海桐(Pittosporumglabratum)、裂果卫矛(Euonymusdielsianus)、丝栗栲(Castanopsisfargesii)、十大功劳(Mahoniafortunei)等植物分布在中坡。而坡顶主要分布的植物有:灯台树(Cornuscontroversa)、香叶树(Linderacommunis)、滇青冈(Cyclobalanopsisglaucoides)、多脉青冈(Cyclobalanopsismultiervis)、丝栗栲(Castanopsisfargesii)、山黄皮(Randiacochinchinensis)、山矾(Symplocossumuntia)、粗叶木(Lasianthuschinensis)等。
2 研究方法
2.1 凋落物处理
凋落叶的野外分解工作采用分解袋法。将收集的凋落叶按常绿叶、落叶分别装入孔径为1 mm,规格为10 cm×20 cm的分解袋中,每个分解袋装入10 g烘干至恒重的叶凋落物样品。同时,为了尽量缩小由于分解袋的隔离作用及其形成的小环境限制土壤动物的分解作用,在分解袋正反两面各剪出一个1 cm2的孔。在茂兰喀斯特原生林内,下坡和上坡各设置3个样地、中坡4个样地,共10个样地,样地面积10 m×10 m。于2015年8月下旬将标记好的样袋放置于样地林下进行分解,每个样地按常绿叶和落叶分别放置30个分解袋,即一个样地放置60个分解袋,下坡和上坡各放置180个分解袋,中坡放置240个分解袋,总计600个分解袋。放置时贴近地表模拟凋落叶分解的自然状况。在2015年9月至2017年2月的分解期内,每2个月取一次分解袋,每个样地按常绿叶和落叶各取3袋,一个样地每次取6袋,即下坡和上坡每次各取18袋,中坡每次取24袋,每次总计取60袋,至2017年2月底共回收9次。将取回的样品中附着的杂物清除后,于80 ℃烘箱中烘干至恒重,测定剩余凋落叶质量及其百分比[15]。
2.2 凋落叶N,C元素测定
将不同坡位凋落叶样品混合均匀进行烘干后,分别将落叶与常绿叶样品磨细,过60目筛后,放置于广口瓶中备测。采用元素分析仪(PE2400-Ⅱ)测定凋落叶N,C含量。
2.3 数据分析与处理
使用Excel 2016软件对数据进行整理后,用SPSS 23.0软件对凋落叶失重率和养分含量进行单因素方差分析(one-way ANOVA),对凋落叶干重残留率进行回归分析。
凋落叶失重率计算公式为:
R=(W1-W2)/W1×100%
式中:R——凋落物失重率;W1——初始重量;W2——分解后的重量。
凋落叶分解速率采用Olson指数衰减模型[16]计算:
y=Xt/X0=e-kt
式中:Xt——时间t时的干重残留量;X0——凋落物的初始重量;Xt/X0——凋落物干重残留率;k——凋落物的年分解系数或腐解系数。
试验期间茂兰喀斯特森林区的月平均降雨量、气温和湿度分布如图1所示。
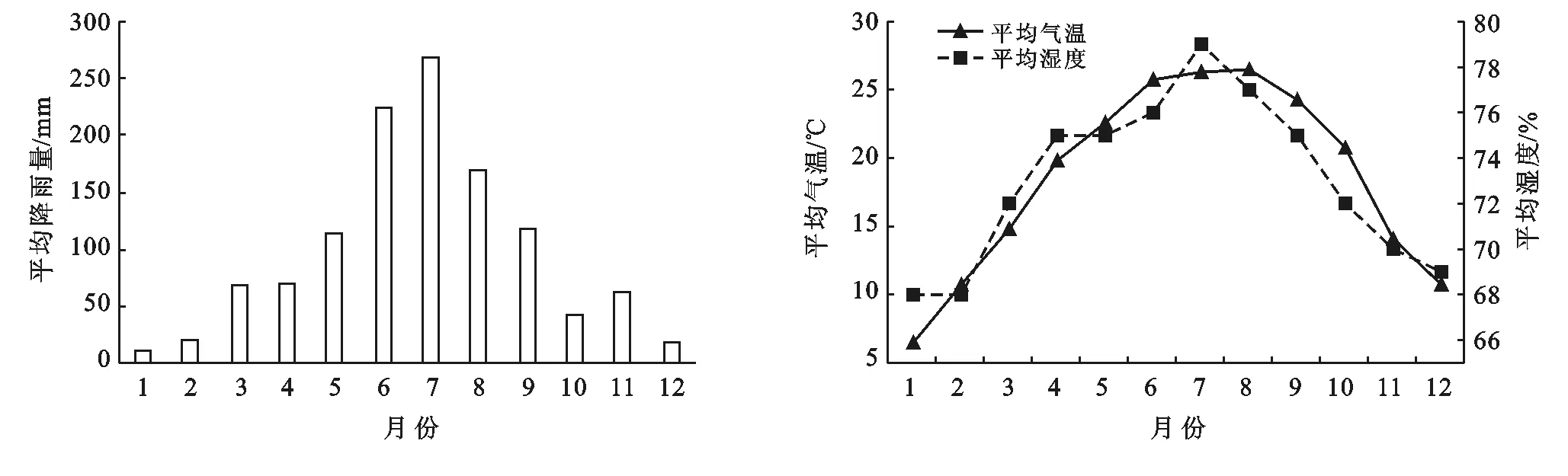
图1 茂兰喀斯特森林区2015-2017年平均气候状况
3 结果与分析
3.1 凋落叶失重率及季节动态变化
计算出凋落叶的失重率,取平均值制成折线图(图2)。由图2可知,在2015年9月到2017年2月的分解期中,落叶树种和常绿树种凋落叶的分解速度均呈现“快—慢—快”的周期变化。凋落叶的失重率变化呈双峰型,第1次峰值期出现在分解期的第2个月(2015年10月),落叶树种和常绿树种凋落叶失重率分别为16.8%和15.4%,上坡、中坡和下坡的凋落叶失重率分别达到11%,16.38%和20.83%。但随后的6个月(2015年11月至2016年4月)凋落叶的分解速度相对减慢,到第8个月(2016年4月)时失重率最低,之后凋落叶分解速度开始再次加快。落叶树种和常绿树种凋落叶的第2次峰值期出现在分解期的第10个月(2016年6月),其失重率分别为12.57%和13.33%。上坡和下坡的第2次峰值期出现在分解期的第10个月(2016年6月),上坡和下坡的凋落叶失重率分别为12.65%和17.72%;而中坡的第2次峰值期出现在分解期的第12个月(2016年8月),失重率为13.9%。由此可见,凋落叶分解的高峰期出现在春夏两季,而秋冬两季分解速度缓慢。
方差分析的结果表明,落叶树种和常绿树种凋落叶失重率无显著性差异(p=0.971>0.05),不同坡位凋落叶的失重率也无显著性差异(p=0.225>0.05)。
由图1可知,茂兰喀斯特森林区气候雨热同期,夏季高温多雨,而冬季低温少雨。夏季6月—8月的平均降雨量、气温及湿度为全年最高,其中7月份的平均降雨量为269 mm,平均湿度达79%,8月平均气温最高为26.5 ℃。冬季12月至翌年2月的平均降雨量、气温及湿度为全年最低,其中1月份的平均降雨量仅11.7 mm,平均湿度为68%,平均气温最低为6.5 ℃。本研究中,凋落叶的失重率峰值期有两个,分别为2015年10月和2016年6—8月,其月平均气温均在20 ℃以上,平均湿度在75%左右,温暖潮湿的环境有利于凋落叶的快速分解。而凋落叶失重率的低谷期为11月至翌年4月,低温少雨,分解较慢。这种气候的季节差异使凋落叶的分解呈现出“快—慢—快”的周期变化,春夏季节凋落叶的分解速度加快,而秋冬季节凋落叶的分解速度减慢。
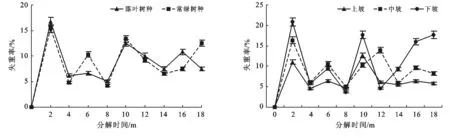
图2 研究区凋落叶失重率动态变化
3.2 凋落叶干重残留率动态变化
3.2.1 不同树种凋落叶干重残留率变化 如图3所示,凋落叶干重残留率随时间的推移总体呈不断下降的趋势。凋落叶干重残留率越低,表明其分解速度越快,而且不同坡位的凋落叶分解均有明显的阶段性。上坡凋落叶分解前期(前8个月)常绿树种凋落叶分解速度比落叶树种凋落叶分解速度快,分解中期(第8—14个月)落叶树种凋落叶分解速度快于常绿树种凋落叶分解速度,分解后期(第14—18个月)落叶树种凋落叶分解速度趋于平缓,而常绿树种凋落叶分解速度再次超过落叶树种凋落叶分解速度,落叶树种凋落叶和常绿树种凋落叶最终干重残留率分别为56%和51%。中坡和下坡凋落叶分解前期(前8个月)分解速度较快,分解中期(第8—14个月)分解速度趋缓,分解后期(第14—18个月)分解速度再次加快。中坡和下坡落叶树种凋落叶最终干重残留率分别为42%和27%,均低于常绿树种凋落叶在中坡和下坡的最终干重残留率(45%和33%),说明中坡和下坡的落叶树种凋落叶分解速度比常绿树种凋落叶分解速度快,且中坡和下坡凋落叶分解过程中落叶树种凋落叶分解速度始终快于常绿树种凋落叶分解速度。
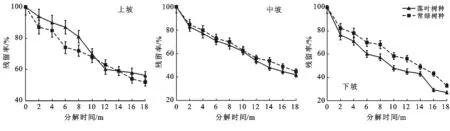
图3 研究区不同树种凋落叶残留率动态变化
3.2.2 不同坡位凋落叶干重残留率变化 由图4可知,茂兰喀斯特森林区凋落叶在经过18个月的分解期后,落叶树种凋落叶分解后的最终干重残留率由小到大依次为:下坡(27%)<中坡(42%)<上坡(56%);常绿树种凋落叶分解后的最终干重残留率由小到大依次为:下坡(33%)<中坡(45%)<上坡(51%)。而且在凋落叶分解过程中,不同坡位凋落叶残留率大小始终为:上坡>中坡>下坡。由此可知,茂兰喀斯特森林区同生活型树种的凋落叶分解速度在不同坡位存在差异,分解速度为:下坡﹥中坡﹥上坡。此外,常绿树种凋落叶分解速度在不同坡位的差异同落叶树种凋落叶相比较小。
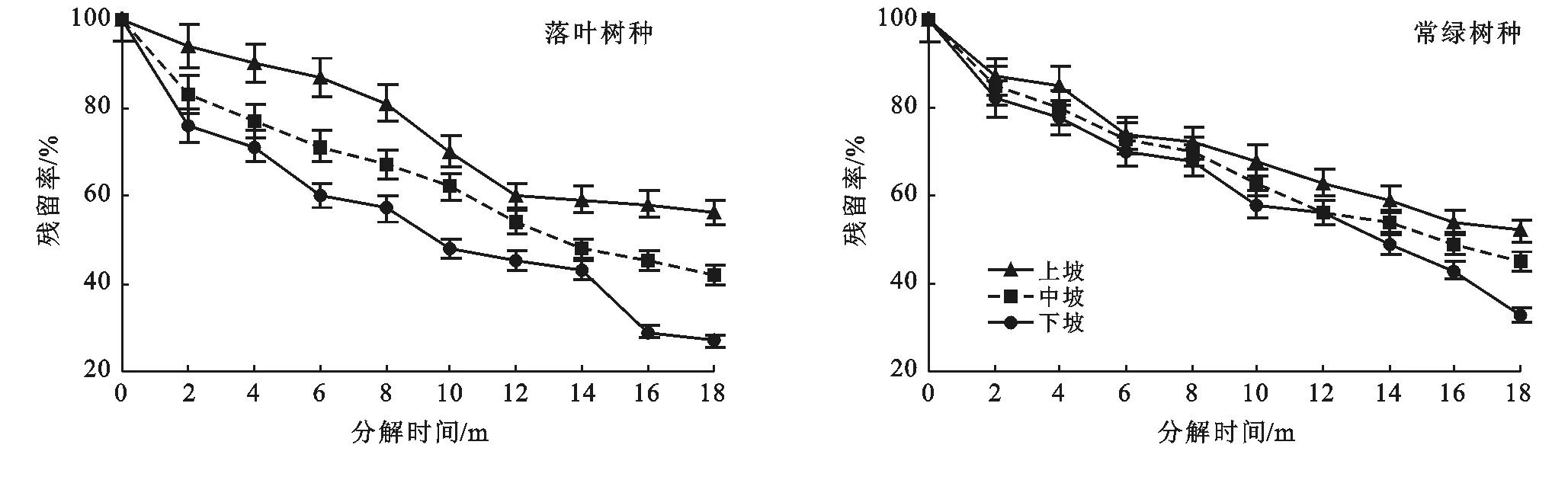
图4 研究区不同坡位凋落叶残留率动态变化
3.3 凋落叶分解时间预测
为比较不同类型凋落叶在不同坡位分解速率的差异,利用Olson指数衰减模型对凋落叶分解50%和95%所需时间进行估测(表1)。由表1可以看出,不同坡位落叶树种与常绿树种凋落叶分解模型的判定系数均很高,拟合效果较好(R2>0.9,p<0.01)。落叶树种凋落叶和常绿树种凋落叶的年分解速率分别为0.548,0.492。
落叶树种凋落叶上、中、下坡的年分解系数分别为0.417,0.501,0.727,均大于常绿树种凋落叶上坡(0.411)、中坡(0.455)和下坡(0.610)的年分解系数。而且不同坡位落叶树种凋落叶分解50%和95%所需时间分别为0.95~1.66 a和4.13~7.19 a,均少于常绿树种凋落叶分解50%(1.14~1.69 a)和95%(4.92~7.30 a)所需时间,所以落叶树种凋落叶和常绿树种凋落叶在不同坡位的分解速度均表现为:下坡>中坡>上坡,且落叶树种凋落叶分解速度快于常绿树种凋落叶。从Olson指数衰减模型计算得出的结论来看,与上述研究结果相一致,符合试验实际情况。
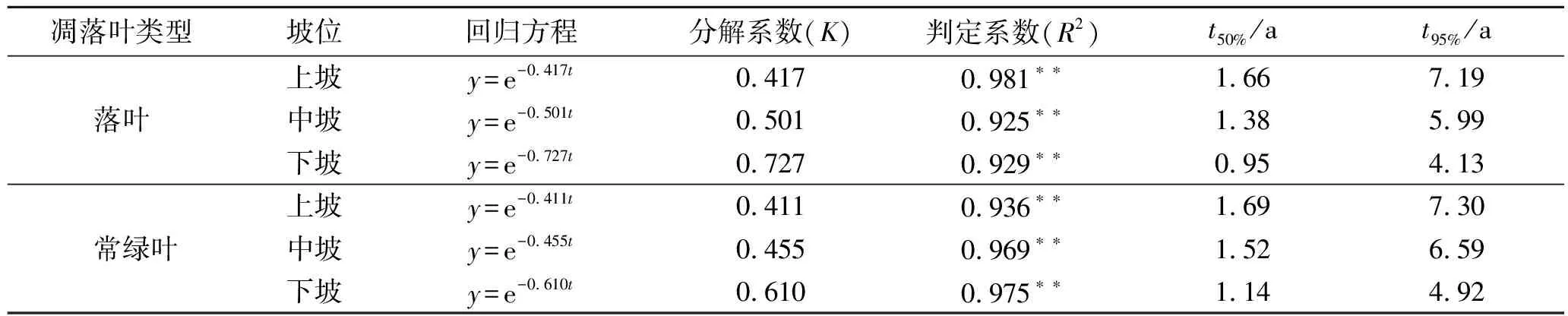
表1 凋落叶残留率随时间的指数回归方程
注:*p<0.05,**p<0.01;t50%为分解50%所需时间,t95%为分解95%所需时间。
3.4 凋落叶养分动态变化
由图5可知,落叶和常绿叶的初始N含量分别为1.28%和1.13%,而初始C含量分别为42.21%和45.54%。在分解过程中,落叶的N含量始终比常绿叶的N含量高,而落叶的C含量始终低于常绿叶。落叶和常绿叶的N含量前期均表现出富集现象,随后分别在第14个月和第16个月N含量达到一个最高值后开始释放,在试验后期凋落叶N元素释放阶段,落叶N元素释放速率大于常绿叶N元素释放速率。而落叶和常绿叶的C含量波动性较大,无规律,但总体随分解时间的推移而减少,经过18个月的分解后,落叶和常绿叶的最终C含量分别为38.12%和41.88%,落叶C元素释放速率大于常绿叶C元素释放速率。落叶和常绿叶的初始C/N比值分别为33.1,40.2,随着分解时间增加,落叶和常绿叶的C/N比值均呈下降趋势,其最终C/N比值分别为20.47,24.16。方差分析表明,落叶树种凋落叶和常绿树种凋落叶的N含量差异极显著(p=0.001<0.01),C含量差异显著(p=0.014<0.05),C/N比值差异极显著(p=0.002<0.01)。
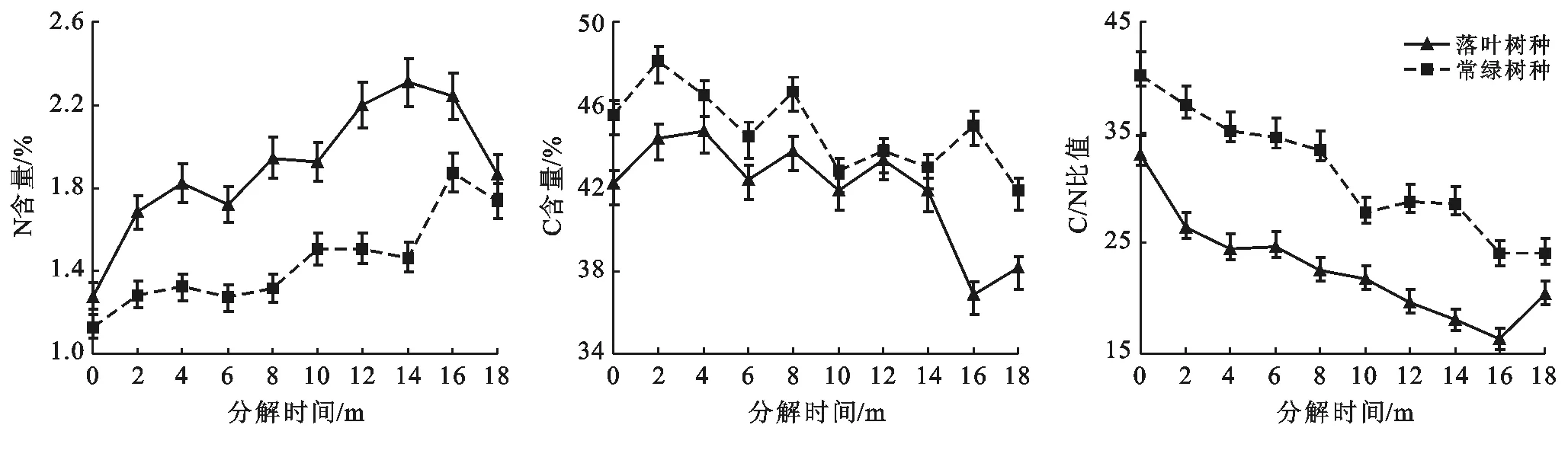
图5 研究区凋落叶N,C含量及C/N比动态变化
4 讨 论
4.1 不同树种凋落叶分解的季节变化动态及差异
由以上结果可知,落叶树种和常绿树种凋落叶间的失重率差异并不显著,且二者的分解均呈现出较明显的季节性变化差异,落叶树种和常绿树种凋落叶分解的高峰期均出现在春夏两季,而秋冬两季分解速度相对缓慢。茂兰喀斯特森林区气候对凋落叶分解的影响主要体现在季节变化所引起的温度和湿度差异。结合图1,茂兰喀斯特森林区5—9月高温多雨,湿度较大,是凋落叶失重率在一年中的高峰期。春夏季由于气温升高、降水量增加改变了土壤动物的生境,提高了微生物活性,加快了有机质和凋落叶分解以及养分元素循环的进行[17]。而秋冬季节则由于气温下降限制了微生物的活性,凋落叶的分解速度减慢。同时,本研究发现,春夏季凋落叶分解率比秋冬季凋落叶分解率高6%~8%,与Moore等[18]研究得出的随着气温升高,凋落物分解率会增加4%~7%的结论相近。本研究中,凋落叶的分解率呈现“快—慢—快”的周期变化,这可能是由于分解初期可溶性有机物的淋洗和易分解碳水化合物的分解,但到一定阶段,难分解的纤维素和单宁等物质的积累,导致分解速度变慢,随着时间推移,组织结构崩溃,分解速度再次加快[19]。
凋落叶残留率越低,表明其分解速度越快。本研究发现,落叶树种凋落叶最终干重残留率低于常绿树种凋落叶最终干重残留率,落叶树种凋落叶分解速度比常绿树种凋落叶分解速度快。在凋落叶分解过程中,不仅受外界气候因子的影响,也受凋落叶自身理化性质的作用,这是不同树种凋落叶分解速率不同的关键原因[20]。一般的落叶树种叶片为比较舒展、轻薄的纸质叶片,而常绿树种的叶片通常为革质叶片,表面有一层蜡质保护膜,比落叶树种的叶片要厚一些,所以微生物一般不易在很短的时间内对常绿树种凋落叶进行分解,而且也不利于降雨淋溶和土壤动物的机械破坏,因此落叶树种凋落叶分解速度比常绿树种凋落叶分解速度快。
4.2 不同树种凋落叶分解的养分动态及养分释放速率
不同树种凋落叶的养分组成不同,对其分解速率和养分释放均有一定影响。在凋落物分解过程中,N是制约凋落物分解的重要因素之一[21]。一般认为,N含量高的凋落物其分解速率也会比较高,凋落物初始N含量与分解速率呈正相关关系[20]。本研究中,初始N含量:落叶>常绿叶,分解速率:落叶>常绿叶。落叶与常绿叶分解过程中的N元素释放模式均为富集—释放模式,N含量的动态变化呈先上升后下降的趋势。这主要是因为凋落物在分解初期,微生物必须从外部获取N源以满足自身分解的需要,故分解初期N的绝对含量趋于升高[22]。落叶与常绿叶的初始C含量分别为42.21%和45.54%,较高的C含量是由于植物叶片需合成有机物质,从而维持其生长和代谢。凋落叶C含量随分解时间的推进呈波动性变化,差异显著,这可能是由凋落叶初始C含量和试验样本量差异造成的。C/N是凋落物分解的一个重要预测指标,本研究中,C/N比值随凋落叶的分解呈不断下降的趋势,这是由于凋落叶分解到后期,难分解物质相对增加,分解速度变缓,C/N比就会逐渐降低[23]。有研究表明,凋落物中C含量及C/N比值越低分解失重及元素释放就越高[5]。本研究中,落叶的C含量及C/N比值在分解过程中始终低于常绿叶,落叶元素释放速率大于常绿叶元素释放速率。不同树种凋落叶中养分元素释放速率的差异,与凋落叶中养分元素的初始含量和叶片结构特征有关。
4.3 不同树种凋落叶分解时间预测
由于不同地区林分特征、生境条件及凋落物质量不同,即使是同一气候带,其凋落物分解速率也会存在明显的差异。本研究中,茂兰喀斯特森林区不同坡位落叶树种与常绿树种凋落叶分解95%所需时间分别为4.13~7.19 a和4.92~7.30 a,高于中亚热带东部武夷山常绿阔叶林(3.01 a)[19]和浙江天童常绿阔叶林(2~4.5 a)[24],略高于神农架常绿落叶阔叶混交林(4.54 a)[25]。水热环境等因素的差异是导致上述区域森林凋落叶分解速率差异的主要原因[26]。而与同区域的喀斯特森林相比,低于黔中喀斯特次生林(3.1~10 a)[27]和贵州普定喀斯特人工林(5~10 a)[28],说明凋落叶分解速率也因不同林分而异。由此可知,茂兰喀斯特森林区凋落叶分解速率比中亚热带东部常绿阔叶林和常绿落叶阔叶混交林低,但高于同区域喀斯特次生林与人工林。
5 结 论
由于不同季节水热条件的差异,茂兰喀斯特森林区不同树种凋落叶分解率均呈现较明显的季节性变化差异,表现为春夏季凋落叶分解率大于秋冬季凋落叶分解率,分解趋势表现出“快—慢—快”的节奏。此外,受不同凋落叶初始质量和叶片结构特征差异的影响,落叶树种凋落叶的分解速率和养分释放速率均大于常绿树种凋落叶,因此,落叶树种凋落叶对维持林地土壤肥力,促进茂兰喀斯特森林生态系统物质循环具有积极作用。

