利用CRISPR/Cas9系统在Beta-TC-6细胞株中剔除Sidt2基因
吕康甲,梁飞腾,郑慧豪,张 杨,徐海平,董莹莹,高家林
(皖南医学院 a.临床医学院;b.医学影像学院 安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 内分泌科,安徽 芜湖 241001)
CRISPR/Cas系统是细菌和古细菌在长期进化过程中形成的一种免疫防御机制,能够抵御外来病毒、噬菌体、质粒等元件的侵入[1-3]。该系统主要通过在细胞之内引入特异性的向导RNA(sgRNA)和cas9酶,在特异性sgRNA的引导下,cas9酶切割sgRNA下游的PAM区从而造成DNA双链断裂,然后利用细胞自身的非同源末端连接(NHEJ)或者同源重组(HR)修复机制修复,对断裂的DNA进行插入缺失、修复或替换,从而实现基因编辑功能[4]。CRISPR/Cas9系统相对于传统的基因编辑工具ZFN和TALEN具有成本低、操作简单等优点[5-6]。但是由于Cas9是一种分子质量比较大的多功能核酸酶,相对于普通表达质粒转染细胞难度偏大,尤其在难转染的细胞系中[7]。虽然CRISPR/Cas9系统对转染效率要求不高,可以依靠转染后的抗生素加压筛选和单克隆培养建立基因稳定剔除细胞系,但是对大多数实验室来说,挑取单克隆仍然是一项繁重且效率低下的工作,极大地妨碍这种基因编辑手段的推广使用,所以CRISPR/Cas9质粒转染进入目的细胞系其实对于大多数实验室来说,是一个不可逾越的屏障。为了有效地解决这个问题,我们将电穿孔转染技术和CRISPR/Cas9系统结合,在相对难转染的内分泌细胞系小鼠胰岛素瘤胰岛β细胞(Beta-TC-6)中剔除溶酶体膜蛋白Sidt2基因,希望为大多数实验室提高CRISPR/Cas9系统的应用效率提供切实可行的方法。
1 材料与方法
1.1 质粒、菌株以及细胞 质粒载体pSpCas9(BB)-2A-Puro (PX459) (Addgene plasmid # 62988);感受态细胞DH5α(天根生化科技有限公司);Beta-TC-6(中国科学院细胞库)。
1.2 主要试剂及仪器 BbsI限制性内切酶、T4 DNA Ligase、T7核酸内切酶Ⅰ(美国NEB公司);Opti-MEM减血清培养基(美国GE公司);胎牛血清(标准级)(依科赛生物科技有限公司);Annealing Buffer for DNA Oligos (5X)(上海碧云天公司)、β-actin抗体(sigma公司);Sidt2兔多克隆抗体(abgent公司);PCR仪(德国耶拿分析仪器股份公司);蛋白印记系统(美国Bio-Rad公司);NEPA 21高效基因转染系统(日本NEPA公司)。
1.3 其他 基因测序由华大科技公司完成。sgRNA ssDNA由上海生工生物科技有限公司合成。
1.4 实验方法
1.4.1 sgRNA oligo DNA序列的设计 利用sgRNA在线设计工具(http://crispr.mit.edu/)针对小鼠Sidt2基因设计长度为20 bp左右的oligo DNA,sgRNAssDNA序列F链5′端需要添加CACC从而可以和BbsI酶切后的载体互补,需要注意的是F链的第一个碱基必须是G,如果选取的Guide序列的第一个碱基不是G,可自行添加一个G以增强U6启动子的活性,R链的5′端添加AAAC。另外,需在位点上下游各设计一条引物,用于后续检测阳性克隆,引物能扩增约300 bp的DNA片段,上游引物距突变位点约100 bp,下游引物距突变位点约200 bp。将设计后的序列送公司合成,纯化级别为PAGE。
1.4.2 oligo DNA退火 合成的sgRNA稀释为终浓度为100 μmol/L,配制退火反应体系:稀释的sgRNA各1 μL,2 μL Annealing Buffer for DNA Oligos (5X),用超纯水补足到10 μL。PCR仪中95℃10 min,随后取出室温冷却2 h。稀释10倍后-20℃储存备用。
1.4.3 px459重组质粒的构建与鉴定 px459质粒为含有U6启动子的sgRNA骨架的表达载体。①px459载体的线性化:使用BbsI限制性内切酶线性化px459载体,使用胶回收试剂盒回收线性化px459载体;②sgRNA与线性化px459连接:按照T4连接酶说明书配置反应体系,PCR中25℃反应3 h;③连接产物转化感受态细胞DH5α,37℃培养过夜。次日挑取菌落摇菌抽提质粒;④px459重组质粒的验证:质粒送生物公司测序,测序引物为U6启动子通用引物,根据测序结果鉴定sgRNA是否正确连接到载体中。测序成功的质粒命名为px459-Sidt2,使用去内毒素质粒大量提取试剂盒抽提质粒,要求质粒浓度大于1 g/L并且纯度达到电转染要求。
1.4.4 Beta-TC-6细胞的培养、重组质粒电转参数的优化及阳性细胞的筛选 ①Beta-TC-6细胞的培养:细胞培养条件为含15%胎牛血清的DMEM高糖培养基,细胞汇合度达到70%左右进行传代。②px459-Sidt2质粒的电转:电转前细胞融合度达到80%左右,胰酶消化细胞后加入Opti-MEM使其成为单细胞悬液并且调整细胞数量为1×106个/90 μL,吸取90 μL细胞悬液加入10 μL质粒轻轻混匀后加入电转杯中。设置导入电转参数:脉冲电压为20 V,脉冲时间为20 ms,脉冲间隔为50 ms,脉冲次数为5次,电压衰减为40%,电穿孔模式为正方向。穿孔电转参数为:固定脉冲时间5 ms,脉冲间隔50 ms,脉冲次数2次,电压衰减10%,电穿孔模式为正方向,设置脉冲电压梯度为125、150、175、200 V。完成电转染的细胞在六孔板中培养过夜。③阳性细胞的筛选:电转染48 h加入嘌呤霉素至终浓度为3 μg/mL进行筛选(提前需要进行嘌呤霉素筛选梯度的摸索,本实验室Beta-TC-6的筛选浓度为3 mg/L),72 h后换为正常培养条件,扩增冻存。
1.4.5 T7酶和Western blot检测 野生型细胞以及阳性细胞一部分使用试剂盒提取DNA,一部分使用细胞裂解液提取全细胞蛋白。提取的DNA通过PCR对sgRNA的靶向区域进行扩增,扩增引物的退火温度54℃。①T7酶切分析:按照说明书进行操作,酶切后的产物通过2%琼脂糖凝胶分析。②Western blot检测:使用微量分光光度计测定蛋白浓度,取等量的蛋白加入蛋白上样缓冲液,煮沸后进行SDS-PAGE电泳,电泳完成后湿转到PVDF膜上,用5%的脱脂奶粉封闭1 h,一抗孵育过夜,第2天进行二抗孵育,加入曝光底物后使用超灵敏多功能成像仪进行曝光,以β-actin作为内参。
1.5 统计学分析 使用GraphPad Prism 6软件进行数据处理分析,组间数据分析采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠Sidt2基因敲除靶点的选择以及sgRNA序列 小鼠Sidt2基因sgRNA和验证引物的DNA序列见表1。
表1 小鼠Sidt2 sgRNA及验证引物序列
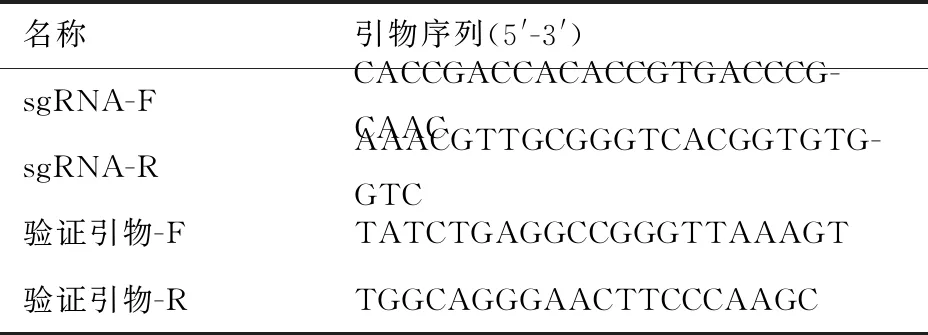
名称 引物序列(5'-3')sgRNA-FCACCGACCACACCGTGACCCG-CAACsgRNA-RAAACGTTGCGGGTCACGGTGTG-GTC验证引物-FTATCTGAGGCCGGGTTAAAGT验证引物-RTGGCAGGGAACTTCCCAAGC
2.2 px459-Sidt2克隆构建 px459空载体经BbsI酶切线性化后,从琼脂糖凝胶中回收酶切后的线性化片段。将退火的sgRNA双链和回收的线性化px459载体相连,构建px459-Sidt2重组质粒。构建的px459-Sidt2经测序表明插入序列的位置、方向均正确,重组质粒px459-Sidt2构建成功(图1)。
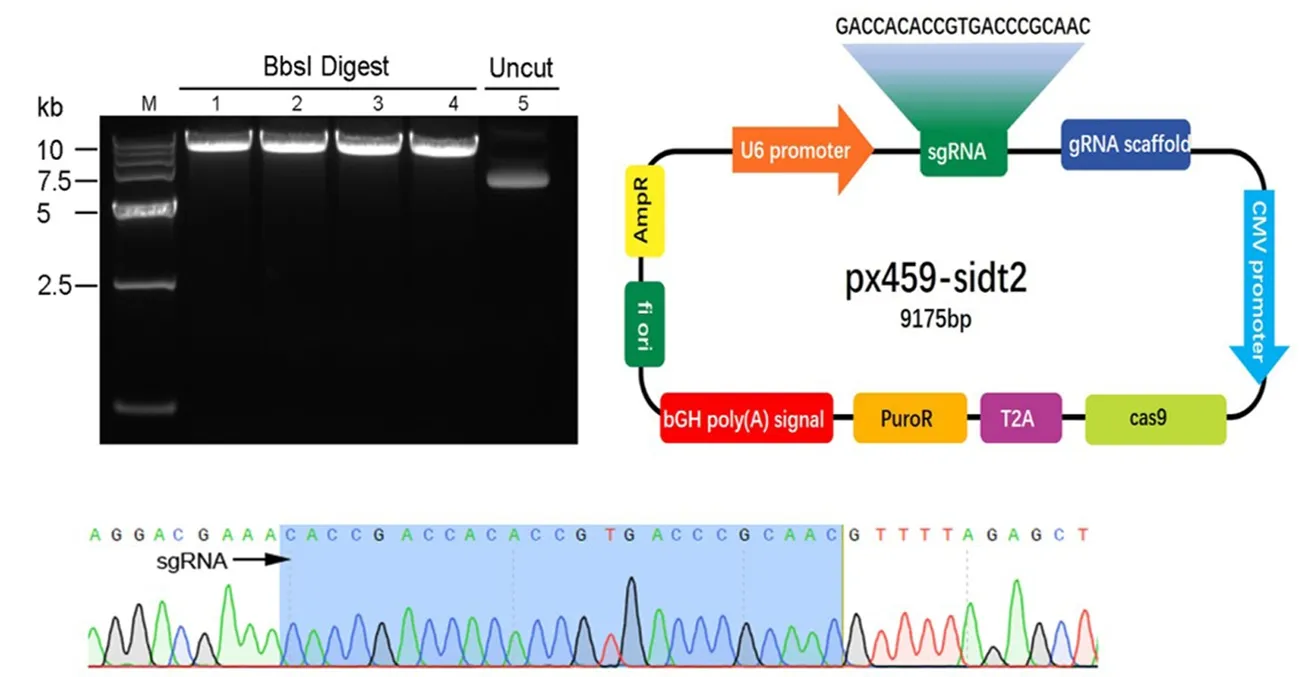
图1 成功构建px459-Sidt2克隆
2.3 Beta-TC-6细胞px459-Sidt2最佳电转染参数的优化 电转染后抗生素筛选,结果显示脉冲电压为150 V时转染效率最高并且细胞状态没有明显改变,因此确定Beta-TC-6细胞电转染px459-Sidt2最优电转穿孔电转参数为:脉冲电压150 V,脉冲时间5 ms,脉冲间隔50 ms,脉冲次数2次,电压衰减10%,电穿孔模式为正方向(图2)。
2.4 T7E1酶及Western blot检测小鼠Sidt2基因的敲除效果 T7E1酶结果显示,电转染px459-Sidt2的混合克隆细胞有一条明显的切开的条带,即混合克隆细胞中出现碱基错配,表明px459-Sidt2在Beta-TC-6细胞中实现靶向敲除。Western blot检测敲除效果,结果显示同野生型细胞比较,混合克隆细胞Sidt2蛋白表达降低(t=6.668,P=0.0026)(图3)。进一步实验需要进行单克隆培养,从而得到敲除效率为100%的克隆细胞株。

图2 设置脉冲电压梯度加压筛选72 h后的阳性细胞
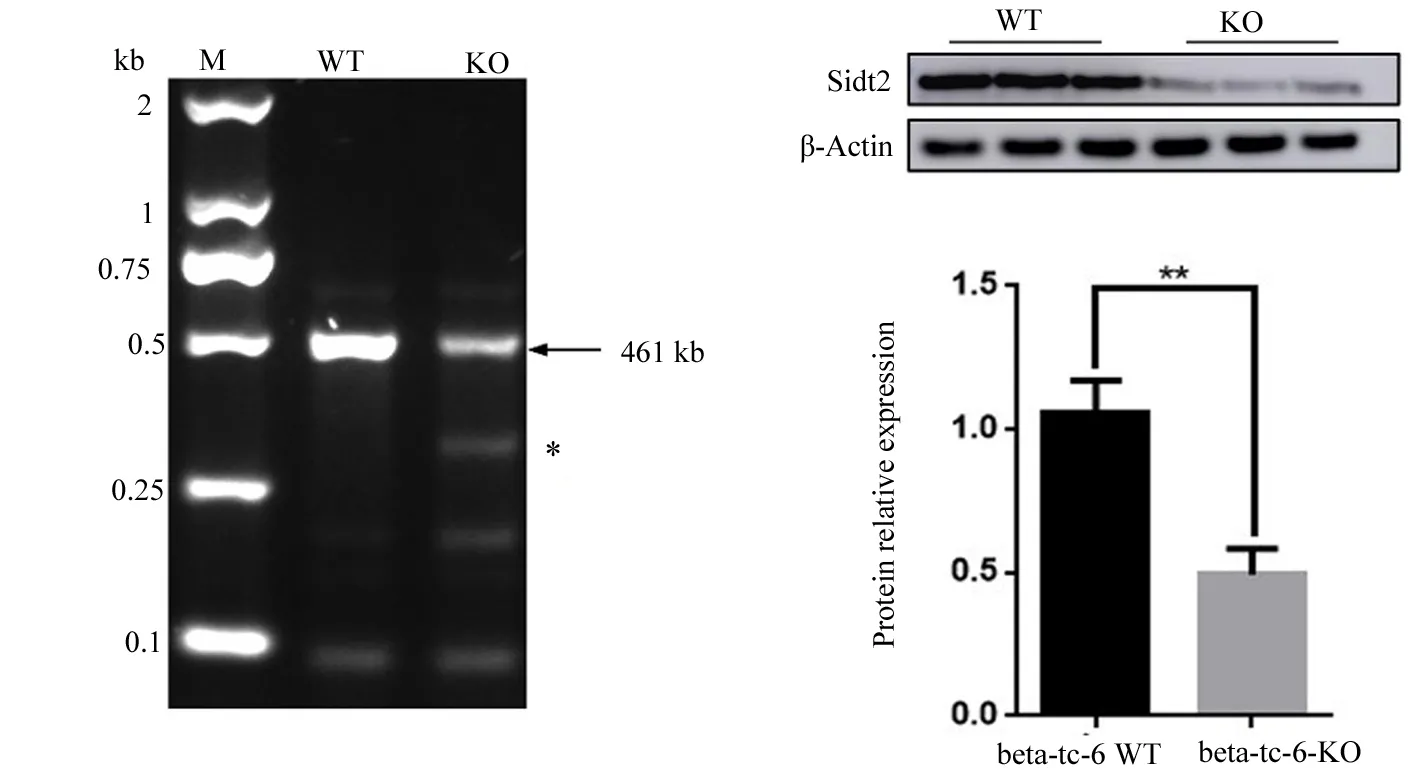
*T7E1酶切开的条带;**P<0.05。
图3 T7E1酶及western blot检测小鼠Sidt2基因的敲除效果
3 讨论
CRISPR/Cas9基因编辑系统成为继锌指蛋白(ZFPs)、转录激活子样效应因子核酸酶(TALEs)之后的第三代基因编辑技术[8-9]。与传统的基因编辑工具相比具有诸多的优点,首先CRISPR/Cas9基因编辑系统适应性和操作性强,来自产脓链球菌和嗜热链球菌的Cas9 由于PAM 识别序列仅为2 个碱基(GG),几乎可以在所有的基因中找到大量靶点[8]。Cas9 蛋白在目前测试过的几乎所有生物和细胞中均有活性,包括细菌、酵母、植物、鱼以及哺乳动物细胞[10-14];其次,CRISPR/Cas9基因编辑系统简单易学,目前已有多种成熟的CRISPR/Cas9基因编辑系统质粒载体,常规的分子生物学实验室即可开展构建,只需要将长约25 bp左右的sgRNA双链连接到线性化的载体中,构建难度相对于常见的表达载体和报告基因载体小,构建完成的载体只需要通过菌落PCR或者测序即可鉴定,不必像构建表达载体那样担心长片段的碱基突变问题。但是CRISPR/Cas9质粒需要表达的cas9蛋白相对于其他的载体偏大,一般常常在10 kbp以上,转染细胞难度较大,尤其对于难转染细胞更是雪上加霜。虽然可以通过对成功转染的细胞表达的抗生素筛选或者荧光标记束进行筛选,但是转染效率低将对后续的筛选和单克隆培养造成很大的困难,并且cas9蛋白具有一定的细胞毒性[15],后续的抗生素筛选和流式分选也会对转染成功的细胞产生影响。因此提高CRISPR/Cas9质粒的转染效率是急需解决的问题。
目前质粒转染主流的方法包括脂质体转染、阳离子非脂质体转染、磷酸钙转染等。这些方法有各自的优点,同时也存在着缺点[16]。比如脂质体转染效率高,但是对于一些原代细胞或者难转染的分泌性的细胞转染效率较低。电穿孔也称为电转染,是通过高强度的电场作用,使细胞膜上形成可逆的瞬时通道,质粒在电场的作用下通过通道进入细胞内[17]。电穿孔转染相比于其他转染方法具有操作简单,对于原代细胞和难转染细胞效率高、重复性好等优点;但是电穿孔转染对于不同的细胞系转染参数差异较大,因此需要针对不同的细胞系进行电转染参数的优化[18]。目前比较成熟的运用电穿孔的细胞都是常见细胞系或者原代细胞,对胰岛细胞系使用电穿孔较少,也没对其进行电转染参数进行优化;另外质粒的纯度以及浓度、细胞的状态等都会对电转的效率产生影响。电转参数优化时一般在保证转染质粒纯度浓度以及细胞状态的前提下,通过固定穿孔时间,摸索不同穿孔电压梯度,以摸索细胞系最优穿孔电压。
本实验针对Beta-TC-6难转染以及CRISPR/Cas9质粒分子较大的特点,采取电穿孔进行Cas9质粒的递送,并且设置不同的穿孔电压梯度进行电转参数的优化,从而实现了在Beta-TC-6中高效的递送CRISPR/Cas9质粒。通过将CRISPR/Cas9基因编辑系统和电穿孔相结合,克服了CRISPR/Cas9质粒难转导的特点,为常规的分子生物学实验室开展CRISPR/Cas9基因编辑系统提供了切实可行的办法。
——一道江苏高考题的奥秘解读和拓展

