三氮唑类杂合体的抗疟疾活性
程凡 编写,徐志,2 审校
(1 武汉弗顿控股有限公司,武汉 430073;2 湖北德信辰科技有限公司,武汉 430080)
1 前言
可感染人类的疟原虫有恶性疟原虫、间日疟原虫、卵形疟原虫、三日疟原虫和诺氏疟原虫五种,其中恶性疟原虫和间日疟原虫最为常见。恶性疟原虫主要分布在东亚、南亚、南美、加勒比地区、中东和非洲,而间日疟原虫则主要分布于中美洲、印度和地中海东部。恶性疟原虫最为致命,其导致了约90%的疟疾死亡。间日疟原虫的致病性弱于恶性疟原虫,但是它是引起疟疾复发的罪魁祸首,而复发性间日疟疾可引起严重贫血甚至死亡。卵形疟原虫和三日疟原虫较为少见且不致命,主要分布于非洲和巴布亚新几内亚,而诺氏疟原虫则是最近刚发现的仅分布于东南亚局部地区的第五种可感染人类的疟原虫。
据世界卫生组织(WHO)估计,与2010年相比,2017年全球疟疾发病人数降低了2000万,但在2015—2017年间全球在抗击疟疾领域并未取得实质性进展。这主要是由于疟原虫的生命周期极为复杂和耐药疟疾的不断涌现及广泛传播所致,故亟需开发可作用于两个或多个生命阶段、对药敏型和耐药性疟疾均有效的新型抗疟疾药物。
三氮唑为五元含氮杂环化合物,可分为1,2,3-三氮唑和1,2,4-三氮唑(图1)。三氮唑可作为酰胺、酯、羧酸和其它一些杂环如吡唑的电子等排体,由于可形成多种非共价键作用可与多个生物靶点相结合,故其衍生物具有抗菌、抗结核、抗肿瘤和抗疟疾等多种生物活性。此外,某些三氮唑衍生物如氟康唑和利巴韦林等已被批准用于临床治疗各种疾病。显然,三氮唑类化合物在新药研发领域举足轻重。
近年来,药物化学家设计合成了数以千计的三氮唑衍生物,并研究了它们的体内外抗疟疾活性,并发现了若干苗头化合物。本文综述了近期三氮唑杂合体在抗疟疾领域的研究进展,并归纳总结了此类化合物的构-效关系(SAR),为进一步研究打基础。
2 三氮唑-喹啉/喹诺酮杂合体和三氮唑作为连接子的喹啉杂合体
2.1 三氮唑-喹啉/喹诺酮杂合体

图1 1,2,3-三氮唑、1,2,4-三氮唑母核及其异构体的化学结构
喹啉类抗疟疾药物如奎宁(QN)、氯喹(CQ)和甲氟喹(MQ)是一线抗疟疾药物,故将三氮唑与喹啉杂合是获得新型抗疟疾药物的有效途径。含有酰胺结构片段的三氮唑-喹啉杂合体1(图2)不仅具有良好的抗氯喹敏感型(CQS) D10和耐药型(CQR) K1恶性疟原虫活性,而且可抑制β-血红素的形成,半抑制浓度(IC50)分别为348.8~27518nmol/L,518.6~130625nmol/L和8.9~46.3μmol/L。其中,这类杂合体的抑β-血红素形成活性与CQ(IC50:18.2μmol/L)相当或更优,但抗CQS D10和CQR K1恶性疟原虫活性则弱于CQ(IC50:17.4和354.7nmol/L)。SAR研究结果显示,喹啉核C-7位取代基与活性息息相关,且含氯杂合体的活性普遍优于氰基衍生物。杂合体1a,b的抗CQS D10和CQR K1恶性疟原虫活性最高,IC50分别为348.8, 584.5和518.6, 2399nmol/L,耐药性指数(RI:IC50(K1)/IC50(D10))分别为1.5和4.1。进一步分析发现,与相应的一级酰胺杂合体相比,二级酰胺衍生物的耐药水平更高。C-7位为氰基的杂合体的耐药水平低于相应的含氯衍生物,提示7-氯喹啉母核本身参与耐药性。RI与脂溶性参数log P正相关,提示水溶性杂合体与CQ的交叉耐药性较低。杂合体1b和1c对哺乳动物CHO细胞的毒性较低,IC50分别为10.7和73.2μmol/L,选择性指数(SI:IC50(CHO)/IC50(D10))分别为31和125。
Taleli等测定了一系列喹啉-四氮唑杂合体2和3的体外抗CQS NF54和CQR Dd2恶性疟原虫活性,结果表明,所测杂合体均具有潜在的活性,IC50为8.9~5330nmol/L,但绝大多数杂合体的抗CQS NF54恶性疟原虫活性弱于CQ和青蒿琥酯(IC50:12.1和<5.2nmol/L)。6个杂合体2b~d、2h,3g和3i(IC50:50.8~78.6nmol/L)具有优秀的抗CQR Dd2恶性疟原虫活性,其活性是CQ(IC50:245nmol/L)的3.1~4.8倍,但弱于青蒿琥酯(IC50:24.2nmol/L)。有趣的是,侧链含有小体积胺基取代基杂合体的抗CQS NF54恶性疟原虫活性优于相应的大体积芳胺衍生物,但抗CQR Dd2恶性疟原虫活性观测到类似趋势。代表物2d的抗CQS NF54和CQR Dd2恶性疟原虫IC50分别为9.8和53.5nmol/L,活性优于CQ,值得进一步开发。
三氮唑-QN杂合体4和5的体外抗恶性疟原虫SAR研究结果表明,三氮唑与QN之间连接子的长度与活性正相关,即含有次乙基连接子的杂合体5(IC50:27~345nmol/L)的活性高于相应的次甲基衍生物4 (IC50:450~20000nmol/L)。与无取代衍生物相比,向苯环上引入氯和甲氧基对活性影响不大,但硝基会大幅降低活性。向苯环的对位引入甲基或延长苯环与三氮唑之间连接子长度则对活性有利。其中,杂合体5l(IC50:27nmol/L)和5m(IC50:30nmol/L)的抗CQS 3D&恶性疟原虫活性分别是QN(IC50:58nmol/L)的2.14和1.93倍,值得进一步研究。
次乙基和次丙基连接的三氮唑-喹啉杂合体6 (IC50:0.90~11.52μmol/L)和7(IC50:0.59~4.71μmol/L)具有中等强度的抗CQS D6和CQR W2恶性疟原虫活性,且长链连接子的杂合体7活性优于相应的短链杂合体6,这可能是优于长链杂合体的脂溶性更高所致。向苯环不同位点引入卤素和烷基对活性影响不大,但向苯环对位引入乙酰基则会提高活性。用萘基取代苯基对活性有利,但向芳环引入烷基醇则会导致活性大幅降低。代表物7c的抗CQS D6和CQR W2恶性疟原虫IC50分别为0.59和1.14μmol/L,活性弱于CQ(IC50:0.04和0.42μmol/L)和青蒿素(ART, IC50:0.03和0.25μmol/L)。
如上所述,三氮唑与喹啉之间的连接子对抗恶性疟原虫活性至关重要。进一步研究发现,无连接子的杂合体8和9对所测恶性疟原虫无活性或仅显示出较弱的活性,且烷基连接子的长度与活性正相关。三氮唑-喹啉杂合体的SAR如图3所示。
三氮唑-小檗碱杂合体10(IC50:0.142~28.006μmol/L)具有潜在的抗CQS 3D7恶性疟原虫活性,SAR显示,苯环上的取代基对活性有显著影响:与无取代衍生物相比,向苯环引入氟和氯对活性有利,而甲基和硝基对活性不利。用哌啶、吗啉或甲基哌嗪取代磺酰基上的氨基或苯胺对活性不利。代表物10d的抗CQS 3D7恶性疟原虫活性IC50为0.142μmol/L,且对PC-3 cells无毒,值得进一步优化。
喹诺酮类是仅次于头孢菌素类抗生素的第二大类抗感染化疗药物。除经典的抗菌活性外,喹诺酮类化合物还具有包括抗疟疾在内的多种生物活性。在N-1位含有三氮唑结构单元的氟喹诺酮类衍生物11(IC50:1.33~6.96μg/mL)对CQS 3D7恶性疟原虫具有中等强度活性,且优于对照药环丙沙星(IC50:8.82μg/mL)。SAR显示,无论向三氮唑N-1位引入芳环或者烷基均不会提高活性,而烷基醇和苄基的引入将导致活性大幅下降。活性最高的杂合体11a(IC50:1.33μg/mL)的抗CQS 3D7恶性疟原虫活性是环丙沙星的6.63倍,可作为先导物进一步优化。
所有三氮唑-喹诺酮-亚胺杂合体12均未显示出抗CQR Gambia Cl D-3恶性疟原虫活性,但其脲衍生物13a,b具有中等强度的活性,IC50分别为3.89和3.91μmol/L,这可能是由于杂合体13a,b可抑制二氢叶酸还原酶所致。
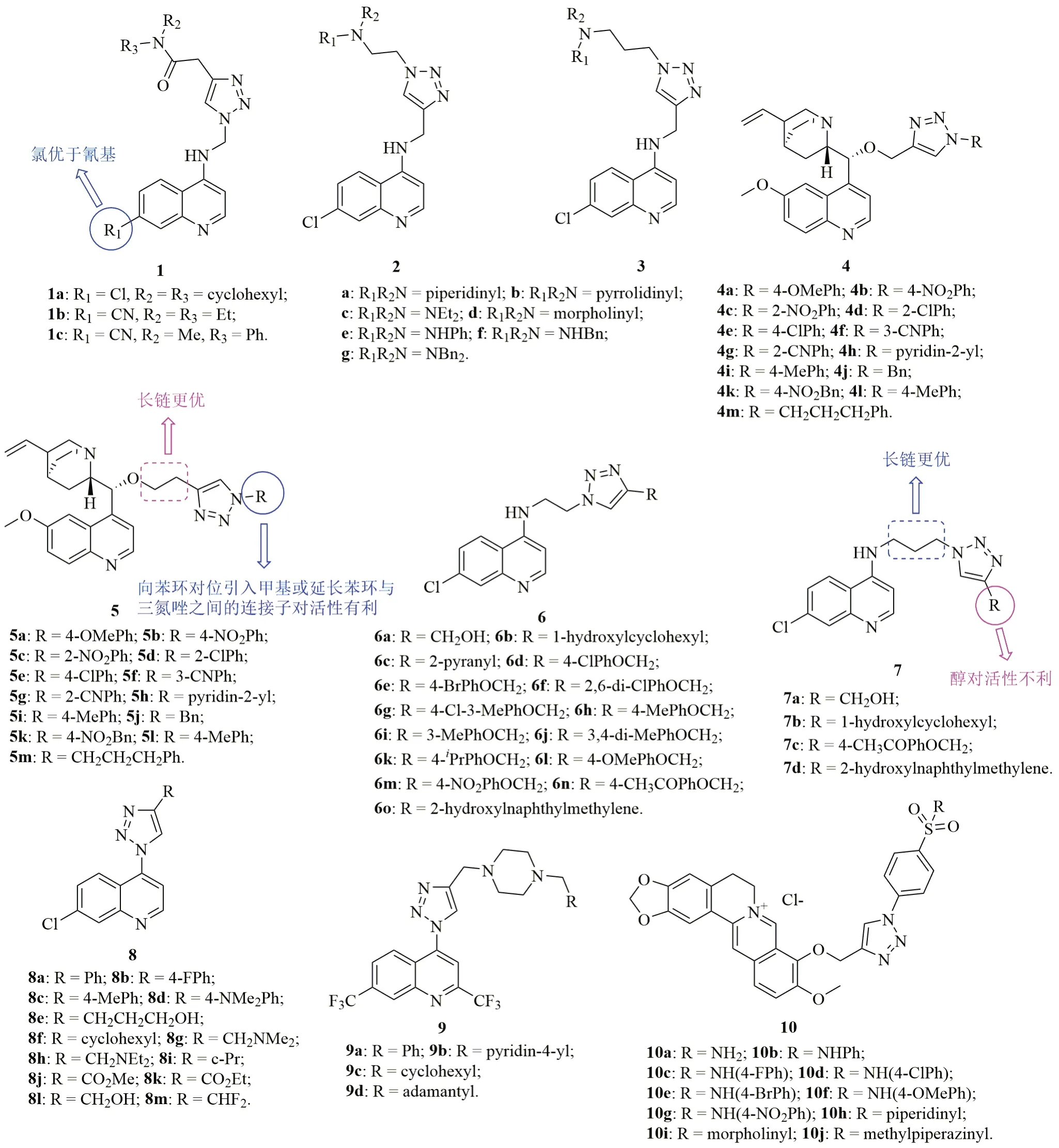
图2 三氮唑-喹啉杂合体1~10的化学结构
2.2 三氮唑作为连接子的喹啉杂合体
药效团之间的连接子对生物活性有极大影响,而三氮唑不仅易于合成,而且具有各种生物活性,是良好的连接子。1,2,3-三氮唑连接的喹啉-均三嗪杂合体14(图5,IC50:0.96~5.97μmol/L)和15(IC50:0.58~2.24μmol/L)对CQS D6和CQR W2恶性疟原虫具有良好的活性,且在浓度高达48μmol/L时对VERO细胞未显示出毒性。SAR显示,杂合体15的活性优于其衍生物14,提示延长三氮唑与喹啉之间的连接子对活性有利。对R1位而言,含有芳基取代基的杂合体活性优于相应的烷基和环烷基衍生物,且向苯环引入供电子的甲基或甲氧基对活性有利。对R1位而言,引入碱性哌啶、吗啉和二甲胺基取代氯原子对活性有利,且取代基对活性的贡献顺序为二甲胺基>吗啉>哌啶>氯。代表物15f(IC50:0.58和0.73μmol/L)的抗CQR W2恶性疟原虫活性与CQ(IC50:0.42μmol/L)相当,但抗CQS D6恶性疟原虫活性低于CQ(IC50:0.04μmol/L)和ART(IC50:0.03μmol/L)。
1,2,3-三氮唑连接的喹啉-脱藻糖泰藻浴星杂合体16a,b不仅具有潜在的抗金黄色葡球菌和表皮葡葡球菌活性,最小抑制浓度(MIC)为0.5~1.0μg/mL,而且对CQR K1恶性疟原虫也具有相当的活性,IC50分别为2.0和0.73μg/mL,提示长链连接子对活性有利。杂合体16b对人二倍体细胞系MRC-5细胞的毒性较低,CC50为43μg/mL,SI为59。研究表明,疏螺体素及其衍生物具有潜在的抗CQS和CQR恶性疟原虫活性。其中,1,2,3-三氮唑连接的喹啉-疏螺体素杂合体17抗CQS FCR3和CQR K1恶性疟原虫的IC50分别为0.079和0.067ng/mL,活性是母药疏螺体素(IC50:0.88和0.93ng/mL)的>10倍。杂合体17对MRC-5细胞的CC50为1050ng/mL,SI和RI分别为≥13400和0.848,具有治疗耐药疟疾的潜力。1,2,3-三氮唑连接的喹啉-kauranoid杂合体17a和17b在浓度为50μg/mL时对CQR W2恶性疟原虫的生长抑制率仅为31.0%和44.0%,仍需进一步优化。
喹啉-查尔酮和三氮唑-查尔酮杂合体均具有潜在的抗疟疾活性,而包含三个药效团的喹啉-三氮唑-查尔酮杂合体可能具有更高的抗疟疾活性。杂合体19~21(图6,IC50:0.04~>20μmol/L)对所测CQS Dd10, CQR Dd2和W2恶性疟原虫具有一定的活性,且SAR显示,连接方式与活性息息相关,且杂合体19(IC50:0.04~5.0μmol/L)>20(IC50:0.3~11.7μmol/L)>21(IC50:2.1~>20μmol/L)。总体而言,向苯环引入2,4-二甲氧基和2,3,4-三甲氧基对活性有利。其中,代表物19b (IC50:0.04, 0.07和0.09μmol/L)的抗CQS Dd10, CQR Dd2和W2恶性疟原虫活性与CQ(IC50:0.017, 0.097和0.069μmol/L)相当,但抑β-血红素形成能力优于CQ。
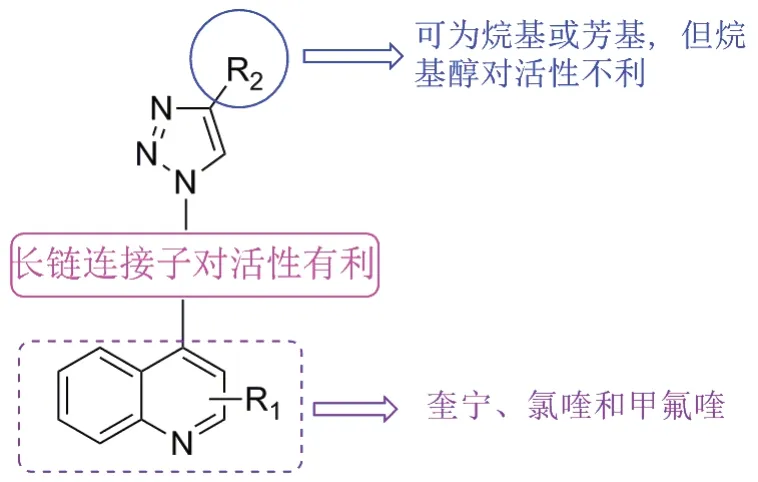
图3 三氮唑-喹啉杂合体的SAR
喹啉- 三氮唑- 查尔酮杂合体2 2 ( I C50:114.1~1909.0nmol/L)和23(IC50:337.1~>10000nmol/L)也具有潜在的抗CQR W2恶性疟原虫活性,且SAR显示杂合体22的活性优于相应的23,提示短链连接子对活性有利。对杂合体22而言,与R1位无取代的杂合体相比,甲氧基的引入可提高活性。代表物22b的抗CQR W2恶性疟原虫IC50为114.1nmol/L,活性不亚于CQ (IC50:150nmol/L),且对HeLa细胞的毒性(CC50:35.6μmol/L)较低。
1,2,3-三氮唑连接的4-胺基喹啉-二茂铁-查尔酮杂合体24~26具有潜在的抗CQR W2恶性疟原虫活性,其中喹啉环上连有烷基胺的杂合体26(IC50:0.37~2.92μmol/L)活性高于相应的哌嗪(24, IC50:2.55~5.08μmol/L)和胺基苯醚(25, IC50:1.16~4.98μmol/L)衍生物。杂合体26j(IC50:0.37μmol/L, CC50:18.20μmol/L)的活性最高且毒性较低,但活性弱于CQ和FQ(IC50:0.060和0.0081μmol/L)。
β-内酰胺-三氮唑-喹啉杂合体27(图7)和β-内酰胺-双(三氮唑-喹啉)杂合体28的抗CQR W2恶性疟原虫活性SAR显示,杂合体28(IC50:1.1~2.8μmol/L)的活性优于相应的27(IC50:1.9~>10μmol/L),这可能由于三氮唑增强了杂合体的溶解性或提高了7-氯喹林与血红素的结合能力所致。杂合体27a和28c抗CQR W2恶性疟原虫活性的IC50分别为1.9和1.1μmol/L,而进一步研究显示,这类杂合体可通过抑制疟原虫的二氢叶酸还原酶(PfDHFR)发挥功效。
喹啉-三氮唑-靛红杂合体29(IC50:118~346nmol/L)和30(IC50:69.0~509nmol/L)具有优秀的抗CQR W2恶性疟原虫活性,且后者的活性优于前者。与无取代的杂合体相比,向靛红的C-5位引入吸电子基如氟、氯或供电子基甲基并不能提高活性。杂合体30c (IC50:69.0nmol/L)的抗CQR W2恶性疟原虫活性与CQ (IC50:60.0nmol/L)相当,但弱于ART(IC50:7.0nmol/L)。
喹啉-三氮唑-靛红杂合体31~33的抗CQR W2恶性疟原虫活性SAR表明,7-氯喹啉与靛红之间烷基连接子的长度与活性正相关,且杂合体33(IC50:1.21~3.85μmol/L)≥32(IC50:1.37~3.07μmol/L)>>31 (IC50:>5μmol/L)。与无取代的杂合体相比,向靛红的C-5位引入吸电子基如氟、氯和溴或供电子基甲基对活性有利,且氯最优。杂合体32c和33c(IC50:1.37和1.21μmol/L)是每个系列里活性最高的化合物,但活性远逊于CQ和ART(IC50:0.099和0.014μmol/L)。
3 三氮唑-香豆素/黄酮/查尔酮杂合体
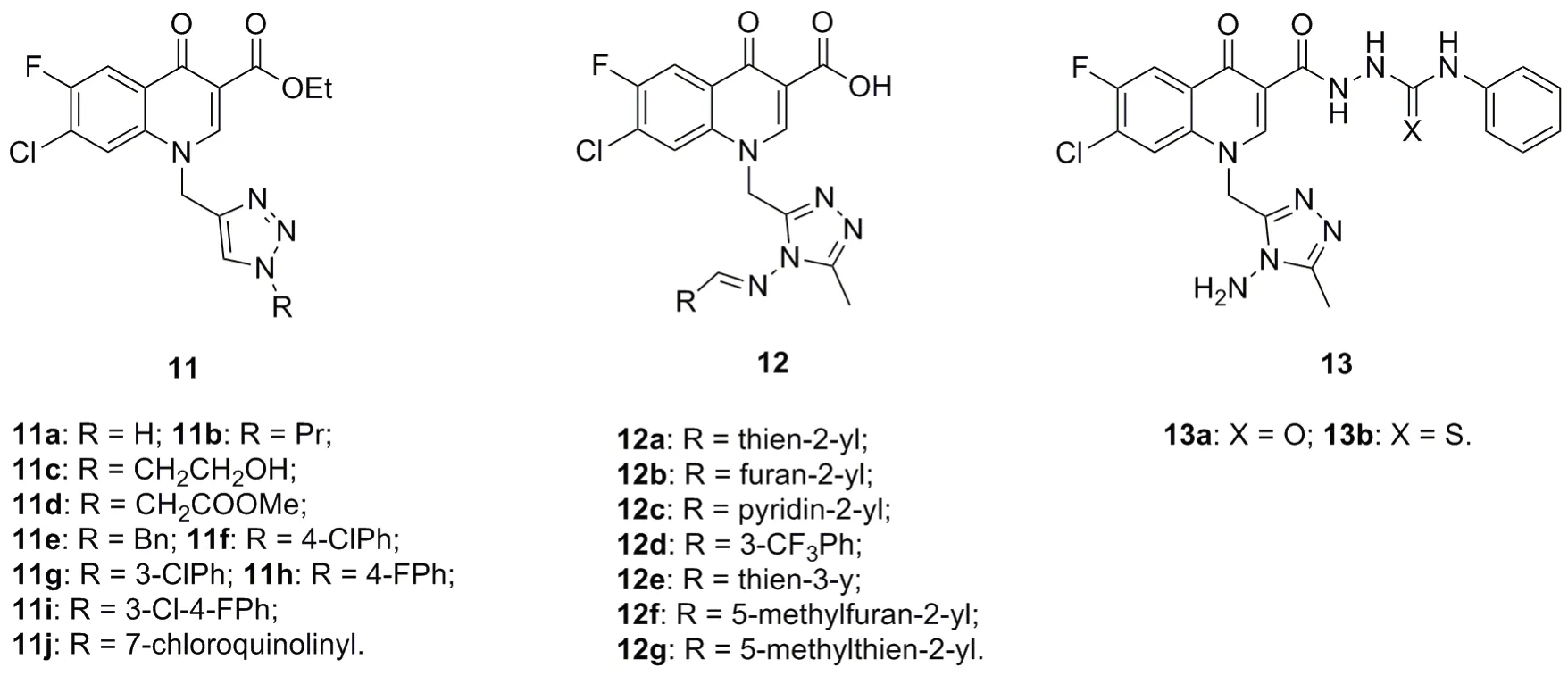
图4 三氮唑-喹诺酮杂合体11~13的化学结构
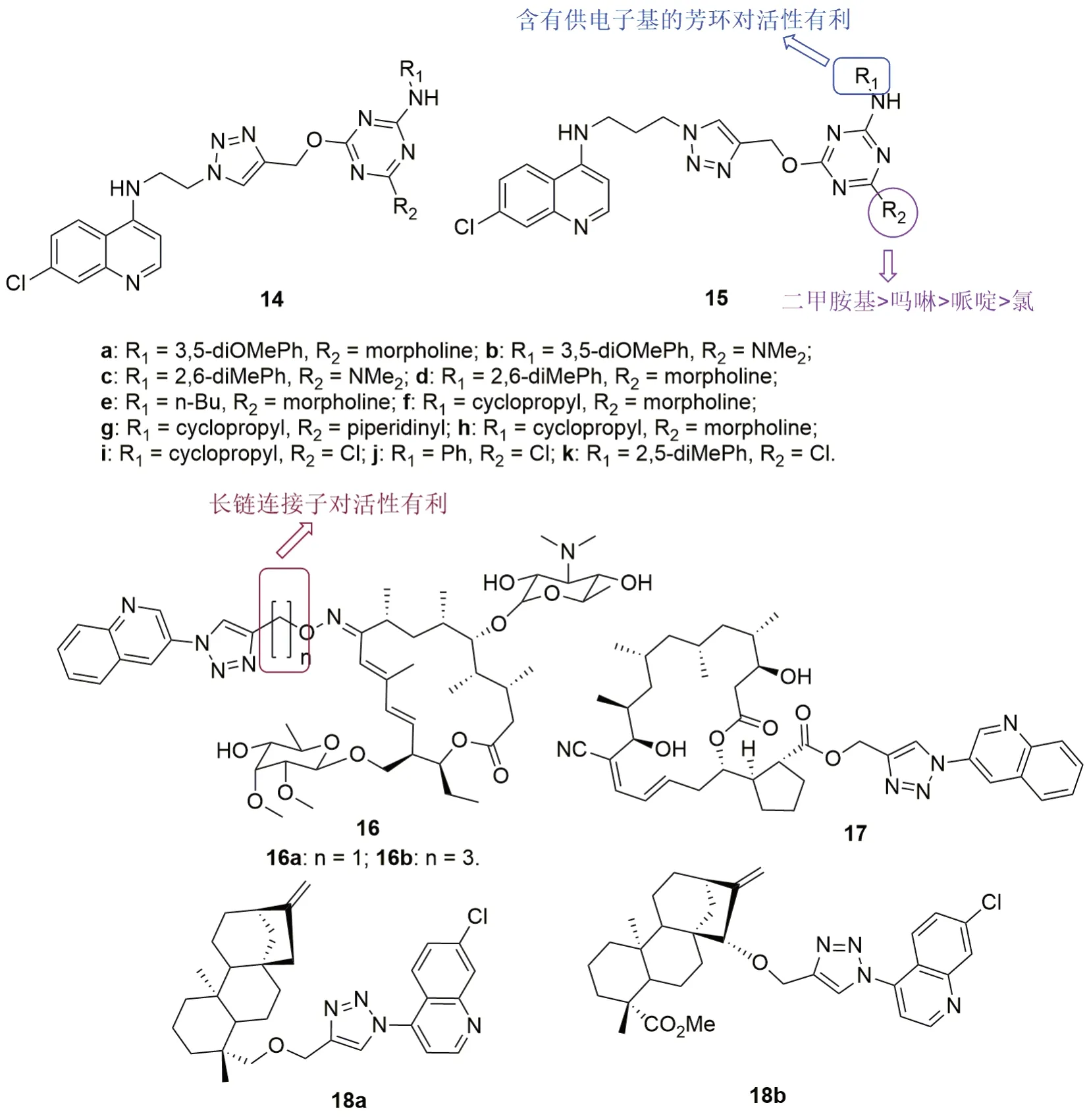
图5 三氮唑作为连接子的喹啉杂合体14~18的化学结构
香豆素和黄酮是天然产物中的常见片段,其衍生物具有潜在的抗疟疾活性。三氮唑-香豆素杂合体34(IC50:0.763~15.40μg/mL)具有抗CQS 3D7恶性疟原虫活性,且与无取代衍生物34r(IC50:1.187μg/mL)相比,向三氮唑引入取代苄基、7-氯喹啉基、羟基次乙基、酯基及除2,4-二甲氧基苯基(34i, IC50:0.763μg/mL)和3,5-二甲基苯基(34l, IC50:0.893μg/mL)之外的苯基取代基对活性不利。作用机制研究结果显示,这类杂合体可抑制疟原虫DNA促旋酶的催化活性,阻止其超螺旋进而诱导疟原虫死亡。
香豆素-三氮唑-查尔酮杂合体35和36的抗恶性疟原虫SAR显示,连接方式与活性息息相关:①所有苯环对位含有三氮唑结构片段的杂合体35d~f和36d~f(IC50:>10μg/mL)均对耐多药K1恶性疟原虫无活性; ②三氮唑在香豆素C-4位优于C-7位。含有2,3-二甲氧基和2,3,4-三甲氧基的杂合体活性最高,IC50为1.60~13.03μmol/L,提示向查尔酮的邻位和间位引入甲氧基对活性有利。其中,杂合体36e不仅对VERO细胞无毒性,而且对耐多药K1恶性疟原虫的活性(IC50:1.6μmol/L)最高,但活性弱于二氢青蒿素(IC50:0.0011μmol/L)。
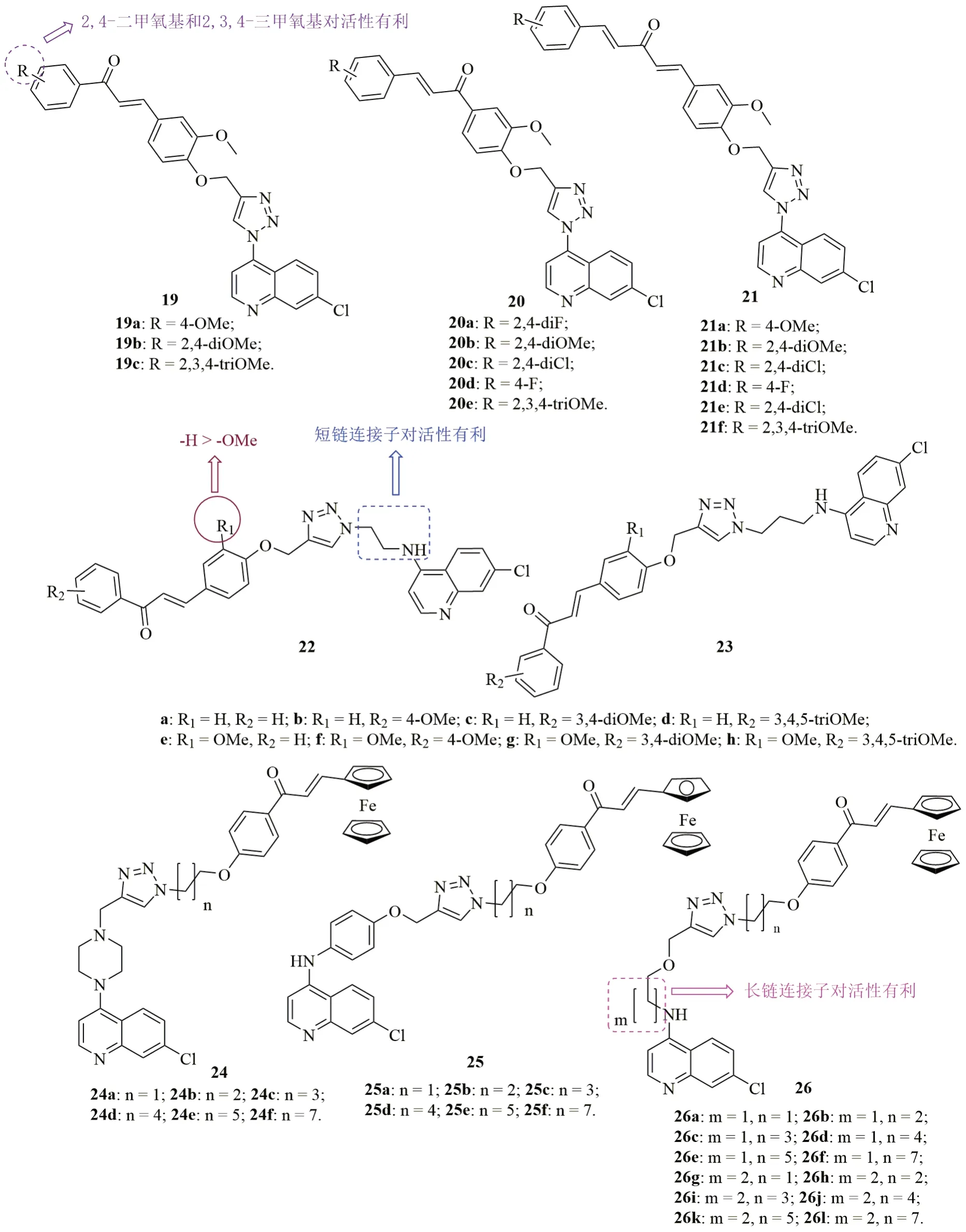
图6 三氮唑连接的喹啉-查尔酮杂合体19~26的化学结构
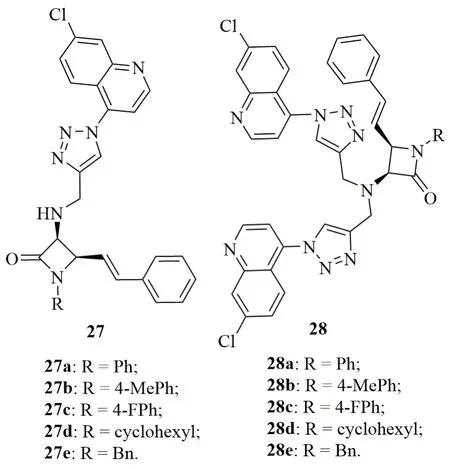
图7 杂合体β-内酰胺-三氮唑-喹啉杂合体27和28的化学结构
三氮唑-黄酮杂合体37(IC50:3.85~12.07μg/mL)和黄酮-双三氮唑杂合体38(IC50:8.98~14.48μg/mL)仅具有弱到中等强度的抗CQS 3D7恶性疟原虫活性,且活性远逊于ART(IC50:1.117ng/mL)。SAR显示,第二个三氮唑结构单元的引入对活性不利,三氮唑-查尔酮杂合体39(图10,IC50:2.74~6.27μg/mL)和查尔酮-双三氮唑杂合体40(IC50:4.92~11.02μg/mL)也观测到了类似的结果,且查尔酮杂合体的活性普遍高于相应的黄酮杂合体。
4 三氮唑-吲哚/靛红杂合体
三氮唑-靛红杂合体41(图11)的抗CQS 3D7和CQR K1恶性疟原虫SAR研究结果表明,向苯环上引入氯原子41b, 41f和41g(IC50:>10μmol/L),将导致活性消失,而其他取代基杂合体具有潜在的活性,IC50为2.25~8.77μmol/L,活性弱于CQ(IC50:0.007和0.44μmol/L)。三氮唑-靛红杂合体42的抗CQS 3D7恶性疟原虫较弱,IC50仅为40μg/mL,但其活性是(S,S)-光学异构体的10倍,提示手性对活性影响巨大。
除化合物43g外的三氮唑并三嗪并吲哚43(IC50:7.10~142.00μmol/L)具有潜在的抗CQS和CQR恶性疟原虫活性,其中无取代或甲基取代衍生物43a~c (IC50:7.10~48.00μmol/L)的活性与CQ (IC50:29.64和277.50μmol/L)和MQ(IC50:38.45和8.12μmol/L)处于同一水平,但向1,2,4-三氮唑结构单元(R1位)引入大取代基如三氟甲基或2-氯苯基将导致活性大幅降低。对R2位而言,引入三氟甲基对活性不利。1,2,4-三氮唑-吲哚啉44a,b抑falcipain-2的IC50分别为4.59和48.78μmol/L,但二者无抗CQR W2恶性疟原虫活性(IC50:>10μmol/L)。

图8 杂合体喹啉-三氮唑-靛红杂合体29~33的化学结构
除化合物45b~d之外的三氮唑连接的靛红-二茂铁杂合体45(IC50:3.76~26.50μmol/L)均显示出抑CQS 3D7和CQR W2恶性疟原虫生长活性,但弱于CQ (IC50:0.021和0.49μmol/L)。SAR显示,连接子的长度与活性正相关,含有次丙基连接子的杂合体45e~h (IC50:3.76~16.20μmol/L)活性高于相应的次乙基衍生物45a~d(IC50:24.43~>100μmol/L)。与无取代衍生物相比,向靛红的C-5位引入氯或甲基对活性不利,但氟可提高活性。代表物45f(IC50:3.76和5.97μmol/L)的抗CQS 3D7和CQR W2恶性疟原虫活性最高,且对HeLa细胞的毒性(CC50:82.14μmol/L)较低,可进一步优化。
靛红- 三氮唑- 查尔酮杂合体46 (IC50:2.18~>20μmol/L)和47(IC50:2.09~>20μmol/L)抗CQR W2恶性疟原虫SAR研究表明,三氮唑与苯环的连接方式与活性息息相关,且对杂合体46而言,间位>对位>邻位,而对杂合体47而言,间位>邻位 >对位。杂合体47b抑制falcipain-2的IC50为15.04μmol/L,但抗CQR W2恶性疟原虫活性(IC50:2.09μmol/L)弱于CQ (IC50:0.0694μmol/L)。
5 三氮唑-β-内酰胺杂合体
绝大多数三氮唑-β-内酰胺杂合体48(图12,IC50:1~7.86μmol/L)具有中等强度的抗CQS 3D7, CQR K1和W2恶性疟原虫活性,但活性远逊于CQ(IC50:0.002~0.02366μmol/L)。SAR显示,R2位和R3位为甲酯的杂合体48a~c抗恶性疟原虫活性较弱。R3位为苯酯的杂合体48d~g抗恶性疟原虫活性与R1位取代基相关,且环己基优于取代苯基。代表物48e(IC50:1.13, 1.21和1μmol/L)对所测所有杂合体的活性最高,可作为先导物进一步优化。

图9 三氮唑-香豆素/黄酮/查尔酮杂合体34~38的化学结构
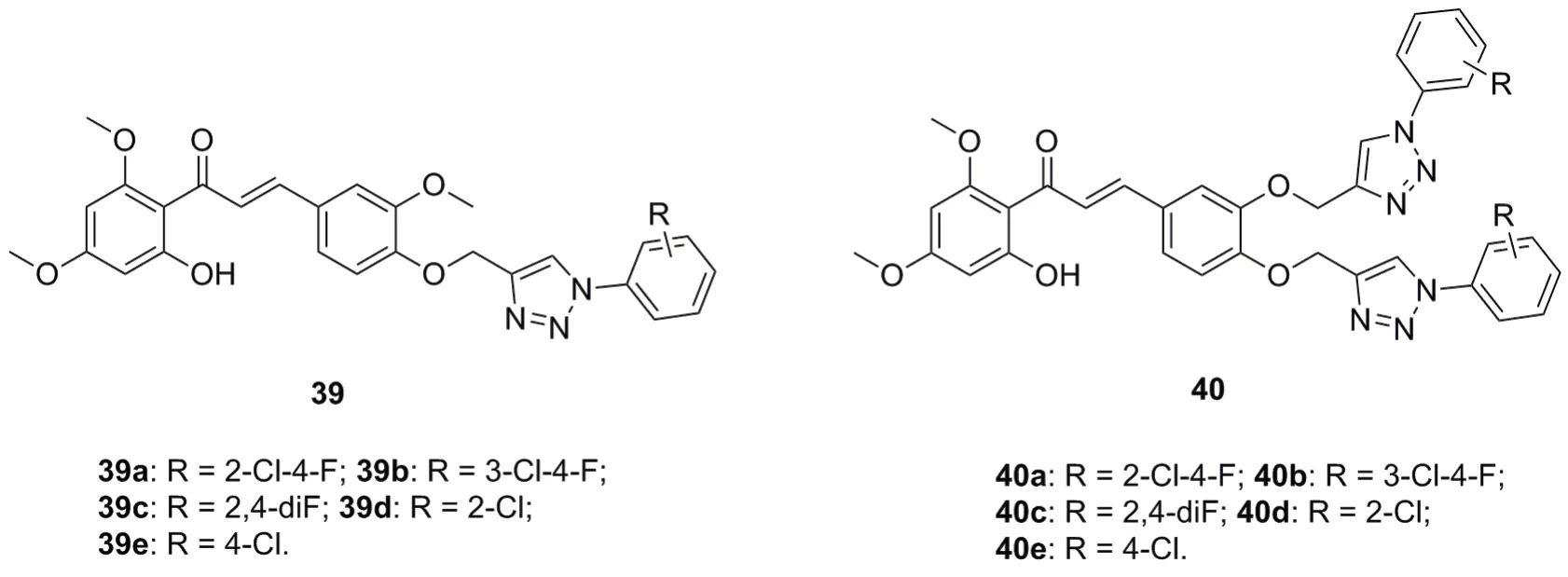
图10 三氮唑-查尔酮杂合体39和40的化学结构
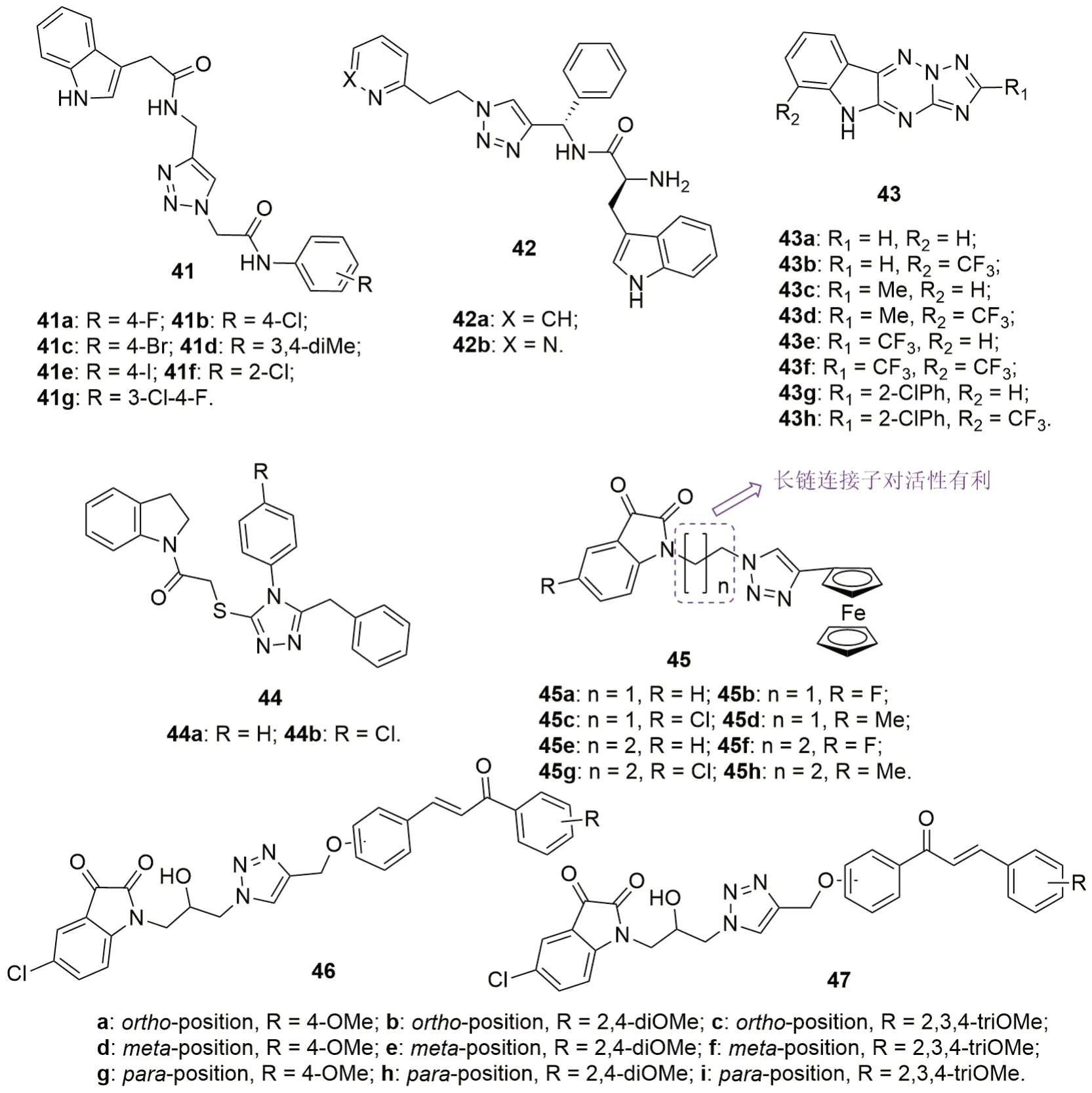
图11 三氮唑-吲哚/靛红杂合体41~47的化学结构
三氮唑-β-内酰胺杂合体49(IC50:5.02~57.51μmol/L), 50(IC50:5.14~>125μmol/L)和β-内酰胺-双三氮唑杂合体51(IC50:<0.97~42.81μmol/L)的抗CQR K1恶性疟原虫SAR显示,第二个三氮唑药效团的引入对活性有利,且51>49>50。对β-内酰胺-双三氮唑杂合体51而言,用酰胺取代R1位醚键对活性不利,且R2位为苄基最优。杂合体51a, 51c和51f的抗CQR K1恶性疟原虫IC50<0.97μmol/L,活性与CQ(IC50:0.80μmol/L)相当,值得进一步研究。
三氮唑连接的β-内酰胺-单/双二茂铁杂合体52(IC50:2.89~26.85μmol/L)和53(图13,IC50:2.36~>100μmol/L)的抗CQS 3D7和CQR W2恶性疟原虫活性弱于CQ(IC50:0.021和0.49μmol/L)。SAR显示,此类杂合体的活性取决于β-内酰胺N-1位取代基,而连接子的长度及二茂铁的个数对活性影响较低。对β-内酰胺N-1位取代基而言,烷基优于芳基。值得一提的是,所有杂合体的RI<1,提示这类杂合体可能具有全新的作用机制。
6 三氮唑-糖杂合体
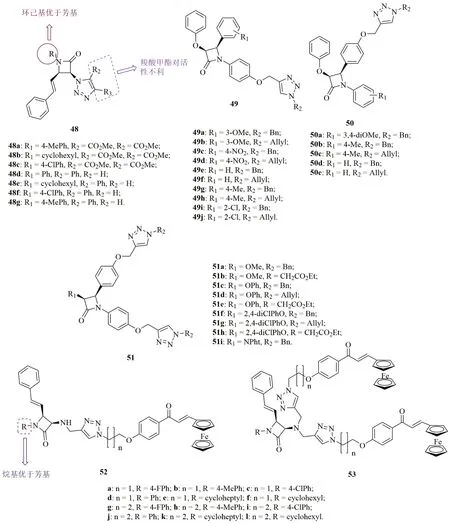
图12 三氮唑-β-内酰胺杂合体48~53的化学结构
Matayoside D, 是从Matayba guianensis根部提取的双糖甙化合物,具有中等强度的抗CQR FcB1恶性疟原虫活性,IC50为3.48μmol/L。三氮唑-matayoside D杂合体53(IC50:12.55~41.55μmol/L)也具有中等强度的抗CQS 3D7和CQR W2恶性疟原虫活性,但弱于CQ(IC50:0.06和1.11μmol/L)。杂合体53b~e的RI<1,具有治疗耐药疟疾的潜力。杂合体53b(IC50:12.55μmol/L)和53d(IC50:12.99μmol/L)分别是抗CQS 3D7和CQR W2恶性疟原虫活性最高的化合物,活性优于母体matayoside D (IC50:17.28和24.59μmol/L)。
糖-三氮唑-靛红杂合体54~60(IC50:1.27~9.34μmol/L)的抗CQS 3D7和CQR K1恶性疟原虫活性弱于CQ(IC50:0.007和0.5μmol/L),且SAR证实,活性与糖结构单元息息相关,且55≈58>57≈56≈60>59≈54。乙酰基保护的杂合体57和58的活性优于羟基衍生物59和60,提示化合物的脂溶性与活性呈正比。杂合体的RI<1,说明这类杂合体的作用机制不同于CQ。
7 三氮唑-氧肟酸杂合体
三氮唑-氧肟酸杂合体61~63(图14)具有潜在的抗CQS 3D7和CQR W2恶性疟原虫活性,且大多数杂合体的IC50在ng/mL水平。SAR显示,三氮唑与氧肟酸之间连接子的长度与活性息息相关,且含有次戊基和己基连接子的杂合体活性最高。对1,2,3-三氮唑结构单元的C-4位取代基而言,萘基和喹啉基(63, IC50:31~165ng/mL)>杂环(62, IC50:36.5~1687ng/mL) >取代苯基(61, IC50:24.5~3500ng/mL)。对杂合体61而言,向苯环的间位引入取代基最有利于活性,且该位点引入第二个苯基可大幅提高活性。所有杂合体的RI在1左右,说明这类杂合体具有治疗耐药疟疾的潜力。其中的14个杂合体的抗CQS 3D7和CQR W2恶性疟原虫活性与CQ(IC50:17和125ng/mL)相当或更优,且对VERO细胞的毒性较低,可作为先导物进一步优化。
三氮唑-氧肟酸杂合体64(IC50:80~>1200nmol/L)及其位置异构体65(IC50:17~>730nmol/L)具有较高的抗CQS D6, CQR W2, 耐多药TM90C235和TM90C2A恶性疟原虫活性,且所有杂合体(IC50:0.02~43μmol/L)也具有良好的抗肿瘤活性。杂合体65d(IC50:17~35nmol/L)对所测所有恶性疟原虫的活性与MQ(IC50:5.9~46nmol/L),且抗CQR W2,耐多药TM90C235和TM90C2A恶性疟原虫活性是CQ(IC50:138~405nmol/L)的3.94~12.65倍。
8 三氮唑-嘧啶杂合体
三氮唑并嘧啶66(图16)作为恶性疟原虫二氢乳清酸脱氢酶(PfDHODH)抑制剂抑DHODH活性与抗CQS 3D7恶性疟原虫活性正相关,提示DHODH是这类杂合体的作用靶点。杂合体66a~t的抑制PfDHODH活性极高,IC50<100nmol/L。三氮唑R1位可引入乙基、异丙基、叔丁基、仲丁基、甲氧基、乙氧基和环丙基等多种取代基,但1,1-二氟乙基, 1,1-二氟丙基和甲硫基最优。代表物66e(IC50:38nmol/L)和66f(DSM265, IC50:33nmol/L)与人和小鼠血浆的蛋白结合率高达97.4%~99.9%,在人和小鼠体内的清除率(CLint)分别为<5, <5, 10.1和8.1μL/min/mg,提示二者具有良好的代谢稳定性。二者对血期和肝期的CQS D6, HB3, NF54, CQR Dd2, K1, 耐阿托伐他汀TM90C2B和TM90C2A恶性疟原虫的活性极高,EC50低至4.6~57nmol/L。细胞毒性试验结果表明,二者即使在浓度高达50μmol/L时对L1210和HepG2细胞也未显示出明显毒性。药代动力学研究结果表明,静脉注射杂合体66f的清除速率较慢[4~6mL/(min·kg)]、分布容积较高(3~6L/kg)、半衰期较长(10~13h),而杂合体66e的清除速率较快[13~23mL/(min·kg)]、分布容积较高(3L/kg),但半衰期较短(4~6h)。二者在口服给药时的口服生物利用度较高,半衰期较长。在感染SCID恶性疟原虫的小鼠模型中,二者(ED90:25.9和8.1mg/kg)抑制外周血寄生虫血症的活性极高,且杂合体66f的活性优于66e。良好的体内外活性和药代动力学性质及低毒性使得杂合体66f极具进一步研究价值。
三氮唑-巯嘌呤杂合体67(腹腔注射给药)在小鼠感染NK 65伯氏疟原虫的小鼠模型中具有良好的活性,且代表物67c在给药d9和d12的活性与CQ相当。遗憾的是,感染小鼠均在26d内死亡。
嘧啶- 三氮唑- 喹啉杂合体68(IC50:7.86~84.15μmol/L)和69(IC50:0.048~10.38μmol/L)具有潜在的抗CQS NF54和CQR Dd2恶性疟原虫活性,但活性弱于CQ(IC50:0.018和0.275μmol/L)。SAR显示,三氮唑与喹啉之间连接子的长度对活性有显著影响,且长度越长活性越高。对R1位的取代基而言,异丙基>乙基>甲基。对R2位的取代基而言,4-硝基苯最优。作用机制研究结果表明,这类杂合体可与包括DNA和血红素在内的多个靶点结合。代表物69j (IC50:0.048μmol/L)的抗CQS NF54恶性疟原虫活性与CQ相当,且对VERO无明显毒性,SI为317.50。
除此之外,其它一些三氮唑-嘧啶杂合体也具有一定的体外抗恶性疟原虫和体内抗疟疾活性,但绝大多数这类杂合体的活性远弱于对照药,无进一步研究价值。
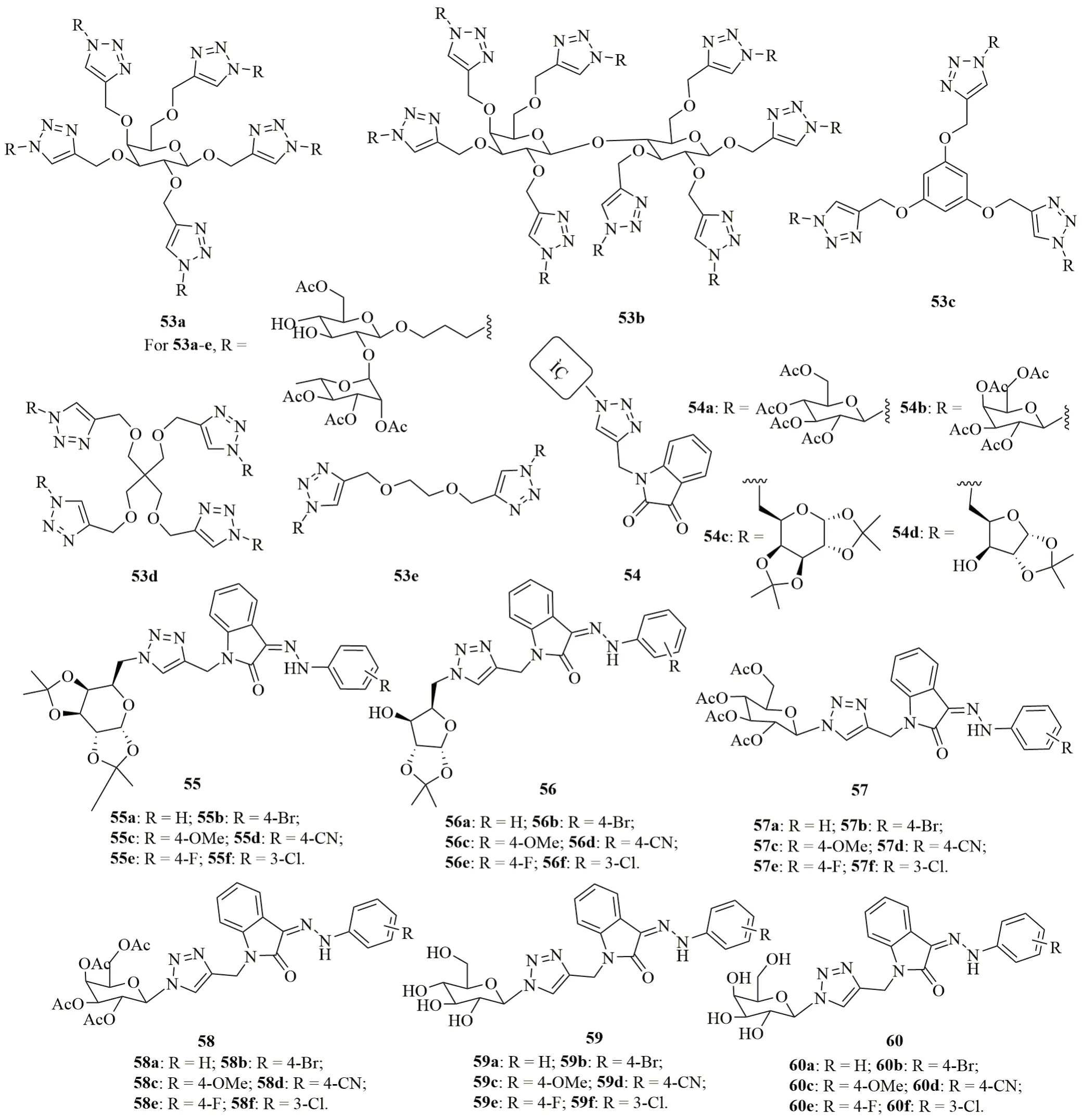
图13 三氮唑-糖杂合体53~60的化学结构
9 三氮唑-唑/啉杂合体
1,2,3-triazole二聚体70(IC50:0.58~8.36μmol/L)具有潜在的抗CQS D6和CQR W2恶性疟原虫活性,但抗CQS D6恶性疟原虫活性弱于CQ(IC50:0.052μmol/L)。所有二聚体的抗CQS D6活性与抗CQR W2恶性疟原虫活性相当,提示这类化合物与喹啉类抗疟疾药物无交叉耐药性。代表物70a的抗CQS D6和CQR W2恶性疟原虫IC50分别为0.697和0.583μmol/L,抗CQR W2恶性疟原虫活性与CQ(IC50:0.46μmol/L)相当。绝大多数三氮唑-二者杂合体71无抑制falcipain-2活性,但化合物71a,b(IC50:19.88和38.97μmol/L)显示出中等强度的活性。三氮唑-吡唑杂合体73(IC50:0.041~1.50μg/mL)具有中等到优秀的抗恶性疟原虫活性,且其中的73b, 73e和73g(IC50:0.041, 0.054和0.092μg/mL)活性与CQ(IC50:0.020μmol/L)相当,但优于QN(IC50:0.286μmol/L)。
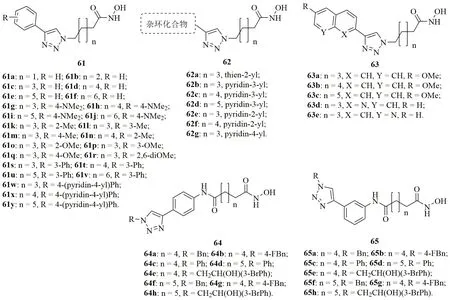
图14 三氮唑-氧肟酸杂合体61~65的化学结构
喹啉- 三氮唑- 吡唑啉杂合体73(IC50:53.7~425.8nmol/L)和74(IC50:77.0~3,003nmol/L)的抗恶性疟原虫活性与连接子的长度和R1及R2位的取代基息息相关。含有次乙基取代基的杂合体73活性高于相应的次丙基衍生物74,且向R1位引入甲氧基对活性有利。杂合体73f, 73g和74m(IC50:58.7, 53.7和77.0nmol/L)的抗CQR W2恶性疟原虫活性ART(IC50:32.1nmol/L)相当,但优于CQ(IC50:150nmol/L)。
10 其它三氮唑杂合体
硫代戊内酯-三氮唑-查尔酮杂合体75(IC50:1.14~5.04μmol/L)和76(IC50:0.68~6.08μmol/L)具有潜在的抗CQR W2恶性疟原虫活性,且连接方式和甲氧基的个数与活性息息相关:邻位≈间位>对位,且甲氧基越多越对活性有利代表物76f和76i(IC50:0.68和0.81μmol/L)的抗CQR W2恶性疟原虫活性最高,但低于CQ(IC50:0.0694μmol/L)。
三氮唑-脒杂合体77(IC50:14.2~866.0nmol/L)具有优秀的抗CQS和CQR恶性疟原虫活性,且77a> 77b>>77c>77d,提示连接方式与活性相关。作用机制研究结果显示,这类杂合体的作用机制与CQ类似,提示可能有交叉耐药性。代表物77a,b(IC50:14.2和79.5nmol/L)的抗CQR恶性疟原虫活性高于CQ (IC50:95.63nmol/L),且在感染279 BY文氏疟原虫的小鼠模型中,二者(0.8和2mg/kg, 腹腔注射给药)可完全抑制寄生虫血症、完全治愈小鼠且无复发。进一步研究显示,杂合体77a的体内外活性最高,且口服给药的ED50为18mg/kg,在口服给药30mg/kg时可完全治愈小鼠。显然,该杂合体可作为先导化合物进一步研究。
三氮唑-磺酰胺杂合体如78a~d(IC50:23~62ng/mL)也具有良好的抗恶性疟原虫活性,四者的抗CQR恶性疟原虫活性与CQ(IC50:20ng/mL)相当,而优于QN(IC50:268ng/mL)。
三氮唑-脲杂合体79抗CQS 3D7恶性疟原虫的IC50为10~3430nmol/L,但弱于对照药阿托伐他汀(IC50:1nmol/L)。SAR显示,用环丙基或异丙基代替脲上的甲基对活性不利。苄基上的取代基对活性的贡献顺序为甲氧基>叔丁基>乙酰基>氟>甲磺酰基>氯>三氟甲基>氰基。代表物79g(IC50:10nmol/L)不仅对HepG2细胞无毒(IC50:>100μmol/L),而且药代动力学性质(Clint:3.0mL/min/g;t1/2:22.6min)较优。在SCID恶性疟原虫感染的小鼠模型中,口服给药杂合体79g的ED50和ED90分别为100和150mg/kg,值得进一步研究。
三氮唑-磷酸杂合体80(IC50:2.75~8.96μmol/L)具有中等强度的抗CQR K1恶性疟原虫活性,而三氮唑-喹喔啉杂合体81(IC50:7.10~153μmol/L)、三氮唑-双喹喔啉杂合体82(IC50:9.76~3540μmol/L)和三氮唑-硫代氨基脲杂合体也具有弱到中等强度的抗CQS 3D7恶性疟原虫活性。
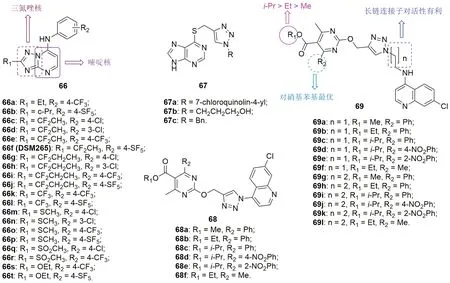
图15 三氮唑-嘧啶杂合体66~69的化学结构
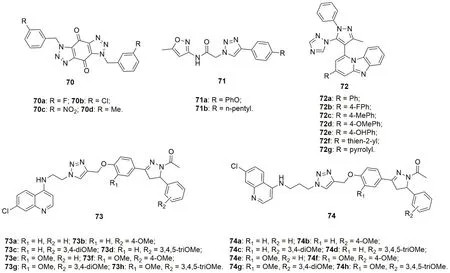
图16 三氮唑-唑/啉杂合体70~74的化学结构
11 结束语
随着耐药疟疾的不断涌现和广泛传播,抗疟疾药物的疗效不断下降。为实现对疟疾尤其是耐药疟疾的防控,亟需研发新型药物。三氮唑类化合物具有多种生物活性,在药物化学领域举足轻重。三氮唑类杂合体如77a和79g具有良好的体内外抗CQS和CQR疟疾活性,证明三氮唑类杂合体可能会在抗疟疾领域大有作为。

图17 三氮唑杂合体75~82的化学结构
本文综述了今年来三氮唑-喹啉/喹诺酮、三氮唑-香豆素/黄酮/查尔酮、香豆素-吲哚/靛红、三氮唑-β-内酰胺、三氮唑-糖、三氮唑-氧肟酸、三氮唑-嘧啶、三氮唑-唑/啉等杂合体在抗疟疾领域的最新研究进展,并总结了SAR,为进一步研究打下基础。

