基于GABA通路研究川芎素对神经病理性痛大鼠模型的保护作用
敬晓鹏,保森竹
(1 青海大学附属医院疼痛科,青海 810000;2 青海大学附属医院整形外科)
神经病理性痛(neuropathic pain,NP)是躯体感觉神经系统的损伤或疾病所致疼痛[1]。研究资料显示,一般人群的神经病理性疼痛患病率高达8.0%。据报道,我国目前神经病理性疼痛的患者约有9 000万,严重影响患者的生活质量[2]。NP病因很多,发病机制复杂,至今尚不完全明确。γ-氨基丁酸(γ-amino-butylic acid,GABA)是一种重要的抑制性神经递质,主要在中枢神经系统通过与其特异性受体结合发挥生理作用[3]。阿魏酸(feralic acid,FA)是当归、川芎等中药中主要有效单体成分,其钠盐为阿魏酸钠片,商品名为川芎素(sodium ferulate,SF),SF具有增强造血机能、抗凝血、抗心肌缺血、抗辐射损伤等作用,临床上主要用于偏头痛、血管性头痛、冠心病、心血管疾病等的治疗[4]。本研究采用坐骨神经结扎慢性损伤法复制大鼠神经病理性痛模型,同时予以不同浓度川芎素进行干预,观察其对NP的保护作用及对GABA信号通路的影响,现报道如下。
1 材料与方法
1.1 实验动物
SD大鼠,雄性40只,体质量210-230 g,由本院实验动物中心提供。饲养1周待适应环境后实验,所有实验大鼠的饲养管理及使用严格按照动物保护学会有关规定进行。
1.2 主要试剂和仪器
3%戊巴比妥钠,购自青岛捷世康生物科技有限公司,批号:HXSJ-021231;川芎素(纯度≥98%,国药准字H51023583),购自成都亨达药业有限公司;Trizol试剂,购自大连宝生物工程有限公司;AceQ qPCR SYBR®Green Mix购自南京vazyme生物公司;miScript SYBR®Green qPCR Kit购自德国QIAGEN公司;一抗兔源GABA抗体、GADD抗体、GAT1抗体、β-actin抗体、二抗羊抗兔IgG均购自英国Abcam公司;Von Frey test触觉测量套件(机械刺痛),购自天津仪数科技有限公司;热刺痛仪,购自上海软隆科技发展有限公司;冷热板测痛仪,购自上海豫研科学仪器有限公司;qRT-PCR引物由上海生工生物工程公司合成;紫外分光光度计,购自美国Thermo公司;qRT-PCR仪购自美国Bio-Rad公司等。
1.3 实验方法
1.3.1 大鼠慢性坐骨神经压迫损伤(CCI)模型制备 参照王东辉等[1]方法制备CCI模型:SD大鼠取右侧卧位固定,腹腔注射3%戊巴比妥钠0.1-0.2 ml/100 g进行麻醉,碘伏消毒大鼠右侧后肢,切开右后肢皮肤,钝性分离肱骨中段坐骨神经的神经干,由近心端向远心端依次每隔相距1 mm用3.0丝线轻度结扎4个结,直至神经外鞘膜稍微受压为宜,打结时可见肢体轻微抽搐,结扎大鼠坐骨神经可见其左侧后爪内敛,后爪轻度外翻和跛行。假手术组钝性分离暴露坐骨神经但不进行结扎。术后大鼠均放回动物房细心护理,每日肌肉注射4万U青霉素,连续3 d,防止手术继发感染。
1.3.2 实验分组 将SD大鼠随机分为5组,每组8只:假手术组(S组),慢性坐骨神经压迫损伤模型对照组(CCI组),川芎素(SF)给药组。川芎素给药组分别按照50 mg/kg,100 mg/kg,200 mg/kg SF(低、中、高剂量SF用0.9%的生理盐水溶解)腹腔注射[4]。S组和CCI组均腹腔注射0.9%生理盐水,注射体积为10 ml/kg。各组小鼠从造模后第8天开始给药(或生理盐水),每天1次,连续给药1周。
1.3.3 机械刺激缩足反射阈值的测定 分别于造模前1 d,造模后7 d,给药后1,3,5,7 d,将各组大鼠置于透明有机玻璃箱中(20 cm×12 cm×20 cm)限定其活动区域,箱底放置0.5 cm×0.5 cm网格铁丝网,使其适应15 min后,测定大鼠机械刺激缩足反射阈值。测定方法:用不同弯折力的Von Frey Filaments(vFFs)纤维丝分别刺激大鼠足底皮肤,维持5 s左右,每次刺激至少间隔15 s,待上一次刺激引起的行为反射消失后再进行下一次刺激,刺激后观察大鼠反应,当大鼠出现明显的缩足、舔足或抖足动作时,视为阳性反应,否则视为无反应,另外vFFs弯折90°时,大鼠仍不缩足,也视为无反应。弯折力最大值为15 g,超过15 g者均按15 g计算,记录每只大鼠折力值,即为机械缩足反射阈值(g)。
1.3.4 热缩足反射潜伏期的测定 分别于造模前1 d,造模后7 d,给药后1,3,5,7 d,采用1.3.2方法限定大鼠活动范围,箱底放置3 mm厚玻璃板,适应15 min后,使用热刺痛仪测定大鼠热缩足反射潜伏期。将热刺痛仪热光源照射大鼠足底,从打开光源至大鼠出现抬足或缩足反应的时间记为缩足反射潜伏期(s)。设定光照时间最长为15 s,刺激温度为30 ℃,避免刺激过程中大鼠烫伤,连续测定3次取平均值,每次间隔15 min。
1.3.5 冷缩足反射阈值测定 分别于造模前1 d,造模后7 d,给药后1,3,5,7 d,采用上述1.3.2方法同样有机玻璃箱限定大鼠活动范围,箱底表面温度为(4 ±1)℃冷玻璃板,使其适应5 min后,记录接下来5 min内大鼠结扎后肢抬足、抖足或舔足次数记为冷缩足反射阈值。
1.3.6 实时荧光定量PCR(qRT-PCR)检测大鼠脊髓组织中GABA通路相关基因表达 末次给药24 h后,将每组8只大鼠均脱臼处死,取腰膨大处(L4/5节段)脊髓,迅速放入研钵中,液氮冷冻后充分研磨,用Trizol试剂提取总RNA,再依次进行反转录和qRT-PCR实验,引物见表1,操作均严格按照试剂盒说明书进行。qRT-PCR采用10 μl体系:cDNA(50 ng/μl)1 μl,上下游引物(10 μmol/L)各0.5 μl,ddH2O 8.0 μl。反应条件为:95 ℃ 90 s,95 ℃ 30 s,63 ℃ 30 s,72 ℃ 15 s,40个循环。以β-actin作为内参,采用2-ΔΔCt法分析脊髓组织中GABA、GAD、GAT1基因mRNA相对表达水平。

表1 qRT-PCR引物序列Table 1 Primer sequences of qRT-PCR
1.3.7 Western blot(WB)检测大鼠脊髓组织中GABA通路相关蛋白表达 末次给药24 h后,按照1.3.6方法将大鼠脱臼处死,取腰膨大处(L4/5节段)脊髓组织,加入裂解液,提取蛋白置于-80 ℃备用。蛋白浓度采用BCA蛋白浓度测定试剂盒进行测定。加入1/5体积6×SDS上样缓冲液,95 ℃ 5 min,冷却离心后置于-20 ℃保存备用。取40 mg蛋白样品行10% SDS-PAGE电泳。用湿转法将胶上蛋白转移至NC膜上,5%脱脂奶粉室温封闭1 h,分别加入GABA GAT1抗体(1 ∶1 000)、GAD抗体(1 ∶1 000)、β-actin抗体(1 ∶1 000),4 ℃孵育过夜,TBST缓冲液洗膜3次,每次20 min,用辣根过氧化物酶标记的羊抗兔二抗IgG(1 ∶3 000)室温孵育45 min,按上述方法洗膜,用免疫印记化学发光试剂(ECL)显色,数字化多功能图像增强化学发光系统曝片,观察结果并进行分析。
1.4 统计学分析
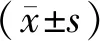
2 结果
2.1 川芎素对CCI大鼠机械刺激缩足反射阈值的影响
各组大鼠造模前机械刺激缩足反射阈值比较,差异无统计学意义(P>0.05)。造模后7 d,与假手术组比较,CCI组和50,100,200 mg/kg川芎素治疗组大鼠机械刺激缩足反射阈值显著降低(P<0.05);给药后,与CCI模型组比较,各时间点50,100,200 mg/kg川芎素治疗组大鼠机械缩足反射阈值显著升高(P<0.05,见表2),而且给药后1 d 100 mg/kg与50 mg/kg组、200 mg/kg与100 mg/kg组、200 mg/kg与50 mg/kg组比较,差异均有统计学意义(P<0.05)。给药后3,5,7 d时50 mg/kg与200 mg/kg比较,差异也有统计学意义(P<0.05)。
2.2 川芎素对CCI大鼠热缩足反射潜伏期的影响
各组大鼠造模前热缩足反射潜伏期比较,差异无统计学意义(P>0.05)。造模后7 d,与假手术组比较,CCI组和川芎素治疗组热缩足反射潜伏期显著降低(P<0.05);给药后,与CCI模型组比较,各时间点川芎素各治疗组大鼠热缩足反射潜伏期显著升高(P<0.05,见表3)。
2.3 川芎素对CCI大鼠冷缩足反射阈值的影响
各组大鼠造模前冷缩足反射阈值比较,差异无统计学意义(P>0.05)。造模后7 d,与假手术组比较,CCI组和川芎素各治疗组冷缩足反射阈值显著升高(P<0.05);给药后,与CCI模型组比较,各时间点川芎素各治疗组大鼠冷缩足反射阈值显著降低(P<0.05,见表4)。

表2 川芎素对CCI大鼠机械刺激缩足反射阈值的影响Table 2 Effect of ligustrazine on the threshold of mechanical stimulation contraction reflex in CCI
与S组比较,*P<0.05;与CCI组比较,#P<0.05;与50 mg/kg组比较,△P<0.05;与100 mg/kg组比较,★P<0.05

表3 川芎素对CCI大鼠热缩足反射潜伏期的影响Table 3 Effects of Ligustrazine on latency of thermosystolic foot reflex in CCI
与S组比较,*P<0.05;与CCI组比较,#P<0.05

表4 川芎素对CCI大鼠冷缩足反射阈值的影响次,n=8)Table 4 Effect of ligustrazine on reflex threshold of cold shrinkage foot in CCI 次,n=8)
与S组比较,*P<0.05;与CCI组比较,#P<0.05
2.4 川芎素对CCI大鼠脊髓组织GABA通路相关基因表达的影响
与假手术组比较,CCI模型组及川芎素各治疗组GABA、GAD mRNA明显偏低,GAT1 mRNA明显偏高(P<0.05),与CCI组比较,川芎素50,100,200 mg/kg组均可显著上调CCI大鼠GABA、GAD mRNA水平,下调GAT1 mRNA水平(P<0.05,见图1)。
2.5 川芎素对CCI大鼠脊髓组织GABA通路相关蛋白表达的影响
与假手术组比较,CCI组、川芎素200 mg/kg组GABA、GAD蛋白表达水平明显降低,GAT1蛋白表达水平明显升高(P<0.05);与CCI组比较,川芎素200 mg/kg组GABA、GAD蛋白表达水平显著上调,GAT1蛋白表达水平显著下调(P<0.05,见图2)。

与S组比较,* P<0.05;与CCI组比较,#P<0.05图1 川芎素对CCI大鼠脊髓组织GABA通路相关基因mRNA相对表达量的影响Figure 1 Relative expression of GABA pathway-related genes in spinal cord of CCI rats after treated with

与S组比较,* P<0.05;与CCI组比较,#P<0.05图2 川芎素对CCI大鼠脊髓组织GABA通路相关蛋白表达的影响Figure 2 Effect of ligustrazine on expression of GABA pathway-related protein in spinal cord of CCI rats
3 讨论
NP是一种由躯体神经系统原发性损伤或功能障碍或疾病等引起的疼痛性疾病[5],其特征主要是自发痛和诱发痛[6],临床表现类型有:痛觉过敏、痛觉超敏、感觉/疼痛异常等[7]。目前临床常用治疗药物有NMDA拮抗剂、抗抑郁药、阿片类镇痛药等[8],然而这些药物针对NP治疗的靶向性并不完全明确,且不良反应较多,治疗具有很大局限性[9]。近来随着动物模型研究增多,对NP研究也不断深入,GABA通路被发现与NP的发生发展密切相关,GABA异常还与失眠等有关[10]。因此本研究拟探究川芎素对神经病理性痛大鼠模型的作用,以及对GABA通路的影响,以期探究川芎素对神经病理性痛大鼠的保护作用机制。
阿魏酸是桂皮酸的衍生物之一,不溶于水,其钠盐阿魏酸钠即川芎素,性质相对稳定,溶于水且易合成,在临床应用广泛[11]。川芎素可直接清除OFR、抗氧化、减少脂质过氧化,还具有抑制血小板聚集、减少细胞内游离钙浓度等作用[12]。有研究发现,川芎素(阿魏酸钠)可通过调节TJ蛋白、MMP-9和AQP4蛋白的表达显著减轻脑缺血和再灌注后血脑屏障破坏[13]。本研究结果发现川芎素治疗,可上调神经病理性痛大鼠机械刺激反射阈值,延长神经病理性痛大鼠热缩足反射潜伏期,降低神经病理性痛大鼠冷缩足反射阈值,提示川芎素对NP具有一定保护作用,但其机制尚不清楚。
GABA是机体一种重要的神经递质,正常情况下与兴奋性递质(如谷氨酸)处于一种动态平衡状态。当GAGB摄取增多或生成减少时,兴奋性递质功能会增强,从而引发疼痛。谷氨酸脱羧酶(GAD)可催化谷氨酸脱羧形成GABA,是GABA合成的关键限速酶[14]。γ-氨基丁酸转运体(GAT)是位于突触前膜、神经胶质细胞膜或囊泡膜上的一种糖蛋白,是突触信息传递的重要调控因子,能选择性将GABA从突触间隙转运至细胞内或囊泡中,从而减少GABA的神经抑制作用[15,16]。GAT1在其4类亚型中占到80%左右,是GABA的主要转运载体[17]。GAT1对于维持突触间隙GABA含量起调节重要作用,GAT1抑制剂具有镇痛作用,而GAT1激动剂或过表达则会引起疼痛或痛过敏[17,18]。本研究基于GABA通路对GABA的合成、代谢和转运进行研究,结果发现,川芎素治疗可显著增加神经病理性痛大鼠GABA、GAD mRNA及蛋白表达水平,下调GAT1 mRNA及蛋白表达水平,提示川芎素可促进神经病理性痛大鼠脊髓组织中GABA、GAD蛋白表达和抑制GAT1蛋白表达。Dubbioso等[19]研究发现,GABA与神经系统紊乱有关,GABA的缺失可增加舞蹈症的发病风险。谌凌燕等[20]研究报道,GABA对神经元有保护作用,升降散可通过抑制NMDAR的磷酸化及提高GABAR mRNA表达水平减轻大鼠神经病理性疼痛。综合以上研究推测,川芎素可能通过上调GABA通路中GABA、GAD蛋白表达和下调GAT1蛋白表达,发挥对神经病理性痛大鼠的镇痛作用。
综上所述,川芎素对大鼠慢性坐骨神经压迫损伤神经病理性痛有良好的镇痛作用,其机制可能与上调GABA通路中GABA、GAD蛋白表达和下调GAT1蛋白表达有关,具体机制尚有待进一步研究。

