STF-31对风湿关节炎成纤维样滑膜细胞凋亡及相关蛋白表达的影响
李佳会,郭 斌,刘亚明,甄亚男,王 颖,霍 强,刘 浩
(蚌埠医学院药学院,安徽省生化药物工程技术研究中心,蚌埠 233030;*通讯作者,E-mail:liuhao6886@foxmail.com;#共同通讯作者,E-mail:620793985@qq.com)
类风湿关节炎(rheumatoidarthritis,RA)是一个系统性的自身免疫性疾病,以对称性、破坏性、慢性多关节滑膜炎为特征,炎性滑膜主要由类风湿成纤维细胞样滑膜细胞(rheumatoid fibroblast-like synoviocytes,RAFLS)组成并积极参与关节炎症和进展[1]。RA表现出一种侵略性的/转化的表型,通过产生炎症介质导致滑膜炎症和软骨损伤[2]。关节破坏的发病机制尚不清楚,但与免疫、炎症等因素密切相关。治疗药物中除了包含传统缓解病情的抗风湿药物(DMARD)外,也包括生物制剂及靶向小分子治疗药物等。虽然RA的治疗有所改善,但目前可用的疾病调节药物并不直接靶向FLS功能障碍。因此,新的合理的设计需要疾病调节剂来代替或补充目前的疗法。对RA的研究主要是利用免疫学、遗传学和细胞生物学技术,但糖代谢对RA发病机制的影响迄今尚未得到重视[3,4]。近年来,一些研究结果表明,糖代谢在RA的发病机制中起着举足轻重的作用。在葡萄糖代谢中,葡萄糖转运体-1(glucose transporters-1,GLUT-1)是一种单一转运葡萄糖蛋白,是各种组织摄取葡萄糖的最基本蛋白,因此,GLUT-1与很多代谢失调的疾病有关[5]。文献表明,RAFLS细胞中GULT1表达上升,且GLUT1的表达量与RA的严重程度成正比[6]。STF-31是一种特异性靶向GLUT-1抑制剂,能够完全抑制葡萄糖的摄取活性,具有合成致死活性,诱导细胞凋亡,且同样可通过降低葡萄糖转运来降低糖酵解[6]。而STF-31对RAFLS细胞的作用尚未有文献报道,本实验旨在研究STF-31对RAFLS细胞的增殖及凋亡的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 主要试剂
DMEM高糖培养基与胰蛋白酶购自Gibco公司,胎牛血清购自浙江天杭生物科技公司,STF-31购自Selleck中国,MTT购自Sigma公司,Bcl-2、Bax、Akt、β-actin等抗体购自Proteintech公司,HRP标记的山羊抗小鼠IgG、山羊抗兔IgG购自博士德生物工程公司,ATP检测试剂盒、线粒体膜电位检测试剂盒(JC-1)购自碧云天公司。
1.2 细胞株
RAFLS购自BNCC细胞库培养于含10%胎牛血清、100 U/ml青霉素、100 mg/L链霉素的DMEM培养基中,放置于37 ℃、5% CO2的细胞培养箱中常规培养。
1.3 MTT比色法检测细胞增殖
取对数生长期的RAFLS细胞株制成终浓度为6×103/ml的单细胞悬液,接种于96孔培养板,100 μl/孔,置于37 ℃,5% CO2,在饱和湿度环境下培养24 h。吸去原培养液,加入葡萄糖转运体抑制剂STF-31处理细胞,24 h,48 h,72 h各加入15 μl的MTT溶液(5 mg/ml)。4 h吸去上清,每孔加入150 μl二甲基亚砜(DMSO),置于37 ℃培养箱继续孵育30 min待甲臜完全溶解,在490 nm波长处用酶联免疫检测仪测吸光度值(OD490 nm)。计算细胞存活率:细胞存活率(%)=实验组OD490 nm/对照组OD490 nm×100%。取均值绘制药物剂量效应曲线并计算药物的半数抑制浓度(IC50)。重复3次取平均值。
1.4 细胞内ATP水平检测
将RAFLS细胞接种于12孔板中(1×105个/孔),培养18-24 h,待细胞汇合达70%时,加入不同浓度STF-31(0,2,4,8 μmol/L)处理。6 h时,收集细胞,离心,弃上清,每孔细胞加入50 μl裂解液,弹击管底使细胞充分裂解。使用4 ℃离心机12 000 r/min离心30 min,取上清用于后续测定(冰上操作)。用BCA蛋白定量法定量。在检测孔中加入事先配好的ATP检测工作液(1 ∶9),每孔100 μl,室温放置5 min,使本底性ATP全部消耗(避光操作)。每孔加30 μl样品或标准品,立即用酶标仪检测。
1.5 JC-1染色检测细胞线粒体膜电位差
将处于对数生长期的RAFLS细胞制成单细胞悬液,接种于12孔培养板,每孔1×105个细胞,培养24 h时加入葡萄糖转运体抑制剂STF-31(0,2,4,8 μmol/L),48 h时,吸除原培养液,PBS溶液洗涤细胞1次,加入1 ml细胞培养液。细胞培养液中可以含有血清和酚红。加入1 ml JC-1染色工作液,充分混匀,细胞培养箱中37 ℃孵育20 min。在孵育期间,配制适量的JC-1染色缓冲液(1×),按照每1 ml JC-1染色缓冲液(5×)加入4 ml蒸馏水的比例,并放置于冰浴。孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗2次。加入2 ml细胞培养液,培养液中可以含有血清和酚红。荧光显微镜下观察并拍照。
1.6 双染法分析检测细胞凋亡
将处于对数生长期的RAFLS细胞制成单细胞悬液,接种于6孔培养板,每孔2×105个细胞,培养24 h时加入葡萄糖转运体抑制剂STF-31,24 h时收集细胞,用PBS洗两次,1 200 r/min离心5 min,加入500 μl Binding Buffer悬浮细胞,加入10 μl Annexin-Ⅴ-FITC混匀后,室温避光反应15 min,再加入5 μl PI染液,1 h内上机检测。
1.7 Western blot检测凋亡相关蛋白Bax、Bcl-2、Akt的表达
将RAFLS细胞接种于6孔板中(2×105个/孔),培养24 h时,加葡萄糖转运体抑制剂STF-31处理。处理48 h时,消化并收集细胞,用预冷PBS洗2次,根据细胞数量加入预冷的蛋白裂解液,冰上裂解30 min,提取细胞总蛋白,BCA蛋白定量法测定各组蛋白浓度。每组取50-90 μg蛋白,SDS-PAGE电泳(70 V,400 mA,50 W,30 min;90 V,400 mA,50 W,90 min);转膜(50 V,200 mA,150 min)至PVDF膜;5%脱脂牛奶室温封闭4 h;一抗室温孵育过夜;TPBS洗膜3次;二抗室温孵育2 h;TPBS洗膜3次;ECL发光试剂盒显影;Bio-Rad凝胶成像系统获取图像。
1.8 统计学分析
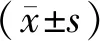
2 结果
2.1 STF-31对RAFLS细胞的增殖抑制作用
MTT检测结果表明,随着STF-31浓度的增加和作用时间的延长,STF-31对RAFLS细胞的增殖抑制作用增加(见图1)。作用24,48,72 h的IC50值分别为9.96,1.38,0.501 μmol/L,与空白对照组比较差异有统计学意义(P<0.05)。

与0 μmol/L比较,* P<0.05图1 STF-31对RAFLS细胞的增殖抑制作用Figure 1 STF-31 inhibits the proliferation of RAFLS cells
2.2 STF-31对RAFLS细胞形态的影响
不同浓度的STF-31作用于RAFLS细胞48 h,在镜下可见,对照组细胞贴壁生长旺盛,细胞间连接紧密,细胞呈梭形,胞膜清楚,胞质饱满,实验组细胞密度减低,无悬浮细胞,细胞间隙增宽(见图2),与空白对照组细胞相比给药组细胞数目明显减少,形态无明显变化。
2.3 STF-31对RAFLS细胞内ATP水平的影响
STF-31作用于RAFLS细胞6 h,与空白对照(0 μmol/L)比较,2,4,8 μmol/L STF-31均可明显降低RAFLS细胞内的ATP水平(P<0.05,见图3),并随着STF-31浓度增加,RAFLS细胞内的ATP水平显著降低。

图2 不同浓度STF-31作用48 h对RAFLS细胞形态的影响Figure 2 Effect of STF-31 on the morphology of RAFLS cells at 48 h

与0 μmol/L比较,* P<0.05图3 STF-31对RAFLS细胞的ATP含量的影响Figure 3 Effect of STF-31 on ATP content in RAFLS cells
2.4 STF-31对RAFLS细胞线粒体膜电位的影响
JC-1荧光出现红色荧光说明线粒体膜电位比较正常,细胞的状态也比较正常;出现绿色荧光说明线粒体膜电位下降,并且该细胞很可能处于细胞凋亡早期。2,4,8 μmol/L STF-31作用48 h均可明显降低RAFLS细胞的线粒体膜电位水平(见图4),提示STF-31可诱导RAFLS细胞线粒体膜电位下降。
2.5 STF-31对RA-FLS细胞总的细胞凋亡的影响
浓度为2,4,8 μmol/L的STF-31处理RAFLS细胞48 h,收集细胞,流式细胞术(Annexin Ⅴ-FITC/PI)双染法检测细胞凋亡比率结果显示,空白对照组的总的细胞凋亡率为(9.12 ±0.6)%;2,4,8 μmol/L的STF-31可诱导RAFLS细胞发生显著的细胞凋亡(见图5),总的细胞凋亡率分别为(16.07 ±2.3)%,(19.56 ±2.7)%,(30.2 ±2.6)%,与空白对照组相比差异有统计学意义(P<0.05)。
2.6 STF-31对RAFLS细胞Bcl-2,Bax,Akt蛋白表达的影响
Western blot结果表明,STF-31可下调凋亡抑制蛋白Bcl-2、p-Akt的表达,同时上调凋亡诱导蛋白Bax的表达(见图6)。

图4 不同浓度STF-31对RAFLS细胞线粒体膜电位的影响 (bar=50 μm)Figure 4 Effect of STF-31 on mitochondrial membrane potential in RAFLS cells (bar=50 μm)

图5 STF-31对RAFLS细胞凋亡的影响Figure 5 Effect of STF-31 on total apoptosis of RAFLS cells

图6 STF-31对RAFLS细胞Bcl-2,Bax,p-Akt蛋白表达的影响Figure 6 Effect of STF-31 on the expression of Bcl-2, Bax and p-Akt proteins in RAFLS cells
3 讨论
正常FLSs细胞主要以有氧代谢提供能量,相比有氧氧化,糖酵解是一种低效率的产能方式。RAFLS细胞中,作为糖酵解途径主要酶的甘油醛3-磷酸脱氢酶和乳酸脱氢酶的活性水平升高,表明RAFLS细胞的糖酵解活性增加[7]。质子磁共振波谱(MRS)研究了RA滑液的组成,检测到乳酸显著升高,葡萄糖浓度降低,同样证实RA滑液中糖酵解活性增加[8]。炎症关节的微环境也表现为缺氧和低浓度的营养物质[9]。缺氧和细胞因子刺激显著增加了糖酵解[10,11]。低氧条件诱导HIF1表达,从而诱导GLUT1表达[12]。GLUT1的表达增加会导致葡萄糖摄取增加、细胞增殖活化,进而加重病程。
STF-31是一种特异性靶向GLUT1抑制剂,可以特异性与GLUT1结合抑制葡萄糖摄取,从而抑制糖酵解。已有研究表明,STF-31能够抑制胶质母细胞瘤、口腔鳞状细胞癌、子宫颈腺癌、头颈癌、结肠癌、骨肉瘤[13]、骨髓瘤[14]及von Hippel-Lindau(VHL)缺陷肾癌细胞[15]中葡萄糖的摄取进而抑制细胞增殖和诱导细胞凋亡。为验证STF-31对RAFLS细胞是否同样有较好的增殖抑制及诱导凋亡作用进行MTT,Annexin-Ⅴ-FITC双染法和JC-1染色,结果表明STF-31对RAFLS细胞有明显的增殖抑制及凋亡诱导作用。细胞凋亡的重要调控因子Bcl-2家族蛋白,包括凋亡抑制蛋白和凋亡诱导蛋白,前者主要有Bcl-2、Mcl-1、Bcl-XL等[16]。凋亡抑制蛋白具有保持线粒体膜的完整性的功能,而凋亡诱导蛋白能够促使凋亡因子如细胞色素C、细胞凋亡诱导因子、第二线粒体衍生的半胱氨酸蛋白酶激活剂等的释放,最终通过激活caspase激酶而导致细胞凋亡[17]。Akt(又称作蛋白激酶B或PKB)作为一种原癌基因,在调控代谢、生长、增殖、存活、转录以及蛋白质合成方面发挥重要作用。本实验中观察到,2,4,8 μmol/L STF-31处理RAFLS细胞48 h,可下调凋亡抑制蛋白Bcl-2及p-AKT的表达,而上调凋亡诱导蛋白Bax的表达,从而增加线粒体膜的通透性以及凋亡因子的释放而诱导细胞凋亡。
鉴于STF-31能够抑制VHL缺乏的RCC细胞葡萄糖的摄取和ATP的产生诱导其凋亡,同时RCC肿瘤种植小鼠模型中显示,肿瘤细胞生长抑制和细胞死亡。ATP结果显示STF-31同样可以降低RAFLS细胞内ATP水平。
由于GLUT受体在正常组织中的普遍表达,在较高剂量下可能导致全身毒性,然而,在低剂量下,STF-31具有通过消耗ATP和下调MDR转运蛋白而增强化学增敏作用,但具有较小毒性。因此,在较低剂量下,STF-31可与细胞毒性药物合用来预防和治疗化学耐药性[18]。综上所述,本实验证明,STF-31对RAFLS细胞增殖抑制且可以诱导RAFLS细胞凋亡,其机制可能是RAFLS细胞通过引起细胞内ATP降低、调节细胞凋亡相关蛋白Bcl-2、Bax、p-Akt的表达。
本实验通过抑制葡萄糖代谢来治疗类风湿关节炎,靶向代谢途径是理解这一问题疾病的机制。抑制葡萄糖代谢可直接调节RAFLS细胞的能量代谢而介导炎症功能,可能是类风湿关节炎的有效治疗策略。

