miR-18a对人滋养细胞中再生蛋白1表达的影响
高 艳,杨 洋,延佳佳,刘成娟
(1 西安医学院第一附属医院超声科,西安 710077;2 西安医学院第一附属医院妇产科;3 空军军医大学唐都医院妇产科;*通讯作者,E-mail:liuchengjuan@sina.com)
子痫前期(pre-eclapmpsia,PE)为产科常见疾病,其发病原因尚未明确[1,2]。滋养细胞凋亡增加,导致细胞浸润能力下降、子宫螺旋动脉重塑异常,最终致胎盘功能障碍可能为PE的病理基础和主要病因学说[3,4]。在妊娠早期,正常功能的滋养细胞保证了胎盘形成及正常妊娠的成功;而滋养细胞凋亡严重程度则与PE疾病呈相关性[5]。相关研究表明,微小RNA(miRNA)能够影响滋养细胞功能,可能与PE发生相关[6,7]。本课题组前期研究表明,在PE胎盘组织中miR-18a呈病理性低表达[8],抑制miR-18a的表达能够增加HTR8细胞的凋亡率[9]。Song等[10]发现,miR-18a能够通过靶向调控再生蛋白(Neogenin),影响脑胶质瘤细胞浸润和凋亡。作为结直肠癌缺失蛋白(deleted in colorectal cancer,DCC)的同源物,Neogenin及其配体在人胎盘组织及绒毛外滋养细胞中均有表达,并参与调节滋养细胞凋亡[11]。
因此,本研究在前期已明确miR-18a与PE的相关性,及其对滋养细胞凋亡能力具有影响作用的基础上,拟分析miR-18a是否能够通过影响Neogenin的表达,进而参与滋养细胞功能调节过程。
1 材料和方法
1.1 细胞株及主要试剂、仪器
HTR8细胞由空军军医大学唐都医院妇产科惠赠。DMEM-F12培养基、胎牛血清(FBS)购自美国Gibco公司;TRIzol Reagent购自美国Invitrogen公司,反转录试剂盒、荧光实时定量PCR反应试剂盒购自日本TaKaRa公司;miR-18a mimics、inhibitor及羧基荧光素(carboxyfluorescein,FAM)标记microRNA NC购自上海吉玛生物公司;Opti-MEM培养基及LipofectamineTM2000转染试剂购自美国Invitrogen公司;细胞裂解液、蛋白定量试剂盒购自科昊生物公司;FITC-兔抗人neogenin单克隆抗体、兔抗人GADPH单克隆抗体、HRP标记的山羊抗兔抗体购自英国Abcam公司;实时荧光定量PCR分析仪购自美国Bio-Rad公司。
1.2 HTR8细胞转染
将冻存的HTR8细胞解冻后接种于RPMI-1640完全培养液(含10% FBS),调整细胞数后接种于培养皿中,5% CO2、37 ℃培养;待细胞生长密度至70%左右时行转染实验。转染实验选取6孔板进行。分为三组:miR-18a过表达组(mimics组)、miR-18a抑制组(Inhibitor组)、阴性对照组(NC组)。消化待转染HTR-8细胞并调整细胞密度,按照LipofectamineTM2000说明书配制转染试剂,配制时避光进行;将转染液逐一加入到对应的6孔板孔中,并设置阴性对照,随即将细胞放入培养箱,初次培养6 h,第一次换液为RPMI1640完全培养液(含10% FBS);随即于荧光显微镜下观察转染效率、记录结果。
1.3 RT-qPCR检测转染后HTR8细胞中miR-18a、Neogenin mRNA的表达
转染后48 h使用TRIzol Reagent提取HTR-8细胞总RNA,测定RNA质量后保存待用。根据PrimerBank公布的基因序列设计miR-18a、Neogenin及内参U6、β-actin的引物序列,具体序列见表1;PCR引物北京奥科公司合成。
吸取1 μl总RNA为模板,反转录合成miR-18a cDNA;根据TaKaRa实时定量PCR试剂盒说明配制反应体系后加样,以U6为内参,进行PCR反应,具体反应条件见表1。
每次检测设定3个复孔,每个样本重复3次。以上在每个PCR循环的延伸期采集荧光信号,PCR反应完成后利用温度梯度变性获得溶解曲线供PCR产物定性分析。根据PCR扩增曲线,得到每个样本的循环周期数(Cq值),使用2-ΔΔCt法计算各组中目的基因mRNA(miR-18a、Neogenin)的表达水平情况。

表1 目的基因引物序列及PCR反应条件Table 1 Target gene primer sequences and PCR reaction conditions
1.4 Western blot检测过表达与抑制miR-18a后HTR8细胞中Neogenin蛋白的表达
转染后48 h使用细胞裂解液提取HTR-8细胞蛋白,并检测蛋白浓度。取30 μg蛋白电泳进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresi,SDS-PAGE),半干法转至PVDF上,将膜置于含5%脱脂奶粉封闭液中,封闭1 h;加一抗兔抗人Neogenin单抗(1 ∶2 500)、兔抗人GADPH单抗(1 ∶1 500),室温孵育2 h;洗涤一抗后加HRP标记的山羊抗兔抗体(1 ∶5 000)二抗孵育1 h;化学发光反应后,显影、定影,用BIO-RAD成像系统对X线片扫描成像,记录灰度值并行半定量分析,目的蛋白的表达量以Neogenin/GADPH比值表示。
1.5 统计学分析
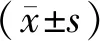
2 结果
2.1 miR-18a转染效率
HTR8细胞中过表达与抑制miR-18a后6 h,于荧光显微镜下观察细胞转染效率约为90%(FAM荧光素酶标记),见图1。

图1 HTR-8细胞转染效率 (×200)Figure 1 HTR-8 cell transfection efficiency (×200)
2.2 转染后miR-18a mRNA水平的表达
RT-qPCR结果显示,与对照组(NC)(0.61 ±0.07)相比,mimics组(1.04 ±0.13)miR-18a表达明显升高,inhibitor组(0.35 ±0.05)miR-18a表达降低,三组间比较差异有统计学意义(F=73.13,P<0.01,见图2)。

与NC组比较,* P<0.01;与mimics比较,#P<0.05图2 miR-18a mRNA在HTR8细胞中水平Figure 2 Levels of miR-18a mRNA in HTR8 cells after different treatment
2.3 抑制miR-18a可增加HTR8细胞中Neogenin在蛋白表达水平
RT-qPCR结果显示,与NC组(0.91 ±0.15)相比,mimics组(0.92 ±0.09)和inhibitor组(0.91 ±0.12)Neogenin在mRNA水平无明显变化(F=0.011,P>0.05,见图3)。
Western blot结果显示,与NC组(0.73 ±0.06)相比,inhibitor组Neogenin表达水平升高(1.18 ±0.40),差异具有统计学意义(F=5.88,P<0.05,见图4)。

图3 过表达或抑制miR-18a后Neogenin在mRNA水平表达Figure 3 Expression of Neogenin at mRNA level after overexpression or inhibition of miR-18a

与其他两组比较,* P<0.05图4 过表达或抑制miR-18a后Neogenin蛋白表达水平Figure 4 Neogenin protein expression level after overexpression or inhibition of miR-18a
3 讨论
作为常见的妊娠期疾病,PE在我国发生率较高[12],因其病因不明,且缺乏安全有效的早期诊断预测方法,往往发病时孕妇机体已发生了不可逆转的病理生理变化,故而其导致围生期母婴死亡率较高[13],临床并发症多。近年来,关于PE的病因学研究领域取得了一定进展,滋养细胞凋亡增加、侵袭能力下降,导致胎盘功能异常,而引发一系列机体变化,逐渐成为其主要病因学说。miRNA能够通过影响滋养细胞功能涉及胎盘浅着床、子宫螺旋动脉重铸障碍等一系列病理过程[6,7],其主要通过对靶基因的调控作用,影响人体多种生理过程,参与包括PE在内的诸多疾病过程。PE时,Zhu等[8]研究表明PE胎盘组织中存在低表达的miR-18a,后续有研究进一步验证了其与PE的相关性[14]。此外,体外细胞功能试验验证了抑制miR-18a的表达可明显增加HTR8细胞凋亡[9]。提示PE相关miR-18a能够通过其某些靶基因介导,共同影响滋养细胞功能。
而miR-18a作为PE相关性因子,其靶基因再生蛋白Neogenin是一种具有多种生物学功能的受体,属于结直肠癌缺失蛋白(DCC)家族成员,其通过与其多种配体相结合,在多种器官组织发育分化、细胞迁移、血管形成以及细胞凋亡等生理过程中发挥重要作用[15]。这提示Neogenin可能也与PE相关。在脑胶质瘤细胞中miR-18a与Neogenin的靶向关系已得到明确,且Neogenin对胶质瘤细胞功能直接具有影响[10]。本研究表明,抑制miR-18a的表达能够影响人正常滋养细胞中Neogenin在蛋白水平的表达(P<0.05);这与上述研究结果[10]部分一致,提示更换细胞平台后,miR-18a与Neogenin之间仍具有靶向调控作用。那么Neogenin是否能够通过miR-18a调控途径与参与PE疾病呢?
Neogenin定位于胎盘及滋养细胞中,参与胎盘形成过程,并与胎儿生长受限、子痫前期等多种病理妊娠相关[16];其对滋养细胞凋亡过程也具有影响作用[11]。另外,钟少平等[17]研究中指出,Neogenin可促进滋养细胞凋亡。而高水平的Neogenin则能够通过其与凋亡相关蛋白激酶(death-associated protein kinase,DAPK)之间的相互作用[18]共同加强细胞凋亡过程,进而影响正常妊娠。本研究中则验证了miR-18a对人滋养细胞中Neogenin蛋白水平的表达存在影响。因此,结合本研究中结果,有如下推论:PE时,滋养细胞中病理性低表达的miR-18a可能通过其在翻译水平对Neogenin的负性调控,使胎盘局部微环境中Neogenin水平升高,并进一步通过自身刺激促进胎盘其他组织部位分泌更多的Neogenin[19];而高水平的Neogenin则能够通过DAPK途径[18],加速滋养细胞凋亡过程,影响胎盘螺旋动脉重铸,引发PE产生。miR-18a可能通过上述途径影响滋养细胞功能,参与PE疾病过程。
综上所述,本研究进一步探讨了miR-18a与PE的相关性,验证了miR-18a对人滋养细胞中Neogenin的表达存在影响;在Neogenin能够影响滋养细胞功能已得到证实的基础上,本研究为进一步探索PE病因,以及miRNA在该疾病预测、临床诊治中应用,提供了部分思路。但具体涉及的机制研究,仍需在后续的实验中不断完善。

