流沙湾浮游动物群落特征及与鱼贝养殖的关系
苏家齐,朱长波,李俊伟,李 婷,陈素文,颉晓勇,张 博
(中国水产科学研究院南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东省渔业生态环境重点实验室,广州 510300)
水产养殖环境为养殖生物提供栖息地并容纳代谢废物,是养殖生物赖以存活生长的基础。养殖生物在环境中生长的同时,也通过呼吸、摄食、排泄以及养殖活动等作用对环境产生影响。水产养殖活动产生的残余物与代谢废物容易打破海域生态系统的营养动力平衡并造成养殖水域富营养化[1]。在地中海的一些贫营养海区,鱼类养殖活动提高了海区生物量并对当地群落结构产生了很大的影响[2]。滤食性贝类的规模化养殖则可引起养殖区悬浮颗粒物的衰减、浮游生物动力学失控,并加速颗粒有机物的沉积[3]。随着水产养殖业的迅速发展和养殖产量的高速增长,水产养殖与环境的交互作用也越来越多地引起人们的重视。
作为海洋食物网中的初级消费者和次级生产者,浮游动物在海洋生态系统中通过参与能量流动和物质循环发挥着重要作用[4-5]。一方面,在水生生态系统中,处于食物网低层的生物往往比高层的生物对环境压力的反应更加敏感[6];另一方面,相对于其它高营养级动物而言,由于其生活史短暂,浮游动物在个体、物种乃至群落结构水平上都可在较短的时间内显示出变化[7],因而浮游动物可作为反映海洋环境变化的指示生物。GOROKHOVA等[8]对波罗的海海洋生态环境状况的评估结果显示,浮游动物生物量、桡足类占总浮游动物生物量的百分比以及枝角类与桡足类比率等指数可对环境状况实现精准评估预测。因此,开展浮游动物群落特征研究,可了解浮游动物群落的动态变化,还可为评估海湾生态系统健康状况及合理利用和优化养殖环境提供理论依据。
流沙湾位于广东省湛江市雷州半岛西南部,是中国最大的海水珍珠育苗与养殖基地,属典型的浅海养殖区。2015年流沙湾的养殖海面已达到16 km2(本研究),占总面积的近四分之一。2011—2016年期间,随着养殖新种的引入和扩大生产,流沙湾海域的养殖模式和布局发生了一系列的变化。而在此期间对该海域浮游动物群落特征的研究仅见于郭永坚等[9]和张才学等[10]的报道。这些报道主要集中在浮游动物群落生态方面的研究,在养殖活动对浮游动物群落结构的影响方面涉及不多,为了解和掌握养殖格局快速变化之下生物群落的响应情况,本文对流沙湾水域开展浮游动物的针对性调查,并纵向比较近年流沙湾浮游动物在种类、丰度上的变化,探讨环境因素和养殖活动对流沙湾浮游动物群落的影响,以期为流沙湾养殖结构优化和生态环境评价提供一定的参考,同时为了解养殖活动对环境的影响提供一定的理论与实践基础。
1 材料与方法
1.1 采样站位点的设定
分别于2015年8月(夏季)、11月(秋季)及2016年2月(冬季)、5月(春季)对流沙湾内湾、外湾进行4个航次的采样调查。采样站位如图1所示。其中扇贝养殖区养殖品种为养殖周期为6—8个月的墨西哥湾扇贝(Argopecten irradians concentricus)和养殖周期约1年的华贵栉孔扇贝(Chlamys nobilis),养殖方式为贝类筏式养殖,有1、2、3、6号站位;珠母贝养殖区有7号站,主要为筏式养殖;8号站位位于湾口鱼类网箱养殖区;4、9号站位分别位于内、外湾主航道;5号站位为外海边界;10、11号站位为内湾采样站位;12号为外湾近岸采样站位。
1.2 浮游动物的采集与分析
浮游动物样品的采集与定量参照《海洋监测规范 GB17378.7-2007》[11]。定性样品采用浅水Ⅱ型浮游生物网自海底向海面垂直拖曳,现场用5%福尔马林固定后,带回实验室后用倒置显微镜进行分析鉴定及计数。

图1 流沙湾养殖布局及采样站位图Fig.1 Farming structure layout and sampling stations in the Liusha Bay
多样性指数采用香浓韦弗计算公式(Shannon—Weaver):;均匀度采用Pielou计算公式;优势度计算公式中,s为物种数,P为第 ii物种在全部采样中的比例,ni为第i种的个体数,N为所有种的个体总数,S为样品种类总数,fi为第i种在各站点的监测频率。Y≥0.02视为优势种。选用种类更替率(R)进行流沙湾各季优势种的变化研究,其计算式:R(%)=[(a+b-2c)/(a+b-c)]×100[4]。式中,a与 b分别为相邻 2个时间段的种类数,c为相邻2个时段共同的种类数。
1.3 环境因子的测定
海水溶解氧(DO)、水温(T)、盐度(S)和 pH采用便携式水质分析仪(YSI-556型)现场测定,透明度(SD)采用萨式盘法测定。水样中亚硝酸盐(NO2-N)采用萘乙二胺分光光度法,氨氮(NH4-N)采用靛酚蓝法,硝酸盐(NO3-N)采用锌(Zn)-镉(Cr)还原法,活性磷酸盐(PO4-P)采用磷钼蓝分光光度法测定,总磷(TP)采用过硫酸钾氧化法测定。叶绿素 a(Chl-a)及颗粒有机物(POM)的测定方法分别为丙酮萃取法和灼烧称重法。以上方法均按照《海洋监测规范GB17378.4-2007》指定方法进行[12]。
1.4 数据处理和分析
采用PRIMER 6.0软件对浮游动物丰度进行lg(x+1)转换,建立Bray-Curtis相似性聚类分析,并进行非度量多维尺度排序(nMDS),同时检验浮游动物群落季节差异(ANOSIM)[13]。用Canoco 4.5版软件分析环境因子对浮游动物物种分布的影响,相关数据除pH外,经过lg(x+1)转换。本文将各季出现的优势种(类群)作为排序物种,对排序物种数据进行去趋势对应分析(DCA),发现4个轴中梯度最大值为3.322,故选择典范对应分析(CCA)进行物种-环境相关性分析。采样站位平面图用ArcMap10.2软件绘制。不同季节间的浮游动物丰度、生物量及多样性指数的比较采用单因素方差分析法。为实现方差齐性,对浮游动物丰度和生物量进行倒数转换并采用Turkey HSD进行分析,多样性指数则采用未假定方差齐性的Dunnett T3进行分析,差异显著性设置为P<0.05。数据的分析处理采用SPSS 19.0统计软件。
2 结果与分析
2.1 浮游动物的种类组成及优势种
如表1和附表1所示,夏、秋、冬、春4个航次共记录到浮游动物18大类119种、浮游幼体17种。浮游动物以桡足类(45种)和端足类(20种)居多,其次为毛颚类(15种)、水螅水母类(12种)、等足类(6种)。被囊动物和多毛类各4种,十足类和管水母类各2种,其余栉水母门、枝角类、异足类、原生动物、翼足类、磷虾类、涟虫类、糠虾类,介形类各1种。春季种类数以桡足类(14种)及浮游幼体(10种)居多,夏季流沙湾端足类(18种)和桡足类(18种)最多,秋季桡足类(22种)和毛颚类(11种)所占比例较大,冬季则桡足类(23种)、毛颚类(9种)、浮游幼体(8种)种数最多。

表1 2015—2016年四季流沙湾浮游动物的种类组成Tab.1 Seasonal zooplankton composition in the Liusha Bay during 2015—2016
如表2所示,调查期间发现浮游动物优势种(类群)共计17种,多为暖水近岸类群和暖水广盐类群。浮游动物优势种秋季最多,夏季次之,冬季最少。其中太平洋纺锤水蚤(Acartia pacifica)、红纺锤水蚤(Acartia erythraea)、肥胖箭虫(Sagitta enflata)为春季优势种。太平洋纺锤水蚤、肥胖箭虫、钳形歪水蚤(Tortanus forcipatus)为夏季优势种。肥胖箭虫、钳形歪水蚤、亚强次真哲水蚤(Subeucalanus subcrassus)、微 驼 隆 哲 水 蚤(Acrocalanus gracilis)、微剌哲水蚤(Canthocalanus pauper)、驼背隆哲水蚤(Acrocalanus gibber)、强次真哲水蚤(Subeucalanus crassus)、小拟哲水蚤(Paracalanus parvus)、百陶箭虫(Sagitta bedoti)为秋季优势种。夜光虫(Noctiluca scintillans)仅在冬季的7个站位中出现,但由于其丰度远高于其它种,优势度Y高达0.52而成为冬季的主要优势种。十足目幼体(Decapod larvae)为春、夏、秋三季的优势类群。箭虫幼体(Sagitta larvae)、钩虾(Gammaridean spp.)、桡足类幼虫(Copepoda larvae)为夏季优势类群。鱼卵(fish eggs)为冬季的优势类群。在流沙湾不同季节出现的优势种(类群)中,十足目幼体、肥胖箭虫、桡足类幼虫、百陶箭虫、鱼卵、红纺锤水蚤、箭虫幼体、亚强次真哲水蚤、微驼隆哲水蚤在四季均有采获,其中十足目幼体和肥胖箭虫在3个季节中成为优势种(类群)。各季节浮游动物优势种(类群)组成发生较大的变化,其中春夏两季的优势种更替率为62.5%,夏秋之间的更替率为78.5%,秋冬两季的优势种更替率则为100%。
2.2 群落结构
浮游动物群落组成的ANOSIM结果显示,流沙湾浮游动物群落的季节差异极显著(Global R=0.659,P=0.001)。流沙湾四季浮游动物nMDS排序结果如图2所示,以40%相似度为依据,春季,位于外湾航道4站位十足类幼虫丰度较低,与其它站位浮游动物群落组成差异明显。夏季8、9站位采集到了大量的钩虾、麦秆虫等端足类,群落组成比较相似。10、11站位群落中以麦秆虫为主,组成比较相似。秋季8、9站位群落组成比较相似,内湾10、11站位与外湾3站位各自独立聚类。冬季1~8(不含3)站位均有检出夜光虫,群落组成比较相似,外湾3、12站位、内湾9~11采样站位则各自独立聚类。
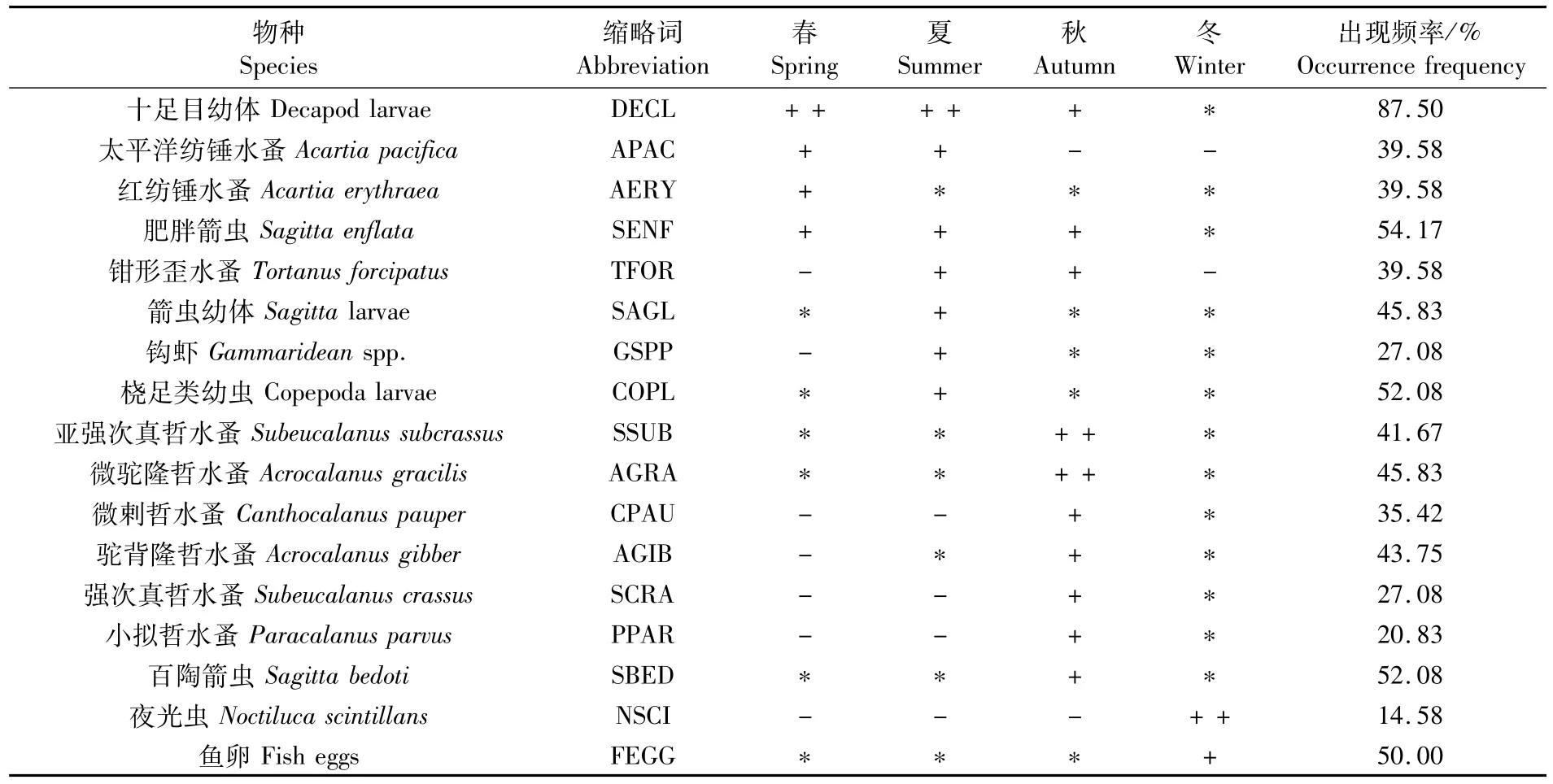
表2 流沙湾浮游动物优势种优势度的季节变化Tab.2 Seasonal variations in dominance of dominant species of zooplankton in the Liusha Bay

图2 流沙湾四季浮游动物群落的多维尺度分析Fig.2 The nMDSof zooplankton of four seasons in the Liusha Bay
2.3 浮游动物丰度与生物量的时空变化
2015—2016年流沙湾浮游动物年均丰度和生物量分别为 151.53个·m-3和 73.48 mg·m-3,四季平均丰度高低依次为冬(455.16个·m-3)、夏(93.63个 · m-3)、秋 (28.70个 ·m-3)、春(28.63个·m-3),其中冬季与秋季差异显著(P<0.05)。浮游动物四季平均生物量大小依次为夏(148.38mg·m-3)、冬(107.07 mg·m-3)、秋(22.87 mg·m-3)、春(15.59 mg·m-3),各季之间无显著差异。如图3所示,春季除站位3之外,扇贝养殖区站位和珍珠贝养殖站位生物量低于对照组4、5站位。夏季6、7、8、9站位生物量远大于其它站位。秋季,外湾对照的4、5站位生物量最大,其次是珍珠贝养殖区,再次为扇贝养殖区,鱼排养殖区生物量最低。在冬季由于夜光虫的大量出现,4、5、6、7站位的生物量和丰度远高于其它站位,去除夜光虫的高丰度对其它浮游动物的遮蔽影响之后,冬季4、5、6、7站位丰度最高,8、9号站位最低。四季平均丰度高低依次为夏(93.63个·m-3)、冬(51.47个·m-3)、秋(28.70个 · m-3)、春 (28.63个 ·m-3),其中夏季与春秋两季差异显著(P<0.05)。
2.4 浮游动物的多样性指数与均匀度的时空变化
流沙湾四季多样性指数H′由大到小依次为夏(3.01)、秋(3.00)、春(2.07)、冬(2.05),春季与夏秋两季差异显著(P<0.05)。浮游动物均匀度指数 J由大到小依次为秋(0.87)、夏(0.81)、春(0.68)、冬(0.57)。如图4所示,春季,各站位的浮游动物多样性指数范围为3.08~0.93;其中对照海区的4、5采样站分别为3.08和3.00,高于贝类、鱼类养殖区以及内湾各采样站。夏季,位于内湾的10、11采样站位的多样性最低,分别为2.12和2.41;其余各站位浮游动物多样性指数均接近或大于3。秋季位于内湾的10、11站位的多样性最低,分别为2.00和2.06;其次为3号站位和8号采样站位,分别为2.45和2.42,其余各站位浮游动物多态性指数均大于3。冬季,受夜光虫的影响,4~8号位点的多样性远低于其它站位。除7号位点之外,其余4个位点的多样性指数均小于1。

图3 流沙湾各采样站位浮游动物丰度及生物量Fig.3 Density and biomass of zooplankton at different sampling stations in the Liusha Bay

图4 不同采样站位浮游动物多样性指数与均匀度指数Fig.4 Diversity and evenness index of zooplankton at different sampling stations in the Liusha Bay
2.5 浮游动物与环境因子的典范性分析
调查期间流沙湾4个季节环境因子的平均值见表3。对优势种与环境因子间进行典范对应分析(canonical correspondence analysis,CCA)及蒙特卡罗置换检验,结果显示第1轴和全部轴均呈极显著差异(P=0.002),表明CCA排序结果可信。CCA分析中13个环境因子可解释浮游动物群落总变量的63.7%,第1轴和第2轴的特征值各解释了42.5%和24.5%的物种变量,且物种与环境的相关系数分别达到0.96和0.93,证明物种数量及分布与环境因子的相关性较好。如图5所示,CCA结果表明,溶解氧(F=11.46,P=0.002)和磷酸盐(F=8.12,P=0.002)是影响浮游动物群落分布的主要环境因素,其次是透明度(F=7.70,P=0.002)、温度(F=4.34,P=0.002)和硝酸盐(F=1.85,P=0.048)。不同浮游动物对环境因子的趋向不同,钩虾、钳形歪水蚤多分布在水温较高的区域,夜光虫、鱼卵等相对分布在相对低温区域,并且对溶解氧要求较高。
2.6 流沙湾不同养殖区浮游动物丰度、生物量及多样性指数
图6比较了外湾对照区(站位4、5、12)、扇贝养殖区(站位1、2、3、6)、珍珠贝养殖区(站位 7)、网箱鱼类养殖区(站位8)和内湾区(站位9、10、11)的浮游动物平均丰度和生物量。结果显示,鱼类小网箱养殖区浮游动物丰度和生物量在春、夏两季高于其它区域,在夏季最为明显。而在秋季之后迅速回落,生物量和丰度低于其它各区域。除夏季外,扇贝养殖区的生物量和丰度则要低于外湾对照区。此外,外湾对照区的浮游动物丰度普遍要大于或近似于内湾,同时其生物量除夏季外也高于内湾区。
流沙湾各区域的浮游动物多样性指数则如图7所示,外湾对照区和珍珠贝养殖区在春、夏、秋三季的多样性指数高于其它各区。扇贝养殖区的多样性指数除冬季外要低于外湾对照区,但是在夏、秋两季多样性指数仍大于3。鱼类小网箱区的多样性指数则在夏、秋、冬三季低于扇贝养殖区。

图5 流沙湾浮游动物与环境因子间的CCA排序图(字母缩写含义见表2)Fig.5 CCA ordination of species-environment of zooplankton in the Liusha Bay(Refer to Tab.2 for abbreviations)

表3 流沙湾主要水质参数Tab.3 Main parameters for water quality in the Liusha Bay

图6 流沙湾不同区域浮游动物丰度及生物量Fig.6 Zooplankton density and biomass in different areas in the Liusha Bay
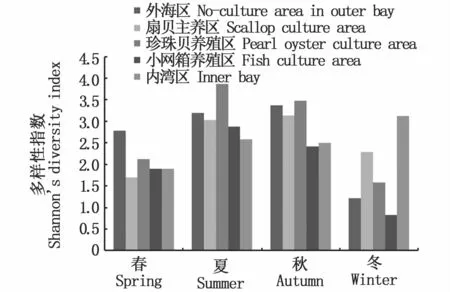
图7 流沙湾不同区域浮游动物多样性指数Fig.7 Diversity index of zooplankton in different areas in the Liusha Bay
3 讨论
3.1 流沙湾浮游动物种群结构及其动态变化
本次调查发现,流沙湾浮游动物优势种多为近岸暖水型生态类群,浮游动物群落存在显著的季节差异,表现出较明显的亚热带海湾特征[10]。此外,流沙湾的浮游动物种群动态变化与环境因子存在着一定的联系。夜光虫为冷水性种类,因而大量出现在平均水温为18℃的冬季[14]。在秋季的10个优势种中,有6种为植食性的哲水蚤,流沙湾叶绿素浓度在秋季最低,体现了浮游动物对浮游植物的摄食压力。而在叶绿素浓度最高的春季,流沙湾的桡足类和其它浮游动物的种数、丰度、生物量也最低。CCA结果显示,溶解氧和硝酸氮是影响流沙湾浮游动物优势种群落分布的主要环境因素,流沙湾的桡足类种数为冬>秋>夏>春,与溶解氧和硝酸盐的季节差异相同。
如表4所示,2015—2016年流沙湾海域浮游动物的主要类群仍然以桡足类和浮游幼虫为主,然而桡足类所占的比例有所降低,毛颚类、端足类、等足类和水螅水母类的种类有所增加。本次调查1~10站位采集的端足类中有钩虾亚目14种、麦杆虫亚目4种、亚目1种,主要出现在夏季的8~10采样站位。钩虾和麦杆虫多数为营底栖生活,同时也是常见的污损生物,能大量附着于浮筏、网笼等养殖设施上。研究表明麦杆虫和钩虾等往往在水温较高的夏季成为深水网箱、扇贝养殖区污损生物优势种[15-16]。流沙湾网箱数量较大,且密布于湾口航道处,同时在养殖活动中产生大量的残饵、粪便等有机质,可为端足类附着生物提供较好的栖息环境及充足的食物来源。在鱼类养殖活动达到高峰的夏季,网箱养殖区出现了18种端足类生物,占流沙湾全年端足类总种数的90%。
在流沙湾海区,水螅水母类零散分布于外湾1~7站位且除春季外均有采获。左涛等[17]认为与外海相比,由于海湾内海流引起的物理驱散扰动小且初级生产力较高,利于水螅水母类水螅体的附着生活,因此湾内水母种类通常较为丰富。郑白雯等[18]对北部湾的调查发现水螅水母类和桡足类是北部湾海区的优势类群。然而,往年调查表明流沙湾水螅水母种类不多。早期数据显示,流沙湾潮流运动为带有旋转流的往复流运动,落潮流速大于涨潮流速且余速较强,海水自净能力很强[19]。相比往年,2015年流沙湾外湾的养殖覆盖率大大提高,约占外湾总面积的50%,可能对流沙湾的海水流速及水交换产生更大的影响,因此更加适宜水螅水母类的生存。养殖面积尤其是鱼类网箱养殖面积的增加提高了海区的营养化水平,进而提高了生产力水平,丰富了浮游植物、小型桡足类的数量和种类,同时为水螅水母类和毛颚动物提供了食物来源[20]。
3.2 环境因子对浮游动物的影响
浮游动物群落结构及季节变化与水文、化学等环境因子密切相关[21]。水中溶解氧参与硝化反应、沉积物需氧、光合作用和水生生物呼吸作用等多个化学和生物反应,是海水重要的化学指标之一[22]。王巧宁等[23]进行了低氧对中华哲水蚤(Calanus sinicus)存活和繁殖影响的实验研究,结果表明与溶解氧为8.5mg·L-1的对照组相比,6mg·L-1及以下低氧环境对中华哲水蚤的存活和繁殖均有抑制作用。CHALKIA等[24]在对石膏岩溶湖的水生动物调查中发现溶解氧是影响枝角类和桡足类的主要因子。陶敏等[25]对沱江的浮游生物调查结果表明,浮游甲壳动物生物量在溶解氧和浮游植物生物量高的环境中较大。相比于中小型枝角类,桡足类对溶解氧的要求更高。本次研究结果显示,溶解氧是影响流沙湾浮游动物优势种分布的主要因素之一,而桡足类为流沙湾海区的第一大类群,占据了优势种的大多数,较好地印证了已有研究。
SUN等[26]对三门湾、象山港和乐清湾3个亚热带水产养殖港湾的浮游动物群落进行调查并探讨了其与环境因子的关系,认为在水体富营养化的条件下浮游动物群落更易受化学因子(如营养盐)的影响,反之则更易受物理因子(如温度、盐度)的影响。本调查的结果显示,在流沙湾海区中,溶解氧、硝酸氮、磷酸盐等化学因子较透明度、盐度等物理因子对浮游动物群落分布影响更大,表明流沙湾海域可能出现富营养化。2012年流沙湾海水养殖区的可溶性无机氮浓度明显增加,富营养化状态凸显。海水营养状态质量指数(NQI)、有机污染评价指数(A)均显示养殖海域已经处于严重的富营养化状态[27]。与2012年相比,流沙湾无机磷和总颗粒有机物的含量有所上升,其中颗粒有机物范围由原先的2.64~6.18 mg·L-1上升到本次的 5.01~10.22 mg·L-1。流沙湾浮游动物目前的群落分布与环境因子的关系正是对海区富营养化过程的一种响应。
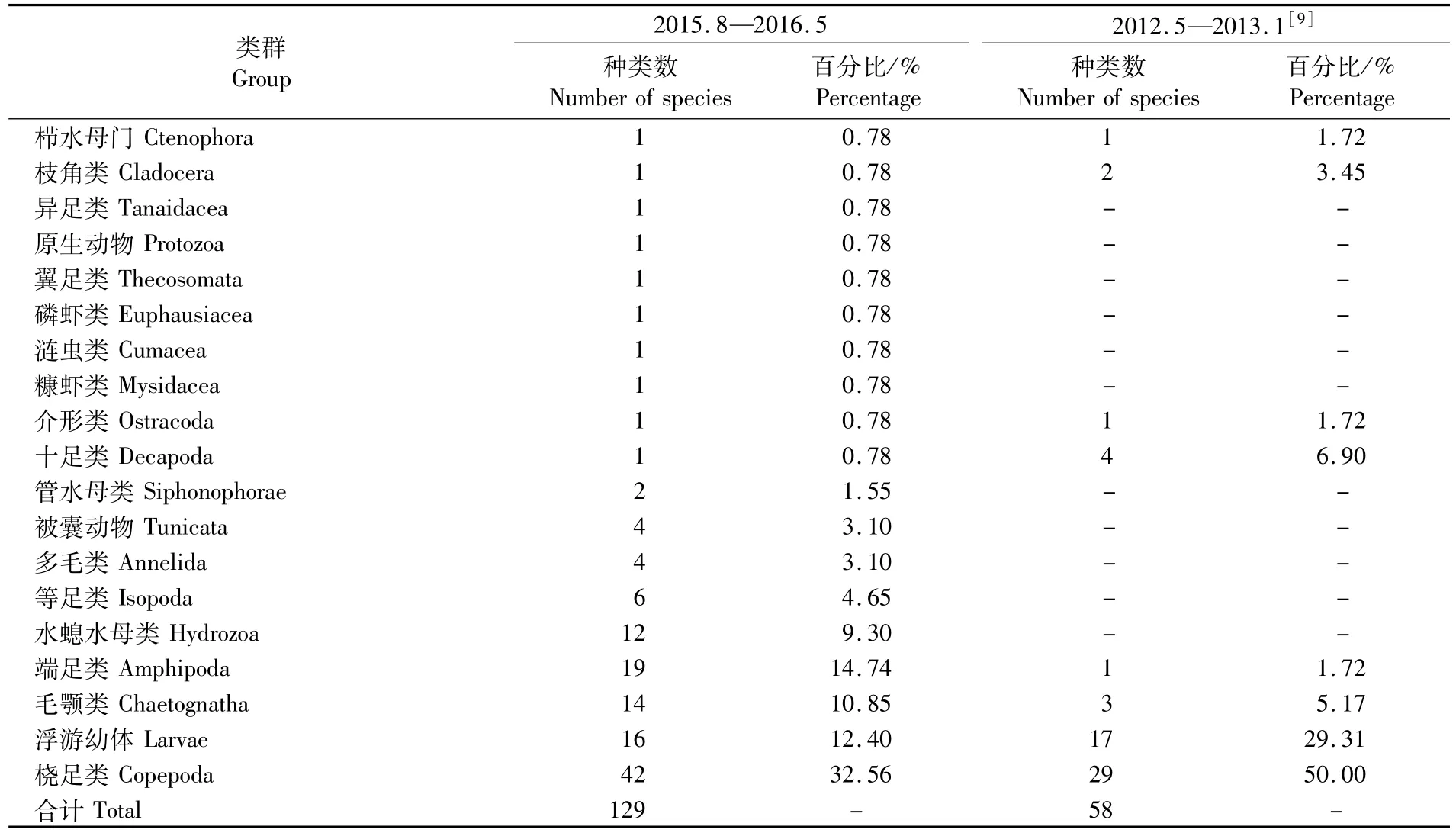
表4 流沙湾浮游动物种类组成的年际变化Tab.4 Annual changes of species coposition of zooplankton in the Liusha Bay
在亚得里亚海东部,温度是决定当地浮游动物季节变化的主要因素,而营养盐等化学因子与盐度则决定了浮游动物的空间分布[28]。MOKHAYER等[29]在对伊朗布什尔沿岸进行调查后认为,透明度、水深和盐度与当地浮游动物优势种的分布密切相关。南澳岛北部海域的浮游动物群落特征调查结果显示,盐度对当地海域各季浮游动物平面分布特征影响最为明显,而温度对浮游动物分布影响主要表现在季节变化[30]。流沙湾海区基本无淡水径流流入,相对河口区而言盐度比较稳定,因而相比盐度而言,温度对流沙湾浮游动物优势种分布的影响更大。
3.3 养殖活动对流沙湾浮游动物的影响
流沙湾海区养殖品种繁多,不同的养殖种类和养殖模式对浮游动物的影响程度不同。贝类滤食浮游植物,对浮游植物的摄食竞争性高于植食性浮游动物。同时贝类也可以滤食小型浮游动物或浮游动物幼体,给浮游动物带来一定的摄食压力。随着贝类养殖密度的扩大和摄食压力的增加,浮游动物的丰度和生物量也随之受到影响[31-32]。在本次调查中,除夏季外,流沙湾海域扇贝养殖区浮游动物生物量和丰度普遍低于外海对照区。而在冬季,夜光虫在流沙湾海区大量出现,其中在外湾航道的4号采样站位高达2.50×103个·m-3,而在贝类养殖区的6号采样站位为0.97×103个·m-3,7号采样站位则降至0.29×103个·m-3。在1号、2号采样站位丰度分别为49、17个·m-3,在3、12号采样站位则不存在。夜光虫具有异养型生物的特性,依靠摄食水体浮游植物进行生长繁殖,其大量繁殖并不直接依赖于水体的高营养盐环境[14]。而贝类养殖通过对浮游植物的竞争性摄食有效的抑制了夜光虫的扩散。进一步表明了大规模贝类养殖活动对浮游动物生物量和丰度的抑制作用。
nMDS排序结果显示,除冬季外,贝类养殖区采样站位多与外湾其它采样站位聚为一类,表明贝类养殖活动目前并未对浮游动物群落结构产生明显的影响。而扇贝养殖区的多样性指数虽然略低于外湾对照区,但也保持了较高的多样性指数,表明当前情况下流沙湾扇贝养殖对浮游动物群落组成及生物多样性影响不明显。这与黄长江等[33]对柘林湾浮游动物调查的结果相似。
流沙湾鱼类网箱养殖主要在每年4月放苗,11月收获。在鱼排区的8号采样站位,浮游动物生物量受养殖活动的影响明显。5月,养殖鱼类的规格较小,因而投饵等养殖活动对浮游动物种数和生物量影响不大。春季网箱养殖区浮游动物生物量高于贝类养殖区,同时略低于对照区,丰度则高于这二区。夏季是养殖鱼类生长的高峰期,同时也是投饵等养殖活动的高峰期。养殖环境的改变引起端足类等污损生物在8号采样站位大量出现,继而提高了该区域的浮游动物生物量。而在秋季随着养殖活动的结束,环境的变化使得网箱养殖区的生物量和丰度大大降低,低于其它区域。nMDS排序结果显示,在夏、秋两季8号采样站位与9号站位聚为一类,表明9号站位在两季受鱼类养殖活动影响较大。具体表现为在夏季,与8号站位相邻的1号与9号都出现了钩虾、水虱、蜾赢蜚(Corophium sp.)等污损生物。而在秋季,9号站位的浮游动物种类组成中几乎包含了8号的所有种类。从多样性指数来看,鱼类网箱养殖区的生物多样性要低于外湾对照区,表明了在鱼类养殖活动作用下,浮游动物的群落稳定性要低于自然海区。
黄长江等[33]研究表明,水体交换能力的大小是柘林湾浮游动物丰度与生物多样性西部低于东部、内侧低于外侧基本格局的重要决定因素。同时水体交换条件的好坏对柘林湾浮游动物的群落结构与时空分布具有决定性的影响。郭永坚等[9]2012年的研究结果显示,流沙湾外湾的浮游动物生物量和丰度普遍高于内湾。而在2015年,贝类养殖区由内湾转移到外湾的环境下,内湾的浮游动物丰度除春季外依旧小于外湾对照区,生物量则除夏季外均低于外湾对照区。除春季外,流沙湾内湾浮游动物群落组成也与外湾存在差异。水动力建模表明,流沙湾内、外湾口水体流速差异显著,退潮时内湾口的水流速度趋于静止状态(图8)。2015年,外湾扇贝筏式养殖面积与湾口鱼类小网箱养殖进一步扩大,势必对流沙湾内湾的水交换产生更大的影响。上述现象可能与内湾水动力不足、水体交换能力较差有关,应引起关注。

图8 流沙湾涨/落潮流场图[34]Fig.8 Tidal current at the time of flood and ebb of the Liusha Bay[34]
由以上讨论分析可知,水产养殖活动对流沙湾海区浮游动物的分布、群落结构及生物多样性产生了较为明显的影响。其中,鱼类小网箱养殖活动对浮游动物的种类、丰度、生物量产生了明显影响,在夏秋两季明显改变了该区及周边采样站位的浮游动物群落结构。贝类养殖区的浮游动物的丰度和生物量明显降低,但浮游动物群落组成及多样性与其它采样点差异不大。同时,流沙湾外湾养殖设施和养殖区面积的持续增加,可能进一步影响了内、外湾水交换能力,进而对浮游群落结构与时空分布产生影响。

附表1 流沙湾浮游动物名录Appendix.1 Species list of zooplankton in the Liusha Bay

·续附表1·
——以“不同咖啡因饮料对水蚤心率的影响”为例

