微小RNA-155和CD4+调节性T细胞与冠状动脉不稳定斑块的关系
贾敏 刘震 罗义 雷晓明 杨阳 陈平安
510095 广州市胸科医院综合内科(贾敏);510180 广州市第一人民医院心内科(刘震、罗义、雷晓明、杨阳、陈平安)
冠状动脉内不稳定斑块(unstable plague,UP)的形成、破裂及继发血栓形成是导致急性冠状动脉综合征(acute coronary syndrome,ACS)发生的最重要机制[1]。研究显示,免疫炎症在动脉粥样硬化斑块的形成和进展中起重要的促进作用。调节性T细胞(regulatory T cell,Treg)是体内一群免疫抑制功能强大的T细胞亚群,在机体免疫稳态维持中起重要作用[2]。微小RNA-155(microRNA-155,miR-155)是具有重要转录后调节作用的小分子RNA,与免疫炎症反应的调节相关[3]。本研究旨在探讨循环miR-155和外周血CD4+Treg细胞与冠心病(coronary artery disease,CAD)患者UP的关系。
1 对象和方法
1.1 研究对象
本研究为回顾性研究。连续入选2016年1月至2018年1月在广州市第一人民医院心内科住院并诊断为CAD的患者120例,男性68例,女性52例,年龄54~68岁,平均(61.8±6.9)岁。其中急性非ST段抬高型心肌梗死16例,不稳定性心绞痛56例,稳定性心绞痛48例。入选患者均接受冠状动脉造影和血管内超声(intravascular ultrasound,IVUS)检查。非ST段抬高型心肌梗死和不稳定性心绞痛诊断符合《2011年美国不稳定性心绞痛和非ST段抬高型心肌梗死治疗指南》。排除标准:(1)需急诊再灌注治疗的急性ST段抬高型心肌梗死;(2)心源性休克;(3)严重肝肾功能不全、重症感染、血液系统或自身免疫疾病、恶性肿瘤;(4)合并急性脑血管意外、消化道或泌尿系统等重要脏器活动性出血。
另外选取同期在体检中心进行健康体检的健康人群50名作为对照组,其中男性23名,女性27名,年龄48~71岁,平均(60.5±8.3)岁。本研究通过广州市第一人民医院伦理委员会审查,入选研究对象均对本研究知情并签署知情同意书。
1.2 方法与分组
1.2.1 血管内超声-虚拟组织学技术(intravascular ultrasound-virtual histology,IVUS-VH)[4]经冠状动脉造影后,对明确存在管腔直径狭窄程度≥50%的冠状动脉注入硝酸甘油200 U,之后使用iLab超声诊断仪(Boston Scientific,美国)及Atlantis SR Pro冠状动脉超声成像导管(Boston Scientific,美国),直径3.6 F,频率40 MHz,超声探头导管在X线透视下沿0.014英寸导引钢丝进入冠状动脉。到达狭窄病变处远端后,自动回撤装置将导管以0.50 mm/s的速度回撤,同时采集影像数据,录盘分析。利用主机自带iMap Basic Viewer软件构建组织图像,测定病变血管外弹力膜横截面积、管腔横截面积、斑块负荷及每种成分在斑块中所占比例,以评价靶病变的斑块性质。IVUS-VH检查血管内横截面积狭窄率超过40%、坏死组织超过10%、且靠近管腔的斑块定义为UP[4]。据此,将入选的CAD患者分为稳定斑块(stable plaque,SP)组50例和UP组70例。
1.2.2 循环miR-155水平的检测 所有研究对象均于清晨8时左右空腹状态下留取静脉血标本,置于乙二胺四乙酸(EDTA-K2)无菌抗凝试管中,2 h内分离血浆,采用实时荧光定量聚合酶链式反应技术[5](Promega公司,美国)对血浆miR-155进行检测,以人snRNA U6(Human snRNA U6)为内参,定义ΔCt=目的基因(miR-155)Ct-内参(U6)Ct;ΔΔCt=待测样品中目的基因(miR-155)ΔCt-参照样品中目的基因(miR-155)ΔCt,相对样品模板量RQ=2-ΔΔCt(Ct值的含义:每个反应管内的荧光信号到达设定的域值时所经历的循环数)。以相对样本模板量表示循环miR-155的相对表达量。
1.2.3 外周血CD4+Treg细胞水平的检测 所有研究对象均于清晨8时左右空腹状态下留取静脉血标本2 ml,置于EDTA抗凝的真空采血管(去热源与内毒素),轻轻混匀,标本于4 h内测试完毕。采用直接免疫荧光法,用肝素钠抗凝全血50 μl后加入10 μl FITC-CD4/APC-CD25二联抗体,4℃下避光孵育30 min,用于标记CD4+CD25+Treg细胞,溶血洗涤后弃上清,洗涤后加入10 μl抗人Foxp3单克隆抗体于4℃下避光孵育30 min,再次洗涤后用500 μl染色缓冲液重悬,上流式细胞仪(Beckman,美国)分析,结果以CD4+CD25+Foxp3+Treg细胞占CD4+Treg细胞的比率表示。
1.3 统计学方法
2 结果
2.1 基线资料
SP组、UP组和对照组的临床基线资料比较,差异均无统计学意义(均为P>0.05),见表1。
2.2 血浆miR-155和CD4+Treg水平
对照组、SP组和UP组患者的血浆miR-155和CD4+Treg水平比较,见表2。
2.3 UP组CAD患者血浆miR-155与CD4+Treg水平的相关性
Spearman相关分析显示,UP组CAD患者的血浆miR-155相对表达量与CD4+CD25+Foxp3+Treg细胞水平呈正相关(r=0.476,P=0.013)。
2.4 血浆miR-155水平和外周血CD4+Treg水平与CAD患者冠状动脉斑块稳定性的关系
采用多因素logistic回归方法分析包括年龄、性别、吸烟、高血压、糖尿病、肾功能不全、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、高敏C反应蛋白、同型半胱氨酸、N末端B型利钠肽原、血浆miR-155相对表达量、外周血CD4+Treg水平等多个因变量与应变量UP(有UP为1;无UP为0)之间的关系。结果显示,血浆miR-155相对表达量、外周血CD4+Treg水平均是CAD患者冠状动脉斑块稳定的独立保护因子(OR=0.662,95%CI:0.472~0.819,P=0.011;OR=0.502,95%CI:0.376~0.765,P=0.019),见表3。
3 讨论
动脉粥样硬化所致的心脑血管疾病是目前危害人类健康的首要疾病,而UP是导致心脑血管事件发生的关键。目前,CAD患者冠状动脉内是否存在UP主要通过侵入性检查冠状动脉造影或IVUS等手段来判断[6],缺乏对其早期预测和诊断的无创性检查指标。动脉粥样硬化是一种慢性炎症性疾病,炎症反应贯穿其起始、进展及至斑块不稳定的各个阶段。CD4+Treg细胞是体内一群免疫抑制功能强大的T细胞亚群,在机体全身及局部免疫稳态维持中起重要作用,其特异性标志为细胞高表达CD25+和Foxp3+。本研究结果发现,UP组患者的CD4+CD25+Foxp3+Treg细胞占CD4+Treg细胞的比例明显低于SP组和对照组,多因素回归分析显示,外周血CD4+CD25+Foxp3+Treg细胞水平是冠状动脉内斑块稳定的独立保护因子。近期研究报道,小鼠动脉粥样硬化模型外周血和斑块中CD4+CD25+Foxp3+Treg数量减少、免疫抑制功能降低,而输注CD4+CD25+Foxp3+Treg能使斑块明显变小[7],提示动脉粥样硬化形成涉及CD4+CD25+Foxp3+Treg的免疫调控机制,其变化是动脉粥样硬化和ACS发生和发展的重要原因之一。国内胡英锋等[8]发现,ACS患者外周血中Treg细胞表达百分比水平和功能显著低于对照组,并且C反应蛋白、肿瘤坏死因子α等炎症因子水平显著升高,而炎症抑制因子白细胞介素10、转化生长因子β水平则明显降低。本研究结果亦显示,Treg细胞数量和功能活化是影响动脉粥样硬化斑块稳定性的重要因素。
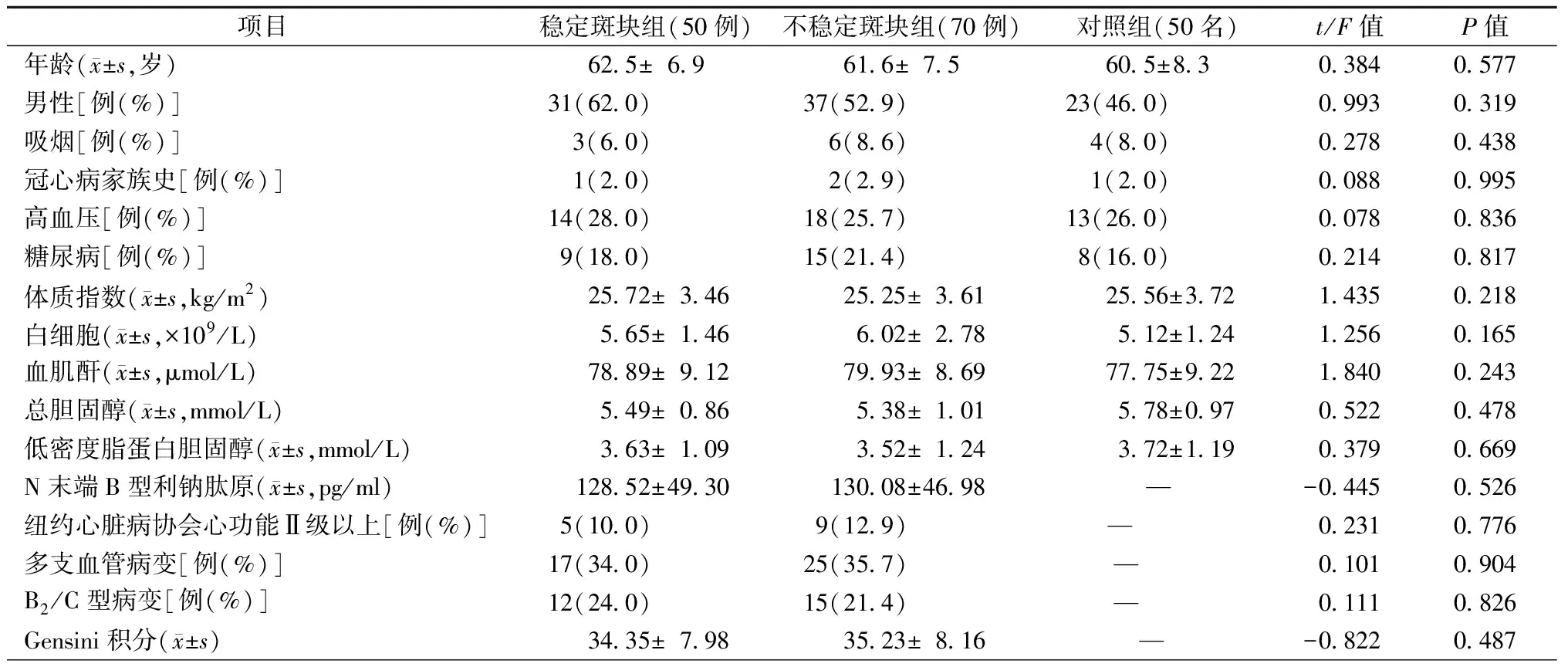
表1 3组的临床基线资料比较
注:B2/C型病变:符合美国心脏病学院基金会(ACCF)和美国心脏病协会(AHA)冠状动脉病变分型标准B2型和C型
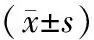
表2 3组血浆微小RNA-155和CD4+调节性T细胞水平比较
注:与对照组比较,aP<0.05,bP<0.01;与稳定斑块组比较,cP<0.01
近年研究显示,循环miRs作为一类单链内源性非编码小分子RNA,在患者生理或病理状态下的变化早于其他生物标记物,并且具有良好的抗RNA酶降解能力和较高的稳定性,有可能成为某些疾病的特异血清学生物标记物[9]。已有研究证实,miR-155可在T淋巴细胞、B淋巴细胞、单核/巨噬细胞表达,并对炎症免疫细胞的激活及免疫炎症的调节起关键作用。本研究结果发现,UP组CAD患者的血浆miR-155相对表达量明显低于稳定斑块组,多因素logistic回归分析显示,血浆miR-155水平与CD4+Treg细胞表达水平均是冠状动脉内斑块稳定的保护因子,而UP组CAD患者的血浆miR-155与外周血CD4+Treg细胞水平呈正相关。Seddiki等[10]研究发现,在胸腺细胞的分化过程中,miR-l55的表达升高可使CD4+Treg细胞Foxp3的表达上调,miR-l55的缺失会导致Treg细胞数量的减少。Yao等[11]通过转染pre-miR-155和抗miR-155到纯化的CD4+Treg细胞中,进行miR-155的过表达与抑制,结果发现转染pre-miR-155的CD4+Treg细胞中Treg细胞的数量比转染抗miR-155的CD4+Treg细胞中的多,同时Treg细胞的特异性标志叉头状转录因子Foxp3表达也明显上调,上述研究显示miR-155具有调控Treg细胞上特异标记物的表达进而影响Treg细胞的功能及数量的效应。从本研究结果来看,miR-155可能正性调节Treg细胞表达,进而通过Treg细胞的免疫抑制功能抑制冠状动脉内斑块炎症反应,减缓斑块进展至不稳定状态。
综上所述,CAD患者血浆miR-155的水平可作为判断和预测冠状动脉内斑块稳定性的一种重要血液学生物标记物。其通过正性调节外周血CD4+Treg细胞表达水平,抑制冠状动脉内及斑块内局部炎症反应,可能是维持冠状动脉斑块稳定性的重要机制之一。但本研究仍存在样本量偏小,研究的冠心病人群及观察的炎症指标较单一等缺陷,因此,本研究结果和结论有待将来大规模的临床试验进一步验证。
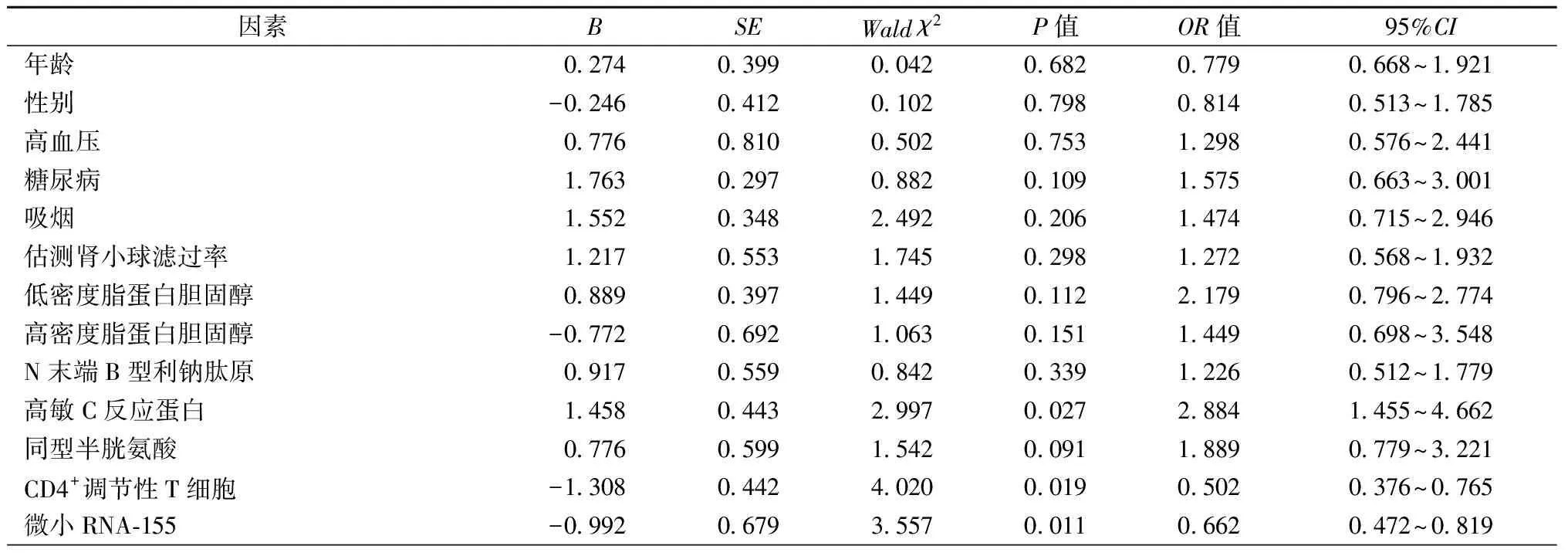
表3 血浆微小RNA -155水平和外周血CD4+调节性T细胞水平与不稳定斑块的关系
利益冲突:无