盐碱胁迫对甜菜光合物质积累及产量的影响
董心久,沙 红,高 燕,石洪亮,邝鹏昆,高卫时,李思忠,张立明,杨洪泽
(新疆农业科学院经济作物研究所,乌鲁木齐 830091)
0 引 言
【研究意义】土壤盐碱化是影响世界农业生产最主要的非生物胁迫之一,已成为限制农作物生长发育的一个主要因素[1]。并且有逐年加重的趋势,世界约有20%的耕地出现不同程度的土壤盐渍化[2]。中国盐碱土面积约9.9×107hm2,而且盐碱化和次生盐碱化每年都在不断加重,给农业生产带来巨大阻碍[3]。根据我国土壤特性和所含盐分特点,将其分为盐土和碱土两大类,盐碱化土壤中的阳离子主要是Na+、K+、Ca2+、Mg2+等,阴离子主要有Cl-、SO42-、HCO3-、CO32-等,不同地区盐碱地盐分离子的组成差异很大,且Na2CO3和NaHCO3等碱性盐对植物造成的伤害远大于NaCl和Na2SO4等中性盐,因为碱性盐伤害除离子毒害和渗透胁迫外,还有高pH值[4-5]。生长在盐渍化土壤的植物盐胁迫和碱胁迫通常相伴发生。研究混合盐碱胁迫比单一盐或碱胁迫更接近实际,能更好地筛选和培育耐盐碱作物以开发和利用盐碱土资源,对农业生产具有实际意义。【前人研究进展】当土壤盐分浓度达到某个阈值时,对作物造成渗透胁迫和营养离子平衡干扰,土壤盐碱化会导致植株体内的离子动态失衡,细胞内活性氧代谢紊乱,降低光合作用和减缓体内能量代谢,抑制作物的生长和发育过程,甚至导致作物的大面积枯萎和减产[6-7],严重影响农业生产的经济效益。前人研究表明,盐胁迫通过降低土壤水势,减弱植物根系吸水能力,进而降低木质部导水有效性,使叶片气孔部分关闭,减少蒸腾,还会破坏植物叶绿体结构,抑制光合磷酸化过程[8-11]。光合作用是影响植物的重要代谢过程,对植物正常生长具有重要意义,可有效指示植物的抗逆性强弱[12-13]。作物的光合作用过程对土壤盐碱度的反应极其敏感,高盐胁迫会导致植物蛋白质合成过程受阻、叶绿体光合反应位点结构破坏,造成叶片净光合反应速率(Pn)的降低[14-15];盐碱胁迫下作物受到高pH、低水势胁迫、渗透胁迫、营养失衡等多重伤害,危害程度远超过中性盐胁迫[16]。【本研究切入点】甜菜(BetavulgarisL.)是我国的主要糖料作物之一,主要分布于西北、华北和东北等干旱和半干旱地区,这些地区盐碱化的土壤面积相对较大[17]。目前有关植物耐盐碱性的研究多集中在单一的盐或碱胁迫或两者的比较研究,涉及胁迫生理、表观遗传、离子转运、激素调节、基因表达等方面[18-21]。混合盐碱胁迫研究少见报道[4,22]。有关甜菜在氯化钠胁迫下的耐盐生理研究较多,但对混合盐碱胁迫研究的较少,研究盐碱胁迫对甜菜光合物质积累及产量的影响。【拟解决的关键问题】按照NaCl∶Na2SO4∶Na2CO3∶NaHCO3=1∶9∶1∶9比例混合,研究盐碱胁迫对甜菜光合物质生产及产量的影响,为盐碱地高产栽培和耐盐品种筛选提供参考。
1 材料与方法
1.1 材 料
1.1.1 试验品种
选取一块无盐碱性的土壤挖出,碾碎晒干;有机肥(羊粪)碾碎晒干。按照土壤:有机肥为4∶1的比例搅拌均匀作为盆栽土壤。以HI0135、SD12830及MA11-8甜菜品种为试验材料。
1.2 方 法
1.2.1 试验设计
试验于2017年4~10月在疆农业科学院玛纳斯试验站甜菜基地进行。采用双因素随机区组试验设计,因素一为甜菜品种,分别为HI0135、SD12 830及MA11-8,因素二为盐碱胁迫浓度,Na+浓度分别为0、0.5%、0.8%及1.0%。
采用盆栽试验,盆长80 cm,宽30 cm,高40 cm。以NaCl、Na2SO4、Na2CO3、NaHCO3四种盐成分为基础,按照NaCl∶Na2SO4∶Na2CO3∶NaHCO3=1∶9∶1∶9比例配制成1 mol/L的混合盐碱溶液。4月15日播种,播种前按照设置的盐碱胁迫浓度每盆浇4 L盐碱溶液。每个处理1盆,每盆30粒种子,重复3次,共计36盆。出苗后1对真叶疏苗,2对真叶定苗,每盆留取长势一致的甜菜植株6株。整个生育期内共浇水16次。10月2日收获。
1.2.2 测定项目1.2.2.1 农艺性状
至收获期实测各处理甜菜的株高和叶片数,株高采用直尺测量,叶片数采用人工记数。
1.2.2.2 净光合速率(Pn)
于7月23日、8月6日、8月22日测定甜菜叶片净光合速率(Pn),选取形态大小相同,朝向一致的叶片进行测量,每个处理选5株,利用美国PP systems公司生产的CIRAS-3型光合仪在11:00~13:00时间内的晴朗天气进行测定,控制光合有效辐射(PAR)为1 500 μmol /(m2·s),叶室温度为27~30℃。
1.2.2.3 生物量
于7月10日进行甜菜生物量的测定。把清理干净的样本分地上部和地下部进行称重(鲜重),装入信封置于烘箱内,105℃杀青30 min,然后温度调至85℃烘干至恒重,测定质量(干重)。
1.2.2.4 盐敏感指数(Salt sensitivity index, SSI)和盐耐受指数(Salt tolerance index, STI)
盐敏感指数和耐受指数的计算公式[23]:
SSI=[(DWNa+-DWcontrol)/DWcontrol]×100.
STI=(DWNa+/DWcontrol)×100.
式中,DWNa+表示盐碱处理下根干重,DWcontrol表示对照根干重。
1.2.2.5 产量
至收获期,记数各处理甜菜收获株数,并测定甜菜根重,计算单位面积(0.24 m2)产量,最后换算成t/hm2。
1.3 数据处理
采用SPSS19.0进行统计分析,采用Duncan新复极差法进行多重比较(P<0.05);采用Excel2010进行图表绘制。
2 结果与分析
2.1 盐碱胁迫对甜菜农艺性状的影响
研究表明,随着盐碱胁迫浓度的增加:HI0135品种甜菜的株高和叶片数表现为先增加后降低的趋势,在盐碱胁迫浓度为0~0.5%时对甜菜株高和叶片数有促进作用,当浓度大于0.5%时开始抑制甜菜的生长发育;SD12830和MA11-8品种甜菜的株高和叶片数表现为持续下降趋势。不同品种间表现为HI0135甜菜的株高和叶片数对盐碱胁迫的适应性相对较强,SD12830品种对盐碱胁迫较为敏感,MA11-8品种居中。图1,图2
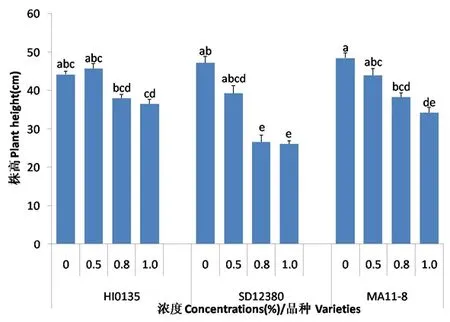
注:数字后a、b、c等不同字母分别表示P<0.05水平下显著性差异
Note: a, b and c means significant difference inP<0.05
图1 盐碱胁迫下甜菜株高变化
Fig.1 Effects of saline-alkali stress on plant height of sugar beet
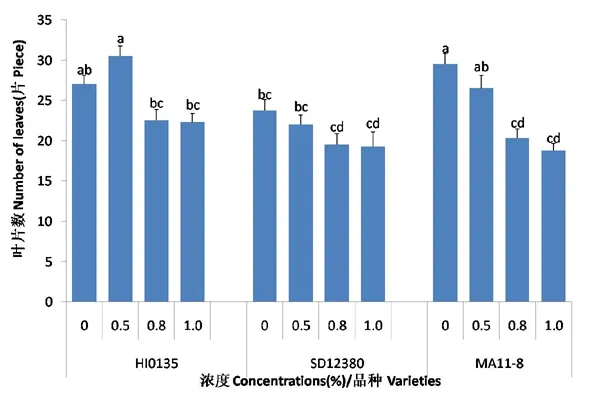
注:数字后a、b、c等不同字母分别表示P<0.05水平下显著性差异
Note: a, b and c means significant difference inP<0.05
图2 盐碱胁迫下甜菜叶片数变化
Fig.2 Effects of saline-alkali stress on the number of leaves of sugar beet
2.2 盐碱胁迫对甜菜净光合速率(Pn)的影响
研究表明,随着盐碱胁迫浓度的增加:HI0135品种甜菜的Pn表现为先增加后降低的趋势,在盐碱胁迫浓度为0~0.5%时对甜菜Pn有促进作用,当浓度大于0.5%时开始抑制甜菜的光合作用;SD12830和MA11-8品种甜菜的Pn表现为持续下降趋势。各甜菜品种均在出苗后58 d达到峰值。不同品种间表现为HI0135甜菜的Pn对盐碱胁迫的适应性相对较强,SD12830品种对盐碱胁迫较为敏感,MA11-8品种居中。图3

图3 盐碱胁迫下甜菜Pn变化
Fig.3 Effects of saline-alkali stress on Pn in sugar beet
2.3 盐碱胁迫对甜菜单株光合物质积累的影响
研究表明,随着盐碱胁迫浓度的增加:HI0135品种甜菜的地上鲜重、地下鲜重、地上干重及地下干重均表现为先增加后降低的趋势,在盐碱胁迫浓度为0~0.5%时对甜菜光合物质积累有促进作用,当浓度大于0.5%时开始抑制甜菜的物质积累;SD12830和MA11-8品种甜菜的地上鲜重、地下鲜重、地上干重及地下干重均表现为持续下降趋势。不同品种间表现为HI0135甜菜的光合物质积累量最大,SD12830品种积累量最小,MA11-8品种居中。表1
表1 盐碱胁迫下甜菜单株光合物质积累
Table 1 Effects of saline-alkali stress on photosynthetic matter accumulation in sugar beet
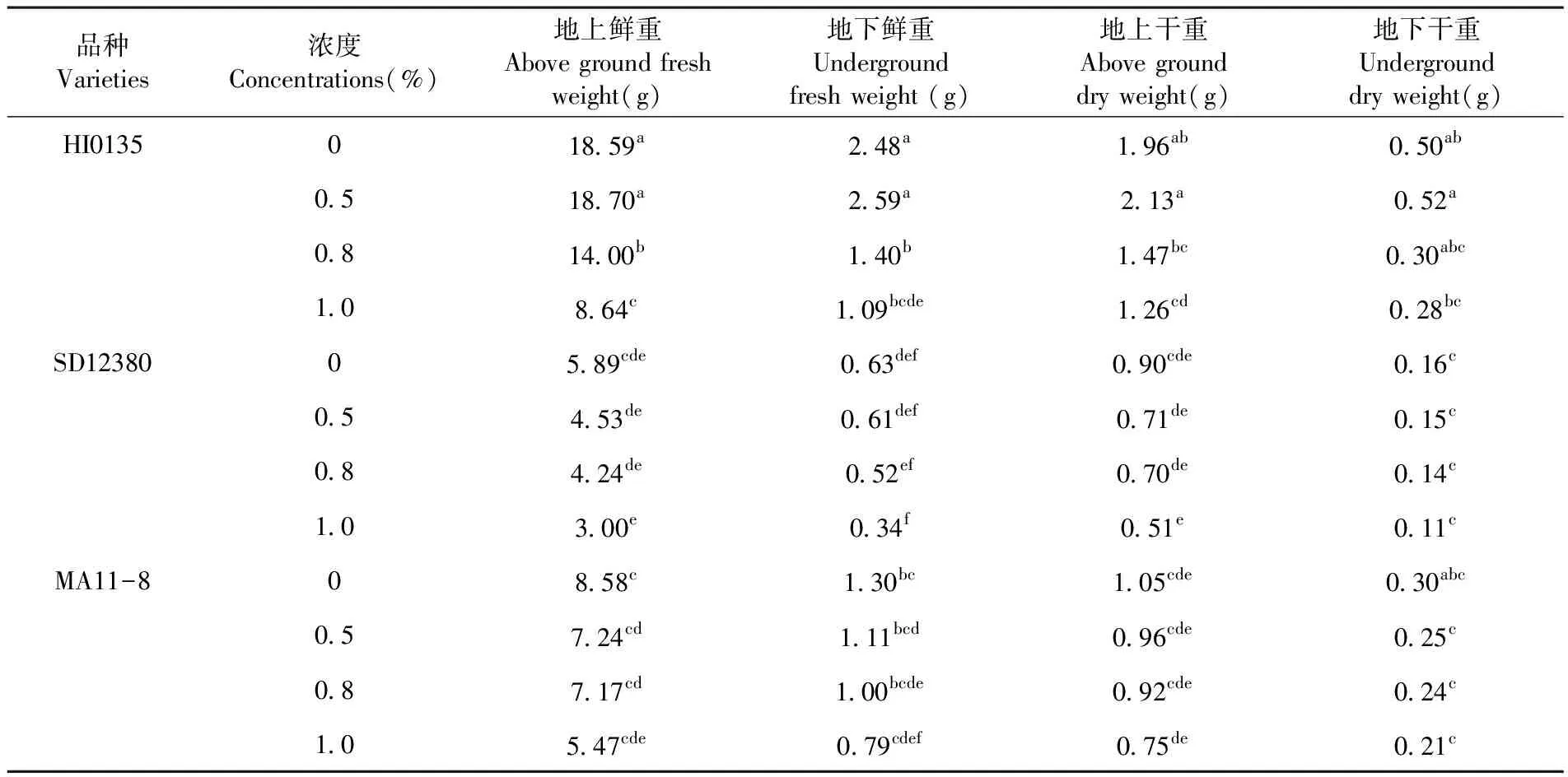
品种Varieties浓度 Concentrations(%)地上鲜重Above ground fresh weight(g)地下鲜重 Underground fresh weight (g)地上干重 Above ground dry weight(g)地下干重Underground dry weight(g)HI0135018.59a2.48a1.96ab0.50ab0.518.70a2.59a2.13a0.52a0.814.00b1.40b1.47bc0.30abc1.08.64c1.09bcde1.26cd0.28bcSD1238005.89cde0.63def0.90cde0.16c0.54.53de0.61def0.71de0.15c0.84.24de0.52ef0.70de0.14c1.03.00e0.34f0.51e0.11cMA11-808.58c1.30bc1.05cde0.30abc0.57.24cd1.11bcd0.96cde0.25c0.87.17cd1.00bcde0.92cde0.24c1.05.47cde0.79cdef0.75de0.21c
注:数字后a、b、c等不同字母分别表示P<0.05水平下显著性差异
Note: a, b and c means significant difference inP<0.05
2.4 盐碱胁迫对甜菜盐敏感指数和盐耐受指数的影响
研究表明,随着盐碱胁迫浓度的增加:HI0135品种甜菜的盐敏感指数和盐耐受指数表现为先增加后降低的趋势,在盐碱胁迫浓度为0~0.5%时促进了甜菜盐敏感指数和盐耐受指数的提高,当浓度大于0.5%时抑制甜菜盐敏感指数和盐耐受指数;SD12830和MA11-8品种甜菜的盐敏感指数和盐耐受指数表现为持续下降趋势,表现为持续抑制状态。盐碱胁迫浓度为0~0.5%时,盐敏感指数和盐耐受指数表现为HI0135>SD12830>MA11-8;盐碱胁迫浓度为0.5%~0.8%时,盐敏感指数和盐耐受指数表现为SD12830>MA11-8>HI0135;盐碱胁迫浓度为0.8%~1.0%时,盐敏感指数和盐耐受指数表现为MA11-8>SD12830>HI0135。图4,图5
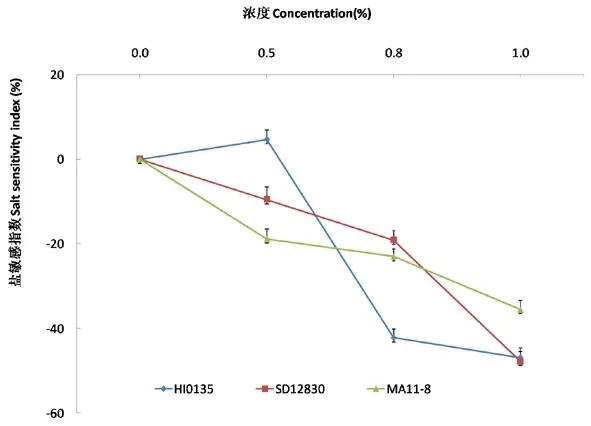
图4 盐碱胁迫下甜菜根部盐敏感指数变化
Fig.4 Effects of salt-alkali stress on salt sensitivity index of sugar beet roots
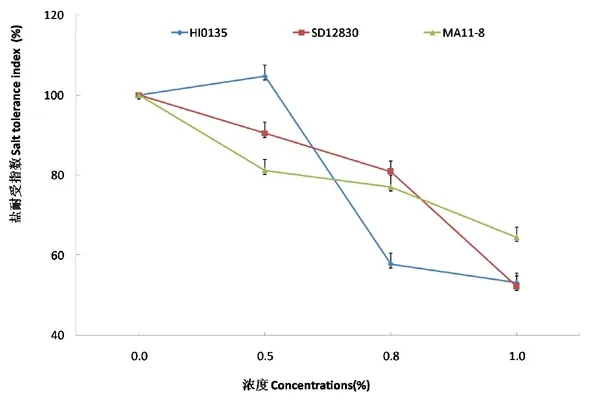
图5 盐碱胁迫下甜菜根部耐盐指数变化
Fig.5 Effects of salt-alkali stress on salt tolerance index of sugar beet roots
2.5 盐碱胁迫对甜菜产量的影响
研究表明,随着盐碱胁迫浓度的增加:HI0135品种甜菜的产量表现为先增加后降低的趋势,在盐碱胁迫浓度为0~0.5%时对甜菜产量有促进作用,当浓度大于0.5%时显著抑制甜菜的产量;SD12830和MA11-8品种甜菜的产量表现为持续下降趋势。不同品种间表现为HI0135甜菜的产量最大,SD12830品种产量最小,MA11-8品种居中。图6
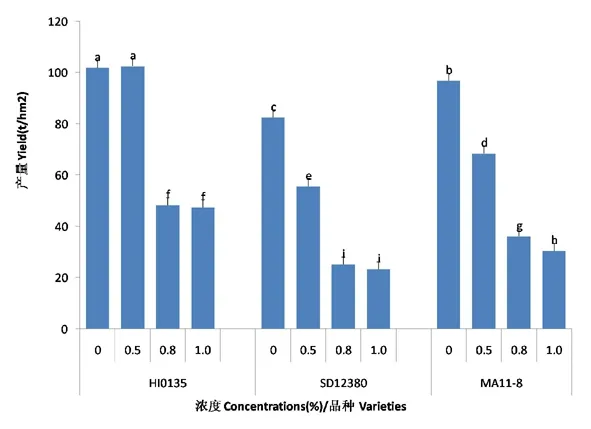
注:数字后a、b、c等不同字母分别表示P<0.05水平下显著性差异
Note: a, b and c means significant difference inP<0.05
图6 盐碱胁迫下甜菜产量变化
Fig.6 Effects of saline-alkali stress on yield of sugar beet
3 讨 论
盐碱胁迫之所以会影响作物的生长发育,主要由于盐碱胁迫后根的生物量、叶面积及叶片数量均变少,致使植株根系吸收养分能力变差、总光合面积减小,最终造成总的生物量的降低[24]。也有研究认为盐碱胁迫下作物的生长受抑制,一方面是作物在盐碱环境中用于生长的能量被损耗,这种能量损耗是由应用于生长的光合产物转而进行离子的运输和吸收而被消耗所引起的;另一方面是作物膨压的丧失,在盐碱环境下细胞壁大量积累盐分导致细胞膨压下降,进一步引起生长受抑,盐碱胁迫抑制了植株的生长,盐碱浓度越大,抑制作用越强[25]。作物可通过提高抗氧化酶活性、增加干物质积累而表现出较强的耐盐碱能力[26]。植物受盐碱胁迫后,地上部和地下部生长受到抑制,生长速度下降,生物学产量减少[27]。研究表明,抗盐碱油用向日葵品种在中度盐碱胁迫下,敏盐碱油用向日葵品种在低度盐碱胁迫下,都能正常生长,地上部和地下部生物量均比对照增加,在高浓度盐碱胁迫下,植物的地上部和地下部生物学产量都显著下降,适当的盐分处理可以促进幼苗的生长[28-29]。试验结果表明,HI0135品种甜菜的株高、叶片数、地上鲜重、地下鲜重、地上干重及地下干重,在盐碱胁迫浓度为0~0.5%时对甜菜生长发育及光合物质积累有促进作用,当浓度大于0.5%时开始抑制甜菜的生长发育及物质积累,且随着浓度的增加,下降的幅度越大;SD12830和MA11-8品种甜菜的生长发育及光合物质积累表现持续下降趋势;品种间表现为HI0135甜菜的株高、叶片数、地上鲜重、地下鲜重、地上干重及地下干重对盐碱胁迫的适应性相对较强,SD12830品种对盐碱胁迫较为敏感,MA11-8品种居中。
光合作用是植物最重要的生理过程之一,盐碱胁迫条件下,光合功能的强弱直接影响植物的生长发育,是评价植物耐盐碱能力的重要生理指标[24]。前人研究表明,土壤盐碱胁迫主要由3种胁迫因子组成:渗透胁迫、离子胁迫以及高pH引起的盐碱胁迫,最终导致植物细胞结构破坏[30]。长时间高浓度盐碱胁迫会抑制光合电子传递和气孔开度,降低碳同化关键酶活性,致使光合机构发生不可逆伤害,甚至会致使植株死亡[31]。试验结果表明,HI0135品种甜菜的Pn表现在盐碱胁迫浓度为0~0.5%时有促进作用,当浓度大于0.5%时开始抑制甜菜的光合作用;SD12830和MA11-8品种甜菜的Pn表现为持续下降趋势;间表现为HI0135甜菜的Pn对盐碱胁迫的适应性相对较强,SD12830品种对盐碱胁迫较为敏感,MA11-8品种居中。
碱胁迫使甜菜块根产量下降,且随着盐碱胁迫程度加大,下降的程度越大[32]。试验与前人研究结果不尽一致,HI0135品种甜菜的产量在盐碱胁迫浓度为0~0.5%时有促进作用,当浓度大于0.5%时显著抑制甜菜的产量。HI0135品种甜菜的盐敏感指数和盐耐受指数在盐碱胁迫浓度为0~0.5%时促进了植株物质的吸收,当浓度大于0.5%时抑制甜菜植株的物质积累;SD12830和MA11-8品种甜菜的盐敏感指数和盐耐受指数表现为持续下降;盐碱胁迫浓度为0~0.5%时,盐敏感指数和盐耐受指数表现为HI0135>SD12830>MA11-8;盐碱胁迫浓度为0.5%~0.8%时,盐敏感指数和盐耐受指数表现为SD12830>MA11-8>HI0135;盐碱胁迫浓度为0.8%~1.0%时,盐敏感指数和盐耐受指数表现为MA11-8>SD12830>HI0135。
4 结 论
适度的盐碱胁迫有利于甜菜生长发育和光合物质积累,株高增高,叶片数增加,促进了甜菜地上鲜重、地下鲜重、地上干重及地下干重物质积累;抗盐碱能力不同的甜菜品种对不同浓度的盐碱处理反应不同,HI0135品种甜菜抗盐碱胁迫相对较强,超过一定的盐碱浓度范围(0~0.5%),则会影响甜菜的生长发育、光和物质积累及产量;SD12830和MA11-8品种甜菜对盐碱较敏感。

