补肾益元方对运动性低血睾酮大鼠睾丸Leydig 细胞睾酮合成酶的影响
王一蓉, 周志宏, 汤长发, 魏 霞, 叶志文
(1.湖南体育职业学院,湖南 长沙410019;2.湖南师范大学体育学院,湖南 长沙410081)
运动性低血睾酮一直是竞技体育界最关心的问题,长时间高负荷运动训练能引起血睾酮水平下降,进而导致体能、运动能力降低或产生疲劳[1],其主要原因是HPG 轴功能的多个环节被抑制[2]。目前,在睾丸Leydig 细胞水平层面,因LH/CG 受体、P450SCC、β2-肾上腺素受体等环节改变引起睾酮降低均有报道,但鲜有关注运动训练、营养干预对睾酮生物合成途径相关酶的影响。
睾丸Leydig 细胞含有较多的内质网和线粒体,是合成和分泌睾酮的场所。下丘脑-垂体对睾丸分泌睾酮的调节变化最终要通过细胞内睾酮合成时反应底物转运、酶促反应等几个关键步骤实现。胆固醇作为睾酮生物合成的起始物质,其来源的主要途径为胆固醇内源性合成、外源性胆固醇摄取和逆转运, 而甲基戊二酸单酰辅酶A 还原酶(HMG-CoA)、低密度脂蛋白受体(LDL-R)、高密度脂蛋白受体(SR-BI) 分别是这2 条途径的关键因素。然后,由类固醇激素急性调节蛋白(StAR) 介导甾体合成,从线粒体膜外向膜内转运, 通过 P450胆固醇侧链裂解酶(P450scc,由CYP11A1 基因表达) 催化,并合成睾酮[3]。
本实验探索补肾益元方对运动性低血睾酮大鼠睾丸Leydig 细胞睾酮合成酶的影响,以方中臣药淫羊藿提取物为阳性对照,观察细胞超微结构及睾酮合成相关酶变化,探讨该方对防治大鼠运动性低血睾酮的有效性和分子机制。
1 材料
SPF 级雄性SD 大鼠40 只(湖南斯莱克景达实验动物有限公司),体质量(300±10) g,实验动物生产许可证号SCXK(湘)2013-0004,温度23 ~25 ℃,相对湿度40%~60%,每天光照时间5 h。H7700 透射电镜(日本日立公司);164-5050 电泳仪(美国Bio-Rad 公司);DYCZ-40 A转膜仪(北京六一生物科技有限公司)。Tris、APS、SDS、TEMED、Tween-20 等购自美国Sigma 公司。
淫羊藿提取物制备方法为取适量药材粉末,用44%乙醇按液料比25 ∶1,在80 ℃水浴中浸提56 min,每5 min摇匀1 次,进行第1 次提取;第2 次提取时用44%乙醇按液料比20 ∶1,在80 ℃水浴中浸提40 min,合并2 次浸提液,回收乙醇,得到总黄酮质量浓度为3.5 mg/mL 的浓缩液,加蒸馏水稀释成2.5 mg/mL,以1 mL/min 体积流量上样。充分吸附后,先以2.5 BV10%乙醇洗脱除去极性大的杂质, 再以4 BV70%乙醇洗脱得总黄酮, 体积流量1.5 mL/min。总黄酮洗脱液回收乙醇后稀释,以水-乙酸乙酯1 ∶2 的比例萃取5 次,每次10 min,合并乙酸乙酯相,即得。
补肾益元方由人参皂苷、淫羊藿苷、枸杞多糖,以及其他提取物(女贞子、黄芪、仙鹤草、大伸筋草、卷柏等) 组成,为褐色粉末,由该复方所制得胶囊的平均粒重为0.543 1 g,由西安天一生物技术股份有限公司制作并提供(批号201500139),具有补肝肾、强筋骨、补气活血、祛风通络功效。课题组前期通过HPLC 法,测得每粒胶囊中分别含人参总皂苷、淫羊藿苷43.57、5.03 mg。
2 方法
2.1 分组与给药 40 只大鼠随机分为空白组、模型组、淫羊藿提取物组及补肾益元方低、高剂量组,其中淫羊藿提取物组剂量为0.70 g/kg;补肾益元方低、高剂量组剂量分别为0.35、0.70 g/kg,复方用生理盐水溶解后配成4 mL溶液,高剂量用量与成人持平[4]。给药组大鼠运动前1 h灌胃给药;空白组、模型组大鼠正常饮食,每天灌胃4 mL生理盐水,连续6 周。
2.2 模型建立 采用逐级递增负荷跑台的方案建立大鼠运动性低血睾酮动物模型,以血睾酮较训练前下降15%为判断依据[5]。该方案是参照Bedford 在1979 年根据大鼠体质量/摄氧量回归方程所建立的逐渐递增速度和时间的运动训练方式,周期6 周,每周训练6 d,坡度保持在0°,最后1 d进行力竭运动。
2.3 取样与指标检测 大鼠6 周训练结束后次日,腹腔注射2%戊巴比妥麻醉,腹主动脉血制备血清,置于-20 ℃冰箱中保存,用于测定血清皮质醇、睾酮水平;取大鼠外周血,半自动生化分析仪检测血清总胆固醇、高密度脂蛋白胆固醇(HDL-CE)、低密度脂蛋白胆固醇(LDL-CE) 水平;无菌环境下取大鼠双侧睾丸(尽量是同侧同一部位)进行电镜观察,放入电镜保存液;Percoll 梯度离心法分离制备睾丸Leydig 细胞,-80 ℃下冷冻保存,Western blot 法检 测HMG-COA、 LDL-R、 SR-BI、 StAR、 CYP11A1 蛋 白表达。
2.4 统计学分析 通过SPSS 18.0 软件进行处理,数据用表示,组间比较采用单因素方差分析。P<0.05 表示差异有统计学意义。
3 结果
3.1 补肾益元方对睾酮、皮质醇、总胆固醇、HDL-CE、LDL-CE 水平的影响 表1 显示,与空白组比较,模型组睾酮水平、睾酮/皮质醇显著降低(P<0.01);与模型组比较,补肾益元方组两者显著升高(P<0.01)。
表1 补肾益元方对睾酮、皮质醇、总胆固醇、HDL-CE、LDL-CE 水平的影响
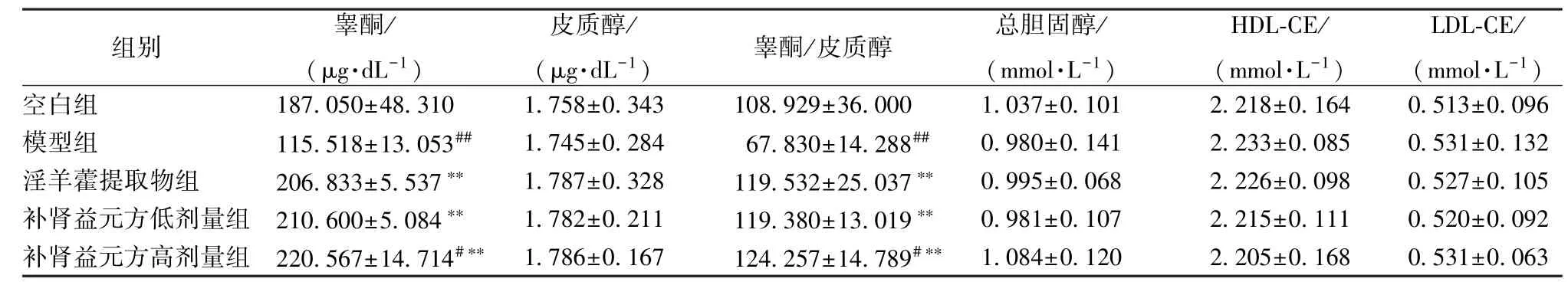
表1 补肾益元方对睾酮、皮质醇、总胆固醇、HDL-CE、LDL-CE 水平的影响
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,∗∗P<0.01
组别 (μ睾g·酮dL/-1) (皮μg·质d醇L-1/) 睾酮/皮质醇 (总mm胆o固l·L醇-1/) (m HmD L ol·-C L E-1/) (m LD m L ol-·CLE-/1)空模淫补补白型羊肾肾组组藿益益 提元元 取方方物低高组剂剂 量量 组组 11222 81012 75600.....05865 51306 08307±±±±±41551 83..4..50.30387 15741 034∗∗∗∗ ###∗ ∗ 11111.....77777 54888 85726±±±±±00000.....32321 48216 34817 1111 06112 87994.....98532 23385 90207±±±±±31211 64534.....02007 08318 08799 #∗∗##∗∗∗ ∗ 10001.....09990 38988 70514±±±±±00000.....11011 04602 11870 22222.....22222 13210 83655±±±±±00000.....10011 68916 45818 00000.....55555 13223 31701±±±±±00000.....01100 93096 62523
3.2 补肾益元方对大鼠睾丸Leydig 细胞超微结构变化的影响 图1 显示,空白组大鼠睾丸细胞结构正常,少部分细胞轻微水肿,但细胞内线粒体结构、内质网清晰;模型组大鼠间质水肿严重,部分细胞水肿、坏死、内质网扩张,细胞膜破裂,少部分线粒体空泡变,染色质边集、裸核;淫羊藿提取物组大鼠间质、部分细胞轻微水肿,细胞膜破裂;补肾益元方低剂量组大鼠部分细胞轻微水肿,少量线粒体体空泡变,溶酶体增多;补肾益元方高剂量组大鼠间质轻微水肿,部分间质细胞少量线粒体空泡,溶酶体增多,部分细胞染色质边集,细胞结构和内质网可见。
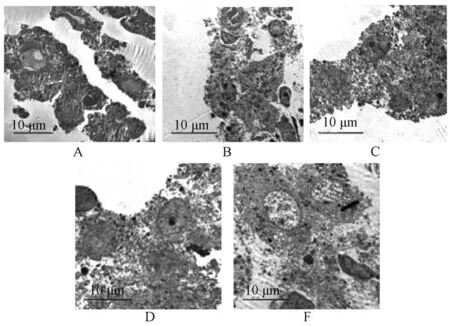
图1 各组大鼠睾丸间质细胞超细微结构
3.3 补 肾 益 元 方 对HMG-COA、 LDL-R、 SR-BI、 StAR、CYP11A1 蛋白表达的影响 表2、图2 显示,与空白组比较,模型组HMG-COA、StAR、CYP11A1 蛋白表达显著降低(P<0.05,P<0.01):与模型组比较,补肾益元方组三者蛋白表达显著升高(P<0.01)。
4 讨论
4.1 大鼠睾丸Leydig 细胞超微结构改变 在大鼠睾丸Leydig 细胞的线粒体和内质网中,含有合成睾酮的一系列关键酶,如催化胆固醇合成睾酮2 个最重要的限速酶P450scc、StAR,故两者在细胞合成和分泌睾酮中起到重要
表2 补肾益元方对HMG-CoA、LDL-R、SR-BI、StAR、CYP11A1 蛋白表达的影响

表2 补肾益元方对HMG-CoA、LDL-R、SR-BI、StAR、CYP11A1 蛋白表达的影响
组别 HMG-CoA LDL-R SR-BI STAR CYP11A1空模淫补补白型羊肾肾组组藿益益 提元元 取方方物低高组剂剂 量量 组组 00000.....43444 12579±±±±±00000.....00000 13111 39929 #∗###∗∗∗ ∗∗ 00000.....44434 58291±±±±±00000.....00000 36332 57185 00000.....33333 73223±±±±±00000.....00000 34223 52892 00000.....33444 83262±±±±±00000.....00000 21123 17892 #∗#∗ ∗∗∗∗ 00000.....43445 58161±±±±±00000.....00000 21221 24125#△∗∗#∗ ∗△

图2 各 组 HMG-COA、 LDL-R、 SR-BI、 STAR、CYP11A1 蛋白表达灰度
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,∗∗P<0.01;与补肾益元方高剂量组比较,△△P<0.01作用[6-7]。李维仁等[8]通过电镜观察老年人睾丸Leydig 细胞,发现部分线粒体水肿,脂滴含有量降低,可能与睾酮降低紧密相关;也有人认为,睾酮水平下降是由于睾丸Leydig 细胞数量的减少[9];朱宝安、Luo 等[10-11]报道,睾丸Leydig 细胞过度凋亡造成睾酮分泌明显下降。
本实验发现,大强度运动对大鼠睾丸超微结构造成明显破坏,尤其是模型组出现间质细胞水肿、坏死,部分细胞膜破裂、内质网扩张,染色质出现边集、裸核、细胞核固缩等现象,表明细胞损伤必然会影响睾酮合成及分泌,与郑菁等[12]报道基本一致;补肾益元方干预后,睾丸Leydig 细胞的水肿状况得到改善,内质网、线粒体、溶酶体结构大致清晰可见,表明该方通过保护和修复细胞内质网及线粒体结构来维持其正常功能,从而促进睾酮的分泌,与石幼琪等[13]研究结果十分接近。
4.2 大鼠睾丸Leydig 细胞胆固醇合成限速酶HMG-CoA、LDL-R、SR-BI 蛋白表达 HMG-CoA 还原酶催化HMG-CoA转变成甲基二羟基戊酸,是胆固醇内源性合成过程限速酶,其活性高低直接决定血浆胆固醇的水平[14]。严翊等[15]比较5 周间歇性负重游泳训练和多增加1 周训练,发现两者血睾酮明显降低,但5 周未出现睾丸Leydig 细胞HMG-CoA还原酶基因表达变化,而增加1 周后其表达显著降低,这与本实验结果基本一致,可能是运动造成血睾酮降低,从而抑制细胞HMG-CoA 还原酶基因表达。本实验发现,给药组HMG-CoA 还原酶蛋白表达明显高于空白组、模型组,但不同剂量之间无明显差异,表明淫羊藿提取物、补肾益元方有助于睾丸Leydig 细胞内胆固醇生物合成,从而提高大鼠睾酮分泌,但这与纪纲[16]研究结果恰好相反。
睾丸Leydig 细胞可分别通过LDL-R 介导的内吞作用和/或SR-BI 介导的胆固醇选择性吸收途径来摄取血液中胆固醇,其主要功能是通过摄取LDL-CE 进入细胞内,产生游离胆固醇,并且LDL-R 合成速度及活性与细胞内胆固醇含有量呈反比[17],研究表明,有氧运动可在转录水平上调大鼠肝脏LDL-R 基因表达,通过增加细胞内胆固醇的利用或降解影响LDL-R 合成,增加肝脏摄取,从而改善血脂水平,预防高脂饮食引起的LDL 代谢异常[18]; SR-BI 是HDL-CE 的高亲和力受体,也是胆固醇流出与流入的重要载体,主要介导血浆胆固醇逆向转运回肝脏和类固醇激素生成组织进行代谢的过程[19]。本实验发现,与空白组比较,模型组血清睾酮明显降低时大鼠睾丸Leydig 细胞LDLR 蛋白表达略微增加,但不明显,与张勇等[20]报道一致;给药组血清睾酮明显升高时,该蛋白表达略微降低,但不明显,表明给药后可能HMG-CoA 还原酶主导的细胞内胆固醇生物合成增加,从而使LDL-R 转录摄取外源性胆固醇的通路受到抑制;与空白组比较,给药组SR-BI 蛋白表达均有所下降,但不明显,血清总胆固醇、LDL-CE、HDLCE 水平亦然,与田振军[21]、严翊[15]报道一致,提示由SR-BI 介导的逆转运摄取外源性胆固醇通路发生了障碍,而且血清胆固醇变化可能与运动训练的时间、强度、方式有关。
当睾丸Leydig 细胞内睾酮水平降低时,可能首先通过HMG-CoA 还原酶主导胆固醇生物合成,其次是刺激LDL-R的转录,然后是SR-BI 介导逆转运摄入外源性胆固醇,但三者之间胆固醇生成顺序还有待进一步研究。见图3。

图3 睾丸Leydig 细胞内胆固醇来源
4.3 大鼠睾丸Leydig 细胞睾酮合成限速酶CYP11A1、StAR 蛋白表达 正常生理条件下,间质细胞内睾酮合成的第一步是由StAR 介导甾体合成的限速步骤——将胆固醇从线粒体膜外向膜内转运,然后P450scc(由CYP11A1 基因表达) 对线粒体内基质膜内表面上的胆固醇催化生成孕烯醇酮,最终合成睾酮[22]。CYP11A1、StAR 蛋白表达高低及活性与睾酮生成显著相关[23], Wang 等[24]发现两者mRNA 表达在45 d 达到最大值,此阶段可能是睾酮合成的快速时期;管永波等[25]用氟化钠抑制两者mRNA 表达,首先影响孕酮合成,从而影响睾酮合成,致使雄性心生殖系统出现损伤;景晓平等[26]报道,雷公藤多苷可使幼年大鼠睾酮水平明显降低,睾丸组织CYP11A1 蛋白表达下降,而补肾类中药可提高雄鼠睾酮水平,从而保护生殖损伤。本实验发现,模型组CYP11A1、StAR 蛋白表达较空白组明显降低,表明它们与睾酮生成高低呈显著正相关,与Zhao等[27]实验结果一致;补肾益元方组睾丸Leydig 细胞两者蛋白表达明显增加,并高于淫羊藿提取物组,表明该方能提高两者活性,从而促进胆固醇合成睾酮,与王建明等[28]报道一致。
补肾益元方可能通过睾丸Leydig 细胞内胆固醇内源性合成以及合成睾酮来影响血睾酮浓度,但对由LDL-R 转录和/或SR-BI 介导的逆转运影响胆固醇合成的分子机制尚不明确,还需要进一步探讨。

