梅花鹿茸多肽对小鼠成骨细胞MC3T3-E1生物学活性的影响
吕东辉,韩 笑,苑广信,刘 玲,安丽萍,杜培革
(北华大学药学院,吉林 吉林 132013)
中国是世界上具有悠久历史的养鹿大国,梅花鹿全身都是宝[1],是经济价值相当高的动物.鹿茸含有大量的钙、磷、生长因子、多糖、多肽及蛋白质等多种化合物.其中蛋白质类物质含量过半,鹿茸多肽(VAP)作为潜在的生物活性资源受到关注.梅花鹿茸具有温补肝肾、强筋健骨等功效.
骨质疏松症是一种全身代谢性的骨骼疾病,以骨组织单位体积骨量的降低和骨组织显微结构发生退行性改变为特征,并导致骨骼的脆性增加和骨折危险性增高,被称为“无声无息的流行病”.骨骼是一种动态活性组织,其结构的完整和矿化平衡需要其持续重塑来实现[1].在这一过程中,成骨细胞、骨细胞和破骨细胞之间的活性协调一致,达到骨重塑过程的动态耦联平衡,发挥骨形成功能的成骨细胞和发挥骨吸收功能的破骨细胞在骨骼重塑中发挥重要作用[2-4].骨质疏松症的发病机制是破骨细胞的骨吸收大于成骨细胞的骨形成,导致骨重建负平衡[5].可见,成骨细胞的大量增殖、分化对治疗骨质疏松症具有关键的促进作用.
小鼠胚胎成骨细胞MC3T3-E1属于前成骨细胞[6],它具有成骨细胞体外培养的所有特性,可以表达以及分泌骨细胞所具有的多种蛋白和受体,在研究药物对骨作用的影响中,MC3T3-E1细胞是最为常用的骨代谢细胞模型.鹿茸中含有一些活性物质,其能够促进骨细胞增殖,加速骨折的愈合,治疗骨质疏松[7].
1 材料与方法
1.1 材 料
新鲜二杠梅花鹿鹿茸(吉林省吉林市龙潭山向阳鹿场);冰醋酸溶液(辽宁泉瑞试剂有限公司);裂解液(碧云天);AR2140型电子天平(梅特勒-托利多仪器有限公司);FSH-2型可调高速组织匀浆机(江苏金坛亿通电子有限公司);AS系列超声波清洗机(天津奥特赛恩斯仪器有限公司);AG-5805台式离心机(上海志江商贸有限公司);YC-2层析实验冷柜(北京博医康实验仪器有限公司);HJ-6多头磁力加热搅拌器(苏州威尔实验用品有限公司);4℃冷藏冰箱(青岛海尔集团公司);SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂);HH S1-Ni电热恒温水浴锅(北京长安科学仪器厂);超净工作台;二氧化碳培养箱(SHELL/JB);倒置显微镜(XDS-1B);荧光显微镜(IBE2000);移液器、96孔板、细胞培养瓶、分析天平(FA1004,HENGPING);pH计(北京华瑞博远科技发展有限公司);HH S1-Ni电热恒温水浴锅(武汉爱斯佩科学仪器有限公司);SHZ-80A水浴恒温振荡器(江苏省金坛市医疗仪器厂);酶标仪(infinite M200 ThernoMixer).
1.2 方 法
1.2.1 匀浆法提取梅花鹿茸多肽
称取新鲜的梅花鹿茸约100 g,微解冻后,用切片机切成薄片,用粉碎机粉碎后放入到烧杯中,用预先放于层析柜(4℃)中冷却过的蒸馏水冲洗数次,至完全无血色;加入预冷的匀浆液(pH3.5的冰醋酸溶液)500 mL,匀浆机高速匀浆10 min(匀浆1 min后停30 s),使其充分散热,始终将匀浆瓶放入冰浴中,低温保持提取物活性,于4℃、以10 000 r/min的转速离心15 min,吸取上清液,标号后4℃保存待测.
1.2.2 匀浆裂解法提取梅花鹿茸多肽
实验步骤同1.2.1,匀浆后加入裂解液,在冰上不断摇晃,裂解0.5 h,于4℃、以10000 r/min的转速离心15 m in,吸取上清液,标号后,4℃保存待测.
1.2.3 匀浆超声法提取梅花鹿茸多肽
实验步骤同1.2.1,匀浆后超声0.5 h,在超声机中加入适量的冰块,超声提取后于4℃、以10 000 r/min的转速离心15 min后吸取上清液,标号后,4℃保存待测.
1.2.4 梅花鹿茸多肽纯化
分别取3组鹿茸粗多肽溶液400 mL,用饱和度80%的硫酸铵沉淀分离上述溶液,操作在冰上进行,并且不断搅拌,待硫酸铵固体溶解,置于层析柜中过夜,离心收集到的沉淀经透析除盐后冷冻干燥,得到鹿茸多肽粉末.
1.2.5 蛋白含量测定
采用BCA蛋白定量试剂盒测定蛋白含量,具体操作步骤参照试剂盒说明书,以牛血清白蛋白(BSA)为标准绘制标准曲线,计算蛋白含量.
1.3 细胞增殖作用的检测
1.3.1 MC3T3-E1细胞复苏
具体步骤:1)从液氮罐中取出冻存的MC3T3-E1细胞,立即将冻存管放入37℃水浴锅溶解,水浴解冻,轻摇冻存管,直到液体完全融化(水面不要超过冷冻管盖沿);2)用75%医用酒精消毒后再放入超净工作台中,补加适量新鲜的含血清的α-MEM培养液,将离心管盖拧紧,用离心机800 r/min离心5 min;离心完毕后,弃去上清,保留细胞,再加入10 mL含血清的α-MEM培养液,温柔地吹打细胞悬液,细胞吹匀后用移液器把细胞移至培养瓶中,十字轻轻摇晃培养瓶,放置37℃、5%CO2的恒温孵箱中培养.
1.3.2 MC3T3-E1 细胞传代
将MC3T3-E1细胞培养于含10%胎牛血清和1%青链霉素双抗的α-MEM培养基中,培养箱条件:37℃、5%CO2、相对湿度70%,定期于显微镜下观察细胞生长状况.隔2~3 d,应用0.25%的胰酶消化进行传代培养,具体步骤:1)弃掉培养瓶中的旧培养基;2)用PBS清洗细胞,倒去清洗液;重复2次;3)加适量的0.25%胰蛋白酶于培养瓶中,使胰酶完全覆盖于细胞层,置37℃培养箱中,消化约1~2 min;4)倒置显微镜下观察细胞,随着时间的推移,消化后的细胞逐渐趋于圆形,细胞不再粘连成片;加入含血清的培养基,终止消化;5)吸取瓶内消化液,吹打瓶壁,反复多次,使细胞从瓶壁脱离,形成悬液;6)将细胞悬液收集至15 mL离心管中,800 r/min,离心5 min,弃上清.加入新鲜α-MEM培养基,轻轻吹打细胞,制成细胞悬液,计数,将其稀释至合适的接种浓度,分瓶接种于新的培养瓶内.取生长良好的细胞用于后续实验.
1.3.3 MC3T3-E1 诱导细胞
成骨细胞分化采用成骨培养基(10 mmol/L β-甘油磷酸钠和100 μg/mL抗坏血酸)诱导细胞,并且每3 d更换成骨培养基.
1.4 MTT法检测MC3T3-E1细胞增殖活性
将 MC3T3-E1细胞浓度稀释为3×103个/mL,吸取100 μL细胞悬液接种到96孔板中,放置37℃、5%CO2恒温敷箱中培养24 h.细胞完全贴壁后,加药孔分别加入含 100 μg/mL,10 μg/mL,1 μg/mL 鹿茸多肽的10%FBSα-MEM培养液100 μL.空白对照组为10%FBSα-MEM 培养液,每组6个复孔.放置37℃、5%CO2恒温敷箱中继续分别培养48,72 h.培养结束后,每孔加入0.5 mg/mL MTT溶液20 μL,于37℃、5%CO2条件下继续孵育4 h,弃去培养液,加入二甲基亚砜(DMSO)150 μL,振荡10 min,以酶标仪测定550 nm波长下的吸光度.计算细胞增殖率:细胞增殖率=[A550nm(实验组平均)-A550nm(空白对照组)]/A550nm(空白对照组).
1.5 茜素红染色矿化分析
将MC3T3-E1细胞接种在6孔板上,并用匀浆法、匀浆裂解法和匀浆超声法分别制得的鹿茸多肽,处理21 d后用成骨培养基诱导的成骨细胞用PBS洗涤细胞3次,用4%多聚甲醛在4℃固定30min,并用去离子水冲洗.最后,将细胞用40 mmol/L茜素红溶液(pH 4.4)在室温下染色5~10 min,并用去离子水冲洗两次,使用光学显微镜捕获染色细胞的图像.
1.6 统计学分析
应用SPSS 17.0统计学软件进行统计分析,统计学方法每组数据均测定3次,并计算平均值,求3个数据的SD(相对标准偏差),绘图与t检验通过GraphPad Prism 7软件制得,以P<0.05为差异具有统计学意义.
2 实验结果
2.1 牛血清蛋白标准曲线及梅花鹿茸粗提液的可溶性蛋白含量
牛血清蛋白标准曲线见图1;梅花鹿茸粗提液可溶性蛋白含量见表1.
2.2 硫酸铵沉淀测定梅花鹿茸多肽含量
硫酸铵沉淀法测定梅花鹿多肽含量见表2.
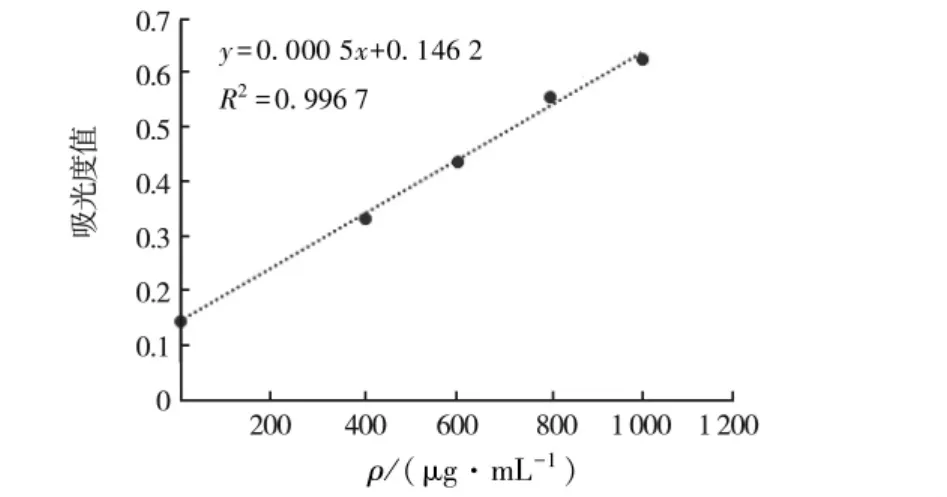
图1 牛血清蛋白标准曲线Fig.1 Standard curve of bovine serum albumin

表1 不同方法测定梅花鹿茸多肽提取率Tab.1 Extraction rate of sika velvet antler polypeptide measured by different methods η/%

表2 硫酸铵沉淀法测定梅花鹿茸多肽含量Tab.2 Contents of sika velvet antler polypeptide measured by ammonium sulfate precipitation ρ/(mg·mL-1)
2.3 梅花鹿茸多肽对MC3T3-E1细胞的促增殖作用
匀浆法、匀浆裂解法、匀浆超声法提取梅花鹿茸多肽对MC3T3-E1细胞增殖的影响,见图2~4.
2.4 鹿茸多肽对MC3T3-E1细胞矿化的影响
矿化对于骨形成十分重要.为进一步研究匀浆超声法制得的鹿茸多肽对骨矿化的重要性,使用茜素红染色进行矿化的定量测定.钙沉积物存在表明:与对照组(见图5,A)比较,匀浆法(见图5,B)、匀浆裂解法(见图5,C)和匀浆超声法(见图5,D)在诱导21 d后,MC3T3-E1细胞中的矿化现象呈现递增趋势.这些数据表明:匀浆超声法制得的鹿茸多肽可明显促进MC3T3-E1细胞矿化.

图2 匀浆法提取的梅花鹿茸多肽对MC3T3-E1细胞增殖能力的影响Fig.2 Effect of of homogenate extracted sika deer antler polypeptide on proliferation of MC3T3-E1 cells
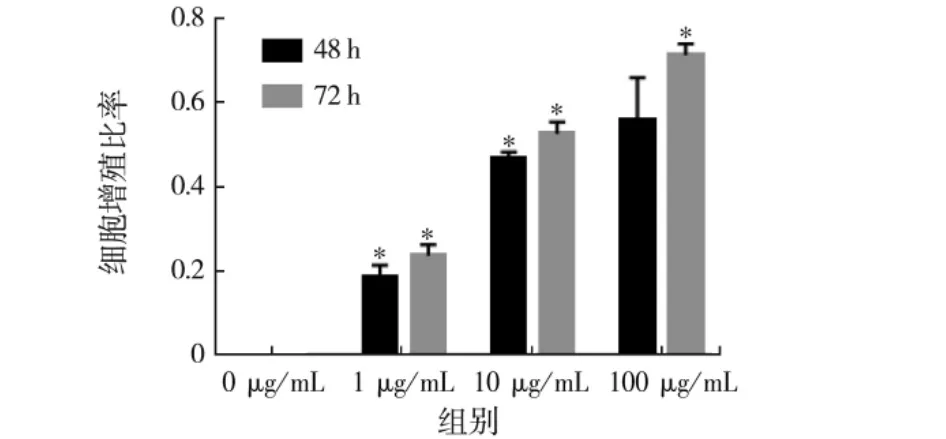
图3 匀浆裂解法提取的鹿茸多肽对MC3T3-E1细胞增殖能力的影响Fig.3 Effect of homogenate lysate extracted sika deer antler polypeptide on the proliferation of MC3T3-E1 cells

图4 匀浆超声法提取的梅花鹿茸多肽对MC3T3-E1细胞增殖能力的影响Fig.4 Effect of homogenate ultrasonic method on the proliferation of MC3T3-E1 cells
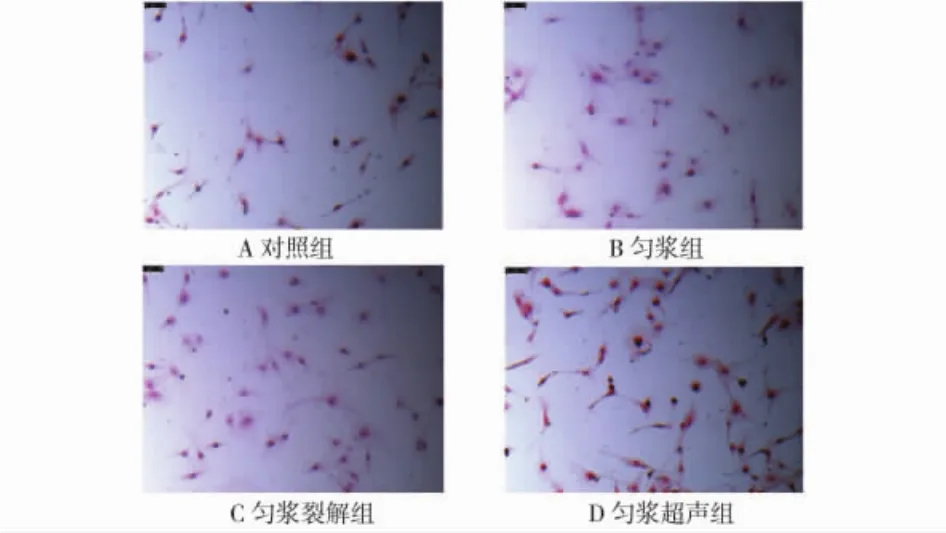
图5 鹿茸多肽对MC3T3-E1细胞矿化的影响(100×)Fig.5 Effect of pilose antler polypeptide on mineralization of MC3T3-E1 cells
3 讨 论
鹿茸是“东北三宝”之一,其功能广泛,是传统名贵药材,鹿茸多肽作为鹿茸主要的药理活性成分,有较高的临床应用价值.本实验探讨采用3种方法提取的鹿茸水溶性多肽对细胞活性影响,匀浆超声法的各项指标均高于匀浆裂解法和匀浆法,匀浆裂解法居次.从匀浆超声法和匀浆法两组可看出水溶性蛋白含量越高,活性也相应越高,说明匀浆超声工艺不但提高了水溶性多肽的含量,而且有利于活性保存.本实验采用经典硫酸铵沉淀法配合离心技术以获取鹿茸蛋白的粗提物,然后用透析法除盐,这种方法的优点是蛋白质的回收率高,并能将一般的非蛋白类物质的小分子除去.
匀浆超声法促MC3T3-E1细胞增殖活性和矿化现象显著高于匀浆法,裂解液法提取蛋白的步骤相对较多,提取时间长,可能会使蛋白发生降解,同时裂解液法中所用到的助溶剂中的几种成分有细胞毒性[7-8],匀浆裂解法对MC3T3-E1细胞活性不如匀浆法和匀浆超声法.匀浆超声法提取工艺简单,步骤少,成本低,对活性无影响.比较提取多肽的含量,匀浆超声的提取率为13.38%,匀浆裂解的提取率为15.56%,差距不大,又考虑到裂解液对后续细胞实验的影响,所以匀浆超声法更为适用.
综上所述,匀浆法和匀浆超声法提取鹿茸多肽更具临床价值.本实验表明:采用超声法提取鹿茸多肽,不仅可以节约时间,而且还可提高鹿茸多肽的提取量,是较为理想的具有蛋白活性的鹿茸多肽.

