大黄素对哮喘小鼠气道重塑的干预效果及机制
袁晓芳 王宋平
(西南医科大学附属医院呼吸一科,四川省泸州市 646000,电子邮箱:840786087@qq.com)
哮喘是由包括嗜酸粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、平滑肌细胞、气道上皮细胞等多种细胞及细胞组分参与的气道慢性炎症性疾病,病程的延长可导致一系列气道结构的改变,即气道重塑[1]。气道炎症和气道重塑是哮喘的两个重要特征。气道重塑主要包括气道管壁增厚、气道上皮下纤维化、平滑肌细胞增生肥大、肌成纤维细胞增生以及腺上皮化生,其中以基底膜下Ⅰ型、Ⅲ型、V型胶原纤维和纤维连接素等细胞外基质(extracellular matrix,ECM)沉积增加,肌成纤维细胞活化及增殖为突出表现。哮喘患者体内转化生长因子β1(transforming growth factor β1,TGF-β1)水平呈升高趋势,在肺组织中许多细胞,如气道上皮细胞、白细胞、嗜酸性粒细胞及T细胞等,均能产生TGF-β1,而TGF-β1在气道上皮下纤维化及气道平滑肌重塑中起着重要作用[2-4]。基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)和特异性内源性抑制因子之间的平衡在气道壁基质沉积和结构重塑中发挥重要的作用,其可通过诱导细胞增殖分化,促进新生血管形成,刺激成纤维细胞的增生并合成胶原等多种机制引起气道重塑[5]。
大黄素是中药大黄的重要单体,具有抑菌、抗炎、保护肝肾、抑制血小板聚集、改善微循环、抗癌等作用,具有较好的临床应用价值。近年来,研究显示大黄素有降低TGF-β1及MMP-9的表达,以及减少胶原沉积的作用[6-8]。然而大黄素是否能通过影响支气管肺组织中TGF-β1、MMP-9的表达,以及气道胶原的沉积,从而抑制哮喘气道重塑,目前国内外尚缺乏相关研究。本研究通过建立哮喘小鼠气道重塑模型,观察大黄素对哮喘气道重塑的影响,并探讨其可能机制。
1 材料与方法
1.1 实验动物及分组 选取清洁级雌性BALB/c小鼠32只(重庆腾鑫比尔实验动物销售有限公司,动物许可证号:21100230045566),6~8周龄,体重(20±2)g。将小鼠标号,采用抽签法随机分为正常组(A组)、哮喘组(B组)、哮喘+小剂量大黄素组(C组)、哮喘+大剂量大黄素组(D组),每组8只。
1.2 主要试剂及仪器 卵清蛋白(Sigma公司,批号:A8040),大黄素(北京索莱宝科技有限公司,批号:E8390),氢氧化铝(上海源叶科技有限公司,批号:S30353),兔抗鼠Ⅰ型、Ⅲ型胶原一抗(Abcam公司,批号:ab90395),辣根过氧化物酶标记山羊抗兔Ⅰ型、Ⅲ型胶原二抗(Aspen有限公司,批号:ab7778),MMP-9酶联免疫吸附剂测定试剂盒(优尔生公司,批号:SEA553Ra),TGF-β1 引物(武汉金开瑞生物工程有限公司),荧光定量PCR仪(Life Technologies公司,型号:StepOne),酶标仪(DiaTek公司,型号:DR-200BS),病理切片机(武汉恒意赛生物科技有限公司,型号:RM2016),光学显微镜(Olympus公司,型号:CX31),恒温培养箱(上海精宏实验设备有限公司,型号:GNP9160)。
1.3 哮喘气道重塑模型制备及给药方式 参照文献[9]方法制造哮喘气道重塑模型。B、C、D组小鼠自实验室适应性喂养1周开始,第0、7、14天腹腔注射卵清蛋白致敏液200 μL(含100 μg卵清蛋白+2 mg氢氧化铝),第21天以卵清蛋白激发液(含50 μg卵清蛋白)滴鼻建立支气管哮喘气道重塑模型,50 μL/次,3次/周,连续6周。C、D组自第21天起分别给予40 mg/(kg·d)、80 mg/(kg·d)大黄素[10]灌胃,A、B组以等量生理盐水灌胃,连续给药6周。滴鼻与灌胃时间间隔无特殊要求。
1.4 肺组织标本收集 于末次激发后24 h内断颈处死各组小鼠,将小鼠固定于手术板上,暴露胸腔,无菌条件下迅速取出左肺组织放于-80℃冰箱保存,备用于TGF-β1及MMP-9的检测。无菌条件下取出右肺组织用4%多聚甲醛固定,备用于苏木素-伊红(hematoxylin-eosin,HE)染色、Masson染色、免疫组织化学检测。
1.5 观察指标
1.5.1 支气管肺组织病理学改变:将部分支气管肺组织脱水、包埋及切片,经苏木素染细胞核、伊红染细胞质及脱水封片后,在200倍光学显微镜下观察支气管肺组织病理学改变情况,观察内容包括支气管壁厚度、气道上皮损伤程度、炎症细胞浸润程度。
1.5.2 气道重塑指标:将部分支气管肺组织脱水、包埋及切片,再将石蜡切片脱蜡至水,将肺组织经Masson染色后,在200倍光学显微镜下,每个标本随机选取3个直径在100~200 μm的完整支气管横截面,取其均值,采用Image-Pro Plus 6.0图像分析系统测量支气管基底膜周径、支气管总面积、支气管管腔面积、平滑肌外缘内气管面积、平滑肌内缘内气管面积,同时用支气管基底膜周径将测量值标准化,标准化平滑肌厚度=(平滑肌外缘内气管面积-平滑肌内缘内气管面积)/支气管基底膜周径,标准化支气管壁厚度=(支气管总面积-支气管管腔面积)/支气管基底膜周径。同时在200倍镜下同一样本随机选取3个视野,采用Image-Pro Plus 6.0图像分析系统测量胶原面积、整个图像总面积,计算胶原面积比,胶原面积比=(胶原面积/整个图像总面积)×100%。
1.5.3 肺组织Ⅰ型、Ⅲ型胶原含量:取出右中叶肺组织后,脱水、包埋,将石蜡切片常规脱蜡后经乙二胺四乙酸缓冲液微波修复,经磷酸缓冲盐溶液清洗(5 min/次,共3次)后放入3%过氧化氢溶液中,室温下避光孵育,经磷酸缓冲盐溶液清洗(5 min/次,共3次)后再用5%牛血清白蛋白封闭。去除牛血清白蛋白后,分别加入1 ∶150兔抗鼠Ⅰ型胶原一抗及1 ∶100的兔抗鼠Ⅲ型胶原一抗覆盖组织,4℃过夜,经磷酸缓冲盐溶液清洗(5 min/次,共3次),再分别加入辣根过氧化物酶标记的山羊抗兔Ⅰ型二抗及山羊抗兔Ⅲ型胶原二抗,37℃孵育50 min,去除磷酸缓冲盐溶液后加入二氨基联苯胺溶液,显色并洗净后用苏木素复染,经梯度酒精脱水、二甲苯透明后,中性树胶封固。用已知阳性切片作为阳性对照,用磷酸缓冲盐溶液代替一抗作为阴性对照。用Image-Pro Plus 6.0图像分析系统测定各组Ⅰ型、Ⅲ型胶原含量,以积分光密度值表示。
1.5.4 肺组织TGF-β1 mRNA的表达:用无菌方法取约100 g肺组织,置于1 mL预冷的总RNA抽提试剂中充分研磨,加入三氯甲烷4℃ 10 000 g离心10 min,加入异丙醇再次于4℃ 10 000 g离心10 min,最后加入75%乙醇再次于4℃ 10 000 g离心10 min,待酒精完全挥发后提取肺组织RNA,在反转录酶作用下合成cDNA。小鼠TGF-β1上游引物为5′-GTGGCTGAACCAAGGAGACG-3′,下游引物为5′-AGGTGTTGAGCCCTTTCCAG-3′,扩增长度为195 bp;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物为 5′-CGCTAACATCAAATGGGGTG-3′,下游引物为5′-TTGCTGACAATCTTGAGGGAG-3′,扩增长度为201 bp。PCR反应体系包括2×实时荧光定量PCR反应混合物5 μL,引物工作液1 μL,模板液1 μL,蒸馏水2.8 μL,ROX参比液0.2 μL。PCR反应为95℃下预变性1 min,然后95℃变性15 s,退火温度为58℃,20 s,72℃延伸45 s,共40个循环。其溶解曲线为60℃→95℃,每20 s升温1℃。PCR结束后,采用2-△△Ct法计算目的基因相对表达量。
1.5.5 肺组织MMP-9含量:按照酶联免疫吸附实验试剂盒说明书操作,检测小鼠肺组织MMP-9含量。
1.6 统计学分析 采用SPSS 17.0软件进行统计学分析。计量资料以(x±s)表示,多组比较采用单因素方差分析,两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况 建立支气管哮喘气道重塑模型后,A组小鼠活泼好动,毛发光滑,呼吸平稳;B组小鼠烦躁不安,频繁打喷嚏,呼吸急促伴口唇发绀,部分小鼠出现小便失禁;C、D组小鼠均有打喷嚏、呼吸急促等状况,但程度较B组小鼠轻。
2.2 各组小鼠支气管肺组织病理学改变 A组小鼠支气管管腔完整,内壁光滑,上皮未见明显损害,管腔未见上皮细胞脱落,支气管内未见炎症细胞浸润;B组小鼠支气管管壁明显增厚,黏膜上皮增生明显,支气管平滑肌层增厚,腔内可见黏液渗出,支气管内炎症细胞浸润明显;C组小鼠支气管管腔内可见脱落上皮及少许渗出,管腔可见少量炎症细胞浸润;D组小鼠支气管管腔可见少许脱落上皮及渗出,管腔炎症细胞浸润明显减少。见图1。

图1 各组小鼠支气管肺组织病理学改变(HE染色,×200)
2.3 各组标准化支气管壁厚度及平滑肌厚度、胶原面积比比较 B、C、D组标准化支气管壁厚度及平滑肌厚度、胶原面积比均厚于或大于A组,B组、C组、D组上述指标依次降低(均P<0.05)。见表1。

表1 各组标准化支气管壁厚度及平滑肌厚度、胶原面积比比较(x±s)
注:▲实验中死亡2只。与A组比较,△P<0.05;与B组比较,*P<0.05;与C组比较,#P<0.05。
2.4 各组肺组织Ⅰ、Ⅲ型胶原含量的比较 Ⅰ、Ⅲ型胶原在4组肺组织中均有表达。B、C、D组Ⅰ、Ⅲ型胶原水平均较A组升高,B、C、D组上述指标依次降低(均P<0.05)。见表2。
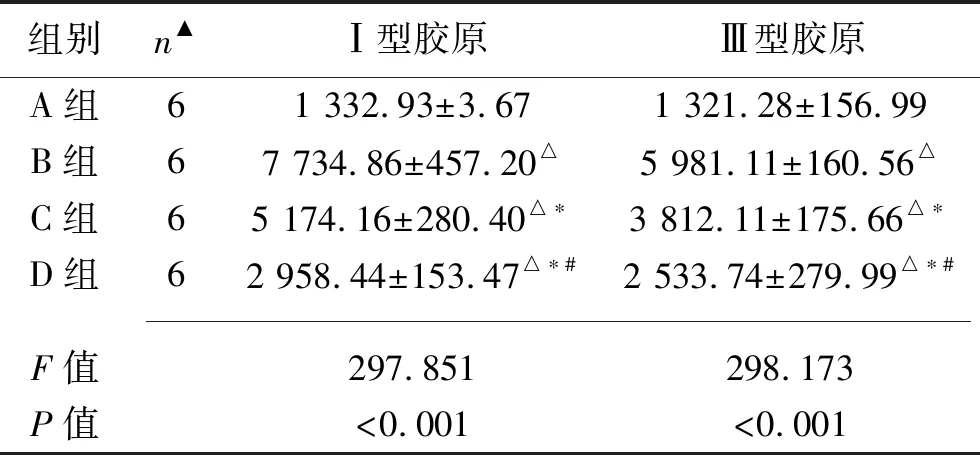
表2 各组Ⅰ、Ⅲ型胶原含量的比较(x±s)
注:▲实验中死亡2只。与A组比较,△P<0.05;与B组比较,*P<0.05;与C组比较,#P<0.05。
2.5 各组肺组织TGF-β1 mRNA表达水平及MMP-9含量的比较 B、C、D组TGF-β1 mRNA相对表达水平、MMP-9含量均高于A组,B、C、D组上述指标依次降低(均P<0.05)。见表3。

表3 各组肺组织TGF-β1 mRNA表达水平及MMP-9含量的比较(x±s)
注:▲实验中死亡2只。与A组比较,△P<0.05;与B组比较,*P<0.05;与C组比较,#P<0.05。
3 讨 论
哮喘是常见的慢性呼吸道疾病之一,其患病率在全球范围内有逐年增加的趋势[11]。气道重塑是哮喘的重要特征,它包括杯状细胞增生、上皮下胶原沉积、平滑肌增生肥大等。气道重塑程度与哮喘的严重程度密切相关,且气道重塑在哮喘的早期即已出现,并随疾病进程呈进行政性加重;即使哮喘症状获得短暂缓解,气道重塑仍呈进行性加重,并伴有肺功能的下降,可发展为不可逆的气道阻塞[12]。本研究结果显示,经卵清蛋白致敏的B、C、D组哮喘小鼠标准化支气管壁厚度及平滑肌厚度、气道基底膜下胶原面积均增加(P<0.05),提示3组小鼠均存在气道重塑。
TGF-β具有调节细胞生长和分化的作用,是由巨噬细胞、上皮细胞、成纤维细胞、嗜酸性粒细胞产生的促纤维化细胞因子,与哮喘的发生、发展密切相关[13]。许多学者认为TGF-β1在过敏性气道炎症及气道重塑中起着重要的主导作用,其不仅可以通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、P38、细胞外调节蛋白激酶、C-jun氨基末端激酶等通路的激活,诱导气道平滑肌细胞的增殖和肥大,还可以通过诱导哮喘气道上皮细胞上皮-间质转化,导致成纤维细胞数量增加,并引起ECM的蛋白合成和分泌,从而参与气道重塑[4,14]。本研究结果显示,B、C、D组TGF-β1 mRNA相对表达水平高于A组(P<0.05),与国内外研究结果相符,进一步说明TGF-β1参与气道重塑。
MMP是由20多种高度保守的锌、钙离子依赖性蛋白内切酶所组成的蛋白,可降解ECM。MMP及其组织抑制剂之间的平衡在合成及降解气道ECM中发挥重要作用。MMP-9作为MMP主要的存在形式,与哮喘有着密切联系。研究表明,哮喘状态下肺组织中MMP-9表达明显升高,这可引起上皮成纤维细胞增殖、活化,以及大量胶原纤维增生,从而促进气道重塑[15]。MMP-9不仅能引起胶原蛋白Ⅲ、胶原蛋白Ⅴ和肌腱蛋白沉积,还可降解ECM中的大部分成分如Ⅳ型胶原,并且通过释放固定化生长因子来促进平滑肌增生,而增生的平滑肌细胞进一步释放MMP-9,从而加重气道重塑。除此之外,MMP-9还可以促使平滑肌细胞移行到血管基质,扩大血管的表面积,使血管壁变薄,促进新血管形成,从而参与气道重塑中的血管重构[16]。本研究结果显示,B、C、D组MMP-9含量高于A组(P<0.05),提示MMP-9可能与气道重塑密切关系。
大黄素为中药大黄、百合等的活性成分,是单蒽核类1,6,8-三羟基蒽醌衍生物。近年来,有研究发现大黄素不仅能降低哮喘气道炎症,其对肺纤维化及慢性胰腺纤维化也有缓解作用[6,17]。本研究结果显示,B、C、D组标准化支气管壁厚度及平滑肌厚度、气道基底膜下胶原面积比、TGF-β1 mRNA相对表达水平依次减小或降低(均P<0.05),提示大黄素可能是通过降低TGF-β1 mRNA表达从而改善哮喘小鼠气道重塑,且大剂量的大黄素对气道重塑的抑制作用更明显。国内外研究也证实大黄素极可能通过Smad 2/3/7通路负性调节TGF-β1的表达而改善气道重塑[18-19]。本研究结果还显示,B、C、D组肺组织中MMP-9及Ⅰ、Ⅲ型胶原含量依次降低(均P<0.05),提示大黄素还可能通过降低MMP-9及Ⅰ、Ⅲ型胶原的含量,从而减轻气道重塑,且大剂量的大黄素的作用更明显。其可能是通过抑制MAPK激酶的激酶-MAPK激酶-MAPK信号通路,降低核转录因子-κB活化,以及抑制p38-MAPK和Janus激酶-信号传导子与转录激活子信号通路的激活,从而改善气道重塑[19-22]。
综上所述,大黄素可改善哮喘小鼠气道重塑,且大剂量的抑制作用更明显;其机制可能与大黄素抑制TGF-β1 mRNA、MMP-9、气道壁Ⅰ型及Ⅲ型胶原的表达有关。

