笔竹(Pseudosasa viridula)花粉活力及柱头可授性研究
赵婉琪,吴正春,肖 姣,国春策,杨光耀,林树燕,于 芬
(1.江西农业大学林学院江西南昌330045;2.江西省竹子种质资源与利用重点实验室江西南昌330045;3.南京林业大学竹类研究所江苏南京210037)
花粉作为传递遗传信息的重要载体,是植物在遗传繁育、杂交育种和种质保存方面必不可少的材料;柱头作为可识别和接收花粉的组织,其可授期是植物有性生殖过程中非常关键的时期;花粉生活力和柱头可授性的强弱是影响植物进行传粉繁育的重要因素。掌握花粉活力变化规律及其贮藏条件、开花过程中柱头可授性的动态变化对于生殖生物学研究、杂交育种都具有重要意义。竹类植物由于开花周期长,开花结实较为少见,使我们对其传粉机制、有性繁殖规律认识匮乏,而大部分竹种花后死亡会造成竹林衰退,使竹林产业、生态安全面临严重威胁[1-5]。近年来,不少学者对竹类植物花粉活力及柱头可授性进行了大量研究,如毛竹(Phyllostachys edulis)[6]、麻竹(Dendrocalamus latiflorus)[7]、紫竹(Ph.nigra)[8]、翠竹(Sasa pygmaea)[9]、异叶苦竹(Arundinaria simonii)[10]等,但未见关于笔竹(Pseudosasa viridulaS.L.Chen et G.Y.Sheng)花粉活力及柱头可授性的报道。
笔竹为禾本科竹亚科(Bambusoideae)矢竹属(PseudosasaMakino ex Naka)竹种[11]。目前,有关笔竹的研究资料很少[12-13],而对笔竹的花粉活力和柱头可授性测定,则未见相关报道。对花粉生活力鉴定有多种测定方法,试验采用操作简便的I2-KI染色法快速测定笔竹花粉活力,采用普遍应用的花粉离体培养基法比较分析不同采样阶段以及不同储藏条件下笔竹的花粉活性,同时对柱头可授性及可授期进行测定,以期探索竹类植物花粉萌发率、花粉适宜的储藏条件及柱头可授性变化规律,旨在丰富竹类植物生殖生物学特性,并为笔竹遗传改良、杂交育种研究提供基础资料,同时也是为揭示竹子开花的机制打下基础。
1 材料与方法
1.1 材料
材料采自江西农业大学竹类植物种质园内处于盛花期、成熟但未散粉的笔竹花药,用镊子夹入至离心管中,并保存在放有冰袋的保温箱内迅速带回实验室,现采现用。用解剖针划破花药,将其与液体培养液均匀混合,放入25℃恒温培养箱内。定期用滴管吸取培养液于载玻片上,并在显微镜下观察花粉萌发情况,每次观察统计至少3个不重复视野,每个视野花粉粒不少于100粒。以花粉管长度大于花粉直径为标准,萌发率=萌发总数/总花粉数。
1.2 实验方法
1.2.1 柱头可授性测定 采用联苯胺-过氧化氢法(1%联苯胺∶3%过氧化氢∶水=4∶11∶22)测定柱头可授性。若柱头具有可授性,则柱头周围反应液呈蓝色并伴随大量气泡,反之无气泡且不变蓝,共统计处于不同开花进程内的30枚柱头。
1.2.2 花粉生活力测定 取1枚成熟且未散粉的新鲜笔竹花药于载玻片上,用镊子或解剖针将其划破,均匀捣碎后,加入1-2滴I2-KI溶液,盖上盖玻片,移至显微镜下进行观察并拍照记录。
1.2.3 花粉最佳萌发时间 采集花粉置于基础培养基(5%蔗糖+0.01%硼酸)中,每隔0.5 h统计1次花粉萌发率,每次设置3个重复,直至花粉停止萌发。
1.2.4 花粉最适培养基组合 设置以下16种不同组合液体培养基(表1),pH=5.8[9];以前期测试的最佳萌发时间为标准培养时间,分别观察统计花粉在各个培养基上的萌发率,从而确定笔竹花粉的最适培养基组合。
1.2.5 花粉萌发的日变化率 选择笔竹盛花期的某一晴天从7∶00-18∶00每间隔1 h采集一次成熟未散粉花药,置于最佳培养基上,统计花粉萌发率,以确定1 d之内花粉萌发的变化规律。

表1 笔竹花粉离体培养基组分Tab.1 Composition of the culture medium for pollen germination
1.2.6 室温下花粉活力维持时间 采集成熟未散粉的花药,带回实验室,用解剖针剖开花粉囊,使花粉完全散出并直接放置于室温条件下,每隔5 min取适量花粉置于最佳培养基内,观测花粉萌发率。
1.2.7 不同储藏条件下的花粉萌发率 采集盛花期内成熟未散粉的花药,分别设置4种不同的储藏条件:①4℃不加干燥剂储藏;②4℃加干燥剂储藏;③室温不加干燥剂储藏;④室温加干燥剂储藏。每隔一定时间,置于最佳培养基中,统计不同储藏条件下笔竹花粉萌发率。
1.3 数据处理
试验数据采用Microsoft Excel 2010统计软件进行处理,SPSS17.0进行分析,采用单因素方差分析(One-Way ANOVA)进行均值间的差异性比较,用Duncan多重比较方法进行差异显著性检验,利用Origin2018绘制图表。
2 结果与分析
2.1 柱头可授性测定
由表2可知,柱头在未伸出时可授性检验显示少量气泡从柱头底部边缘冒出,即开花初期柱头已具有一定的可授性,可进行授粉;随着开花进程的推进,柱头可授性逐渐增强,当雌蕊发育成熟,花药开始散粉,整个柱头被大量气泡包裹,可授性最强;随着外稃闭合,柱头弯曲萎缩,可授性逐渐减弱。

表2 联苯胺-过氧化氢法检测柱头可授性Tab.2 The stigma receptivity estimated by benzidine-H2 O2
2.2 花粉活力测定
采用I2-KI染色法测定笔竹花粉活力,其中蓝色或黑蓝色的花粉为发育较好,黄褐色花粉为发育不良,无色花粉为死亡花粉粒。结果如下:共计镜检笔竹花粉粒11 141粒,其中发育良好的花粉粒6 275粒,约为56%,发育不良花粉粒4 034粒,约为36%,死亡花粉粒847粒,约为8%,笔竹花粉败育率约为44%。
2.3 花粉萌发最佳培养时间
不同培养时长对笔竹花粉萌发率的影响不同。由图2可知,随着时间的推移,笔竹花粉萌发率逐渐上升,到达3 h时花粉萌发率达到最高值30.73%±3.52%,后期萌发率趋于平稳,直至花粉管生长停滞,表明3 h为观测笔竹花粉萌发率的最适时长。

图1 笔竹花粉染色后的不同状态Fig.1 Different states of pollen after staining(1)发育良好花粉;(2)死亡花粉;(3)发育不良花粉(1)Well-developed pollen;(2)Dead pollen;(3)Stunted pollen
2.4 花粉萌发最适培养基组合
不同培养基组合对笔竹花粉萌发率的影响不同。由图3得知,笔竹花粉在第5号(10%蔗糖+0.01%H3BO3)培养基组合上的萌发率最高,达到43.61%±2.58%,极显著高于其他培养基组合,说明10%蔗糖 +0.01%H3BO3培养基组合为最佳培养基组合;在第15号(20%蔗糖+0.1%H3BO3)培养基组合上花粉萌发率达到最低,仅为3.2%±0.74%,说明高浓度的蔗糖会导致花粉内、外渗透压无法保持平衡,细胞脱水死亡,因而降低花粉的萌发率;Ducan多重比较分析结果显示,在p=0.05检验水平上,第1、5、9、13号培养基显著高于其他培养基组合,即在相同蔗糖浓度的条件下,花粉在加入低浓度的硼酸(0.01%)后萌发率提高。
2.5 花粉萌发的日变化率

图2 花粉的最佳萌发时间Fig.2 The optimal time for pollen to germinate
2019年3月25日从7∶00-18∶00每隔1 h持续采集成熟未散粉花药,置于花粉萌发最佳培养基组合10%蔗糖+0.01%H3BO3上培养3 h。图4结果表明,1 d之内不同时间段花粉萌发率差异明显,其中3∶00 pm时花粉萌发率显著高于其他时间点,达37.41%±7.25%;随后迅速下降,在6∶00 pm时达到最低,仅为4.76%±2.07%。花粉萌发日变化率测定为日后笔竹授粉时间确定提供了参考依据。
2.6 室温下花粉活力维持时间
测定花粉(无花粉囊)在室温下的花粉萌发率:由图5可知,新鲜笔竹花粉的萌发率最高,可达41.3% ±7.39%;而随着在室温内放置时间的增加,花粉萌发率在10 min后迅速下降,20 min后花粉萌发率仅为6.93%±1.13%,30 min后萌发率只有2.24%±0.56%,35 min后花粉完全失去活力,花粉活力维持时间非常短,极易失活;在自然条件下,受光照、降水等环境因素的影响,花粉更易丧失萌发能力,因此做到现采现授,有助于提高竹花受精率。

图3 不同液体培养基组合中花粉的萌发率Fig.3 The germination rate of pollen in different liquid culture media

图4 花粉萌发的日变化率Fig.4 The diurnal variations of pollen germination

图5 室温条件下的花粉萌发率Fig.5 The germination rate of pollen under room temperature
2.7 不同储藏条件下的花粉萌发率
测定花药在4种不同储藏下的花粉萌发率:采集新鲜花药进行4种不同处理,取一定的花粉置于最佳培养基组合上培养。由图6可知,随着时间延长,4种不同储藏条件下的花粉萌发率均呈显著下降趋势;可以看出4℃条件下,未经干燥处理的花粉萌发率显著高于干燥处理过的花粉,其中前8 h内,2种处理下的花粉活性下降趋势不显著,随着时间延长,干燥处理后的花粉活力迅速下降,72 h内花粉失活,而相同温度下未经干燥处理的花粉活力则延长至120 h;常温条件下,经过干燥处理的花粉在24 h内迅速失活,而未经过干燥处理的花粉储藏24 h后活力为10.6%±6.42%,直至3 d后才完全失去活性;综上所述,是否经过干燥处理对笔竹花粉活力具有显著影响,4℃低温对花粉活力具有一定的积极作用,因此低温、湿藏短时间内可有效延长笔竹的花粉活力,但仍难以满足远距离携带,因此,笔竹杂交育种工作尽可能做到现采现授。
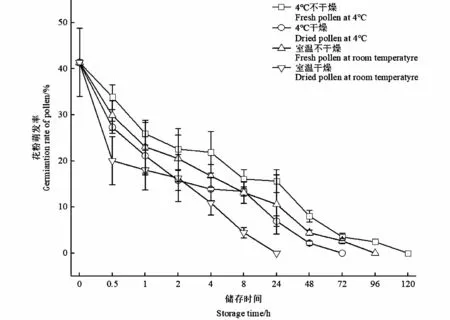
图6 不同储藏条件下的花粉萌发率Fig.6 The germination rate of pollen under different treatments
3 讨论
花粉活力和柱头可授性是影响授粉质量和结实率的关键因素,因此准确测定花粉活力和柱头可授性非常重要,是人工授粉实践前必不可少的基础研究。实验中,采用了染色法和萌发法2种不同的实验方法测定花粉活力,通过对比发现,I2-KI染色法测得新鲜笔竹花粉活力为56%,在室温下放置15 min后失去活力;采用花粉离体培养基法测得新鲜花粉萌发率为41.3%,放置在室温条件下10 min后活性迅速下降,在35 min左右完全失活,两者具有差异。在以往的研究中,对短穗竹(Brachystachyum densiflorum)[14]、早竹(Ph.praecox)[15-16]、孝顺竹(B.multiplex)[17]等多种竹种花粉萌发率测定实验结果也表明两种实验结果均存在差异,这是因为I2-KI染色法虽然快速、简便,但未考虑外界环境(温度、湿度、时间、pH值等)对萌发率产生的影响,误差相对较大,而离体萌发为花粉提供的条件与花粉在柱头内自然萌发的条件更为相近,因此花粉离体培养基法测定结果相较于染色法更为准确[18]。但同时2种实验均表明,笔竹花粉活力不高;新鲜的笔竹花粉萌发率最强,但随着时间的延长,花粉活力均迅速下降直至失去活性。
离体培养基法常用的基本成分是蔗糖和硼酸,蔗糖对植物花粉离体萌发起到关键影响,主要起到提供营养能量和调节渗透压的作用[19-21];硼酸在花粉萌发的作用中主要起到促进糖的吸收、代谢,并参与花粉管壁的建造,从而促进花粉萌发和花粉管伸长[22-24];硼酸与蔗糖的融合能够更好地提高花粉的萌发率,因此添加适宜浓度的蔗糖和硼酸有利于促进花粉萌发。实验结果表明,过高或过低的蔗糖浓度都不利于笔竹花粉萌发,当蔗糖浓度稳定在10%时,笔竹花粉内、外渗透压平衡,花粉萌发效果最好,与五月季竹(Ph.bambusoides)[25]、木竹(B.rutila)[25]、雷竹(Ph.praecoxf.prevernalis)[26]、福建茶秆竹(P.amabilisvar.convexa)[14]等多种竹种所需蔗糖浓度一致;当硼酸浓度为0.01%时更有利于促进笔竹花粉萌发和花粉管生长,这与林树燕等[10]、刘静等[27]的研究结果一致。
花粉活力除了受自身遗传因素的影响外,也与外界环境因素影响紧密相关,其中储藏温度和湿度是影响花粉活力最重要的外界环境因素。一般来说,低温和冷藏处理可以抑制花粉的呼吸作用和酶活性,适宜的花粉含水量有利于储藏时间的延长[28-29]。本实验中通过4℃低温湿藏将笔竹花粉活力延长至120 h;前人报道雷竹花粉在低温湿藏可保存114 h[26];毛竹花粉在4℃低温保存5 d后仍可授粉利用[30];陈良碧等[31]对禾本科3种不同植物花粉在不同储藏条件下进行保存,发现低温湿藏处理下花粉蛋白质降解更慢,进一步证明低温、湿藏是有利于延长植物花粉活力的储藏条件。
柱头的可授期在一定程度上决定着授粉的成功与否。通过采用联苯胺-过氧化氢测定笔竹柱头可授性,研究结果表明,开花初期笔竹柱头即具有可授性,随着开花时长的增加,可授性逐渐增强,直至雌蕊发育成熟、花药开始破裂散粉时可授性达到最强,但随着散粉完成,内、外稃的闭合,柱头由透白、直立变成枯黄、萎缩,柱头可授性也随之减弱,柱头可授期非常短,仅2~3 h,因此把握正确的可授期可有效增加授粉成功的几率。
4 结论
综上所述,花粉离体培养基法相对于I2-KI染色法测定花粉活性更具有准确性;离体培养花粉的过程中,过高或过低浓度的蔗糖和硼酸都不利于促进花粉萌发,因此笔竹花粉在浓度为10%蔗糖+0.01%硼酸的培养基内培养3 h萌发率最高;1 d内不同时间段、开花进程内的花粉活性、柱头可授性不同,笔竹花粉在3∶00 pm左右花粉活性最强,而柱头可授性在花药散粉时期最强,可在此时间段收集新鲜笔竹花粉对散粉期的柱头进行授粉;新鲜花粉易失活,4℃低温湿藏短时间内有利于延长花粉活性。花粉活力的强弱和柱头可授期的长短是影响授粉成功的关键因素,研究为笔竹授粉繁育及杂交育种研究提供了参考依据。

