2018年江西及福建省新现猪急性腹泻冠状病毒的分子流行病学调查
张誉瀚,袁为锋,张帆帆,李 凯,李指全,宋德平,唐玉新
(1.江西农业大学动物科技学院,江西 南昌 330045;2.江西省动物疫病诊断与防控重点实验室,南昌 330045)
2017年2月,研究人员从广东腹泻哺乳仔猪中检测到一种新的类似蝙蝠冠状病毒HKU2的冠状病毒:猪急性腹泻综合征冠状病毒(Swine Acute Diarrhea Syndrome Coronavirus,SADS-CoV),随后该病毒被成功分离,动物试验证实了该病毒可引起仔猪急性腹泻,发病率和死亡率均非常高[1];SADS-CoV是甲型冠状病毒属成员,具有典型的冠状病毒结构,病毒表面有突起,直径为100~200 nm,基因组为单股正链RNA。全基因组序列分析显示SADS-CoV全长27 155 nt,与来源于蝙蝠的冠状病毒HKU2同源性高达95%,但两者的纤突蛋白序列核苷酸和氨基酸相似性分别只有80%和87%,这表明HKU2不是SADS-CoV的直接祖先,但两者在遗传进化上相近[1-2]。据报道,SADS-CoV主要引起仔猪的水样腹泻,剧烈呕吐、消瘦和脱水,其中5日龄以下感染仔猪死亡率达90%,8日龄以上感染仔猪死亡率低于5%。自2016年10月SADS-CoV在广东清远某猪场暴发后,相继又在该地区的其它3个猪场暴发,截至2017年5月该病毒共造成24 693头仔猪死亡,但该病毒目前仅在广东清远地区报道过。研究发现SADS-CoV不与目前猪场流行的3种冠状病毒:猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus,PEDV)、猪传染性胃肠炎病毒(Porcine Transmissible Gastroenteritis Virus,TGEV)及猪德尔塔冠状病毒(Porcine Deltacoronavirus,PDCoV)的抗体发生交叉反应,因此现有的猪冠状病毒疫苗对SADS-CoV感染可能无效,这对我国新生仔猪腹泻病原的检测与防控提出新的挑战[1-5]。
目前,SADS-CoV的诊断方法主要有病原分离鉴定、免疫荧光染色、RT-PCR等方法。分离培养法对实验室的条件要求较高,费时且操作繁琐,对人员的技能要求较高[6]。PCR法不但能克服病毒分离困难,易产生交叉反应等特点,还具有敏感性高,特异性强的特点。普通PCR方法虽然操作简便但由于其检测的灵敏度有限,极易出现假阴性。套式PCR方法与普通PCR方法相比具有更高的灵敏度和特异性且经济、易于推广等诸多优点[7]。本研究旨在建立一种快速敏感的检测方法,为SADS-CoV的临床诊断和流行病学研究提供更为敏感和可靠的手段。
1 材料与方法
1.1 毒株及临床样品
SADS-CoV毒株为从临床发病猪场样品中分离获得,由本实验室保存。临床样品为2018年从江西及福建8个规模猪场采集的492份猪粪便样品,-80℃保存。
1.2 试剂
酵母提取物、胰蛋白胨、氨苄青霉素均购自北京索莱宝科技有限公司;TaKaRa Ex Taq、10×Ex Taq Buffer、dNTP Mixture、DL 2 000 DNA Marker、pMD18-T载体均购自宝生物工程(大连)有限公司;质粒小提试剂盒购自北京天根生化科技有限公司;胶回收试剂盒购自OMEGA公司。
1.3 主要仪器设备
SorvallST16R高速冷冻离心机和Legend Micro 21R高速冷冻离心机均购自美国Thermo公司;NanoDrop 2000微量核酸测定仪购自美国基因公司;Applied Biosystems 9700 PCR仪购自美国应用生物系统公司;水平电泳槽购自北京六一科技有限公司;凝胶成像系统购自上海培清科技有限公司。
1.4 引物设计
根据GenBank中公布的猪急性腹泻综合征冠状病毒GDS04毒株(GenBank登录号MF167434)的N基因保守区域,应用Primer Premier 5.0软件设计两对特异性引物,引物由上海生工生物工程技术公司合成。其它相关病毒,如PEDV和PDCoV的检测引物参考Song等的引物和方法进行[8]。引物序列如表1所示。

表1 引物信息
1.5 病毒RNA提取
小肠组织按1∶2体积用PBS稀释后匀浆,反复冻融3次;粪便按1∶2体积用PBS稀释后充分涡旋,冻融3次;冻融好的样品涡旋3~5 min,4℃8 000 r/min离心 10 min;取 250 μL 上清液加 750 μL RNAiso Plus,静置5 min后加入200 μL氯仿,连续剧烈震荡15 s后静置2 min;4℃于1.5 mL灭菌EP管内,4℃12 000 r/min离心15 min;吸取400 μL上清液至新EP管中,加入等体积预冷的异丙醇,涡旋振荡混匀,常温静置5 min;4℃ 12 000 r/min离心10 min,弃上清;沉淀加入1 mL经DEPC处理水稀释的75%乙醇;4℃ 12 000 r/min离心10 min,弃上清液;室温放置5 min,沉淀用30 μL DEPC处理过的水溶解,-80℃保存备用。
1.6 RT-PCR扩增反应
以上一步提取的病毒RNA为模板进行反转录和PCR扩增,反转录反应体系为:5×Buffer 4 μL、dNTP mix 2 μL、待测样品的 RNA 模板 2.5 μL、Ribonuclease inhibitor 0.5 μL、M-MLV 1 μL、Mg2+2 μL、Random Primer 2 μL、ddH2O 6 μL。反应程序为:42 ℃50 min;95 ℃ 5 min。PCR 反应体系:10×Ex Taq Buffer 2.5 μL、待测样品的 cDNA 模板 2.5 μL、TaKaRa Ex Taq 0.3 μL、dNTP Mixture 1 μL、ddH2O 16.7 μL、SADS-CoV-OF 1 μL、SADS-CoV-OR 1 μL,总体积为25 μL。PCR扩增程序为:94℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸45 s,进行20个循环;72℃再延伸7 min。
1.7 套式PCR方法优化
套式 PCR 反应体系:SADS-CoV-IF 1 μL、SADS-CoV-IR 1 μL、外套PCR扩增产物稀释100倍模板 2.5 μL、TaKaRa Ex Taq 0.3 μL、10×Ex Taq Buffer 2.5 μL、dNTP Mixture 1 μL、ddH2O 16.7 μL。反应程序为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,进行20个循环;72℃延伸7 min。PCR产物2%琼脂糖凝胶电泳观察电泳结果。用本研究建立的套式PCR检测方法分别以PEDV、TGEV、PDCoV的基因组 DNA以及 SADSCoV的DNA为模板进行PCR扩增,以此检测该方法的特异性。利用引物组对提取的SADS-CoV基因组DNA为模板进行PCR扩增;然后采用Omega Gel Extraction Kit回收PCR产物作为目的片段;采用大连宝生物的pMD18-T Cloning Vector试剂盒,将上述目的片段插入pMD18-T载体中,构建重组质粒,通过转化及筛选,得到含插入有上述目的片段的重组质粒的阳性克隆菌;该阳性克隆菌经过扩大培养后,用天根质粒提取试剂盒提取培养菌液中的质粒,提取方法参照说明书。通过超微量分光光度计NanoDrop 2000测定提取的重组质粒的浓度,再根据重组质粒分子质量和阿伏伽德罗常数将质粒浓度换算成单位体积分子拷贝数,并将重组质粒以1.0×108拷贝/μL为原始浓度后进行10倍梯度稀释,分别以 1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101、1.0×100拷贝/μL 为模板进行多重PCR扩增以检验该检测方法的灵敏度。以提取的SADS-CoV的基因组DNA为模板,进行3次扩增(间隔1周),以确定检测结果的重复性。
1.8 江西及福建省猪群SADS-CoV临床分子流行病学调查
利用本试验所建立的猪急性腹泻综合征冠状病毒套式PCR检测方法对采自江西7个猪场460份粪便样品和福建1个猪场32份粪便样品,共计492份样品进行检测,以验证该方法的实用性。
2 结果与分析
2.1 外引物与内引物RT-PCR扩增结果
利用所设计的外引物SADS-CoV OF、SADS-CoV OR进行RT-PCR反应,扩增出大小约为650 bp的片段,其大小与理论预期相符(图1)。片段回收、克隆后进行测序,测序结果经比对表明为SADS-CoV。用内引物SADS-CoV IF和SADS-CoV IR对外引物扩增的cDNA产物进行套式PCR扩增,扩增出约291 bp大小的片段,其大小与理论预期相符(图1)。测序结果证实所扩增片段为SADS-CoV。

图1 外套引物与内套引物扩增结果
2.2 套式PCR敏感性试验
对以1.0×108拷贝/μL为原始浓度后进行10倍梯度稀释的重组质粒进行多重PCR反应。结果表明:本试验所建立的猪急性腹泻综合征冠状病毒套式PCR检测方法的最低检测量为1.0×102拷贝/μL,表明所建立的PCR方法敏感性良好(图2)。

图2 套式PCR敏感性试验
2.3 套式PCR特异性试验
应用本试验所建立的猪急性腹泻综合征冠状病毒套式PCR检测方法对PEDV、TGEV和PDCoV的检测结果均为阴性,只有猪急性腹泻综合征冠状病毒的PCR检测结果呈阳性,表明该套式PCR检测方法的特异性良好(图3)。

图3 套式PCR特异性试验
2.4 套式PCR重复性试验
利用本试验所建立的猪急性腹泻综合征冠状病毒套式PCR检测方法在不同时间点进行测定,测定结果一致,表明本发明所述的方法重复性良好(图4)。

图4 套式PCR重复性试验
2.5 临床样品SADS-CoV流行情况调查
用建立的套式PCR对采集自江西省7个猪场460份临床病料进行检测,均未检出SADS-CoV,从福建猪场中检出了2份SADS-CoV阳性样品,阳性率为6.25%(表2)。同时,还检测了其它两种腹泻病毒,PEDV和PDCoV。结果发现,492份样品中有39份为PEDV阳性,阳性率为7.93%,其中江西临床猪只粪便样品中有6.96%(32/460)为PEDV阳性,福建样品中有21.87%(7/32)为PEDV阳性。还从样品中检出了PDCoV,阳性率为11.59%,其中江西临床样品的阳性率为12.17%,福建样品中阳性率为3.12%。
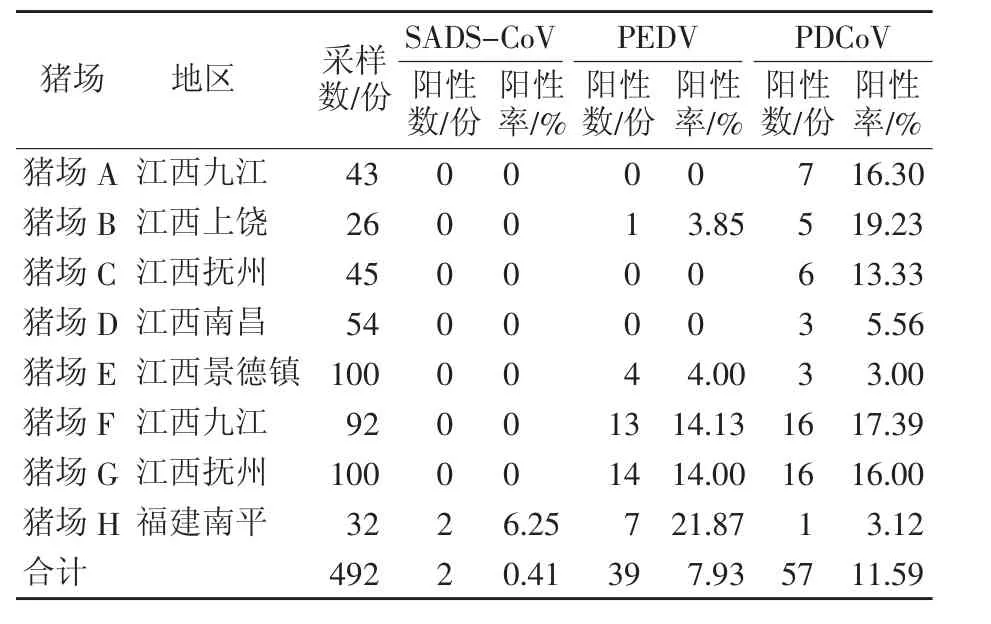
表2 临床样品中SADS-CoV及相关腹泻病毒检测结果
3 讨论
2017年,Pan等从哺乳仔猪中分离到一种类似蝙蝠HKU2冠状病毒的猪肠溶性alpha冠状病毒,该病毒主要引起仔猪的水样腹泻,剧烈呕吐、消瘦和脱水,其中5日龄以下感染仔猪死亡率达90%,8日龄以上感染仔猪死亡率低于5%。Zhou等研究结果显示SADS-CoV至少自2016年8月起在中国出现,SADS-CoV的患病率仅次于PEDV,为43.53%。SADS-CoV阳性样品中有62.2%的样品与PEDV、TGEV和PDCoV这3种冠状病毒中的一种或几种发生共感染,其中与PEDV的共感染率最高,为17.65%[9]。Zhou等研究结果显示,猪场在大规模暴发SADS-CoV之前曾暴发过PEDV,由此推测PEDV可能会促进SADS-CoV的感染[10]。SADS-CoV感染的仔猪全肠道切片均显示轻微的微观病变,但严重程度要低于PEDV感染的仔猪,与PDCoV相比,PDCoV仅空肠和回肠有病变[11],由此推知SADS-CoV的致病性要低于PEDV,高于PDCoV[1,12]。研究发现该病毒所引起的临床症状与TGEV、PEDV所引起的临床症状非常相似,均可使新生仔猪产生水样腹泻,剧烈呕吐,最终脱水死亡[13-16],这给三者的鉴别诊断带来了很大困难,给养猪业带来了巨大的经济损失。
目前,SADS-CoV的诊断方法主要有实时荧光定量、RT-PCR、ELISA(酶联免疫吸附试验)、病毒分离、免疫荧光法等。经对比后发现针对N基因的qRT-PCR检测方法灵敏度最高,且稳定性最好。但由于TaqMan RT-PCR对设备和操作人员的技术要求较高,且成本较高,不大适合现今各级诊断实验室大规模临床检测与流行病学调查,因此,建立一种简单、经济而可靠的SADS-CoV诊断技术非常有必要[17]。套式PCR具有较高的敏感性和特异性。相对于普通PCR,套式PCR通过两轮扩增的方法可最大限度地降低非模板物质、RNA样本纯净度等因素对PCR扩增的影响,从而获得理想结果[18]。从特异性来看,本方法不与PEDV、PDCoV和TGEV产生交叉反应,表明本方法确实是一种特异高效的诊断方法[19]。由于套式PCR需要经过两次扩增,可避免因操作不当或仪器污染等因素造成的一次扩增出现的假阳性检测结果,提高了检测结果的可靠性。
用建立的套式PCR检测方法对采集自江西省7个猪场460份临床病料进行检测,均未检出SADS-CoV,从福建猪场中检出了2份SADS-CoV阳性样品,阳性率为6.25%,目前,虽然SADS-CoV阳性检出率不如PEDV、PDCoV阳性检出率高。但是SADS-CoV可能会继续发生变异,造成大规模流行。因此进一步了解江西猪群中SADS-CoV的感染情况,追溯SADS-CoV的来源和分析各毒株间的进化关系,以及对该病毒的分离、致病性研究,乃至疫苗开发是目前亟待开展的工作。
4 结论
本研究根据GenBank数据库的SADS-CoV基因组序列,设计了扩增SADS-CoV基因片段的外套和内套特异性引物,扩增的片段大小分别为650 bp和291 bp,建立了SADS-CoV的套式PCR检测方法。应用所建立了的套式PCR检测方法对采集自江西省7个猪场460份临床病料进行检测,均未检出SADS-CoV,从福建猪场中检出了2份SADS-CoV阳性样品,阳性率为6.25%。本研究将为调查该病毒在江西省的流行情况奠定基础,为SADS-CoV所致疾病防控提供参考。
——一道江苏高考题的奥秘解读和拓展