益生菌应用对2型糖尿病患者肠道菌群的影响
张 研 蒋鸿阳 刘殿媛 李盛学 王 清
作者单位:吉林大学中日联谊医院 内分泌代谢科 130033
近年来肠道菌群与2型糖尿病的关系越来越受到国内外学者的关注[1]。肠道菌群变化与宿主的胰岛素抵抗、肥胖、全身炎症和氧化应激密切相关[2]。肠道菌群失调加重胰岛素抵抗而影响糖代谢及其并发症的进展。本研究拟在2型糖尿病患者中采用益生菌干预,研究肠道菌群的变化,探讨该干预方式的临床应用价值。
1.资料与方法
1.1 研究对象 选取2017年1月至7月在中日联谊医院内分泌代谢科就诊的2型糖尿病患者为受试者,需满足7.0%≤HbA1c≤10.0%,共入组101人,糖尿病病史1周~26年;所有受试者了解研究方案后参加试验,自愿遵从研究者的指导,签署知情同意书。排除标准:伴有严重的肝肾功能受损、心衰、发热、感染、糖尿病急性并发症以及妊娠和哺乳期妇女、空腹血糖≥13.3mmol/L,严重高血压(收缩压≥180mmHg和/或舒张压≥110mmHg)以及研究者认为不适合加入者。2型糖尿病诊断符合1999年制定的WHO糖尿病诊断标准。
1.2 研究方案 所有受试者由专人进行病史采集,记录性别、年龄、病程、身高、体重、血压。嘱受试者规律饮食,指导患者每日运动量相近,在降糖方案不变的基础上,每日服用益生菌产品,包括长乐胶囊3粒,每日3次口服,洚糖奇冲剂1袋,每日2次餐前1.5小时冲服(均为吉林天三奇药业有限公司生产)进行联合干预,总疗程24周。长乐胶囊是以玉米粉、大米粉、脱脂乳粉、小麦粉、脱脂大豆粉、低聚异麦芽糖、白砂糖、葡萄糖、酵母浸膏为主要原料制成的保健食品,每100g中含两歧双歧杆菌1.2×108CFU、嗜酸乳杆菌4.2×108CFU、嗜热链球菌4.3×108CFU;洚糖奇冲剂的成分为豆粉、奶粉、可可粉、钙粉、山药粉、魔芋粉、螺旋藻粉、杏仁粉、乌梅粉、甘草粉等,餐前服用可以增加饱腹感,其中的碳水化合物起到类似益生元的作用。所有受试者在试验期间维持原有降糖、降压、调脂等治疗方案不变,共101人入组,75人完成临床观察安全出组。
1.3 检测指标 每个受试者检测基线和终点时空腹血糖(FBG)、餐后2小时血糖、血脂、肝功、肾功、尿常规、空腹C肽(FCP)、糖化血红蛋白(HbA1c)等指标。留取受试者基线和终点时粪便进行肠道菌群16srRNA高通道测序(委托微基生物科技(上海)有限公司进行),对样本肠道微生物多样性进行鉴定和分析。胰岛素抵抗指数HOMA-IR=(FCP×FBG)/22.5。
1.4 统计学方法 正态分布资料用均数±标准差表示,采用配对t检验方法进行分析;非正态分布资料用中位数(四分位数)表示,采用配对秩和检验进行分析。所有数据采用SPSS软件进行统计分析。
2.结果
2.1 联合干预对受试者一般情况、血糖、血脂和胰岛素抵抗水平的影响 完成临床观察者共75例(平均年龄56.5±7.5岁),男性25例,女性50例。受试者终点时体重、收缩压和舒张压较基线水平下降,但无统计学意义。空腹血糖明显降低,差异有统计学意义(P<0.05),餐后2小时血糖及糖化血红蛋白下降,但无统计学意义(见表1)。将HbA1c<7.0%定义为达标,入组时受试者HbA1c达标率为27.7%,出组时HbA1c达标率为35.6%。联合干预对血脂的影响无统计学意义(见表1)。将甘油三酯<1.7mmol/L定义为达标,入组时甘油三酯达标率为38.6%,出组时达标率为52.5%。将总胆固醇<5.2mmol/L定义为达标,入组时总胆固醇达标率为44.6%,出组时达标率为61.4%。受试者空腹C肽水平在干预前后无统计学差异,用HOMA-IR代表胰岛素抵抗水平,干预后受试者终点HOMA-IR下降,有统计学意义(P<0.05),胰岛素抵抗得到改善。

表1 联合干预对受试者血糖、血脂、胰岛素抵抗的影响
注:*P<0.05。
2.2 安全性 访视期间所有受试者未出现严重低血糖及心脑血管事件,联合干预前后受试者肝功、肾功未见明显改变。
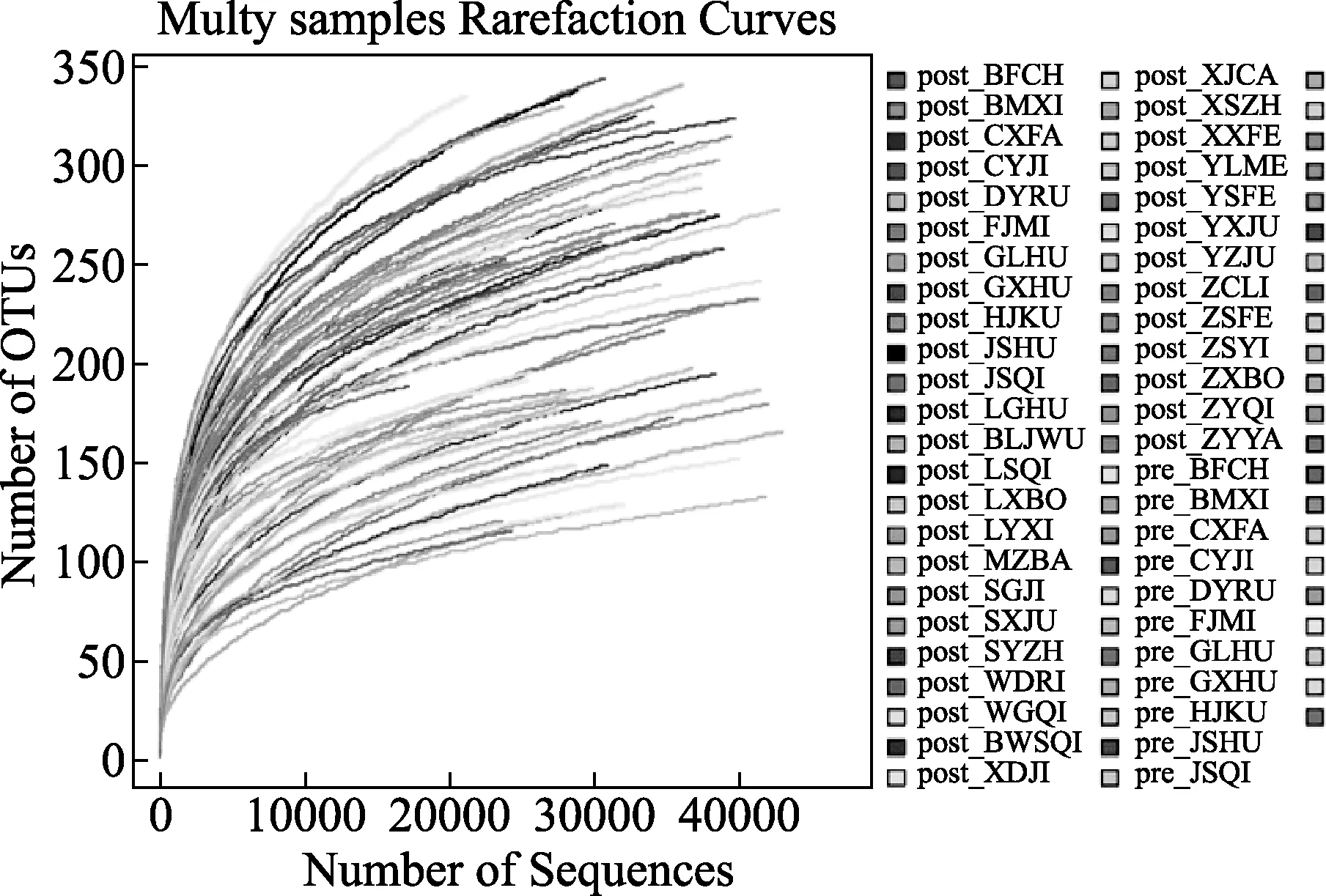
图1 各样本OUTs稀释曲线图
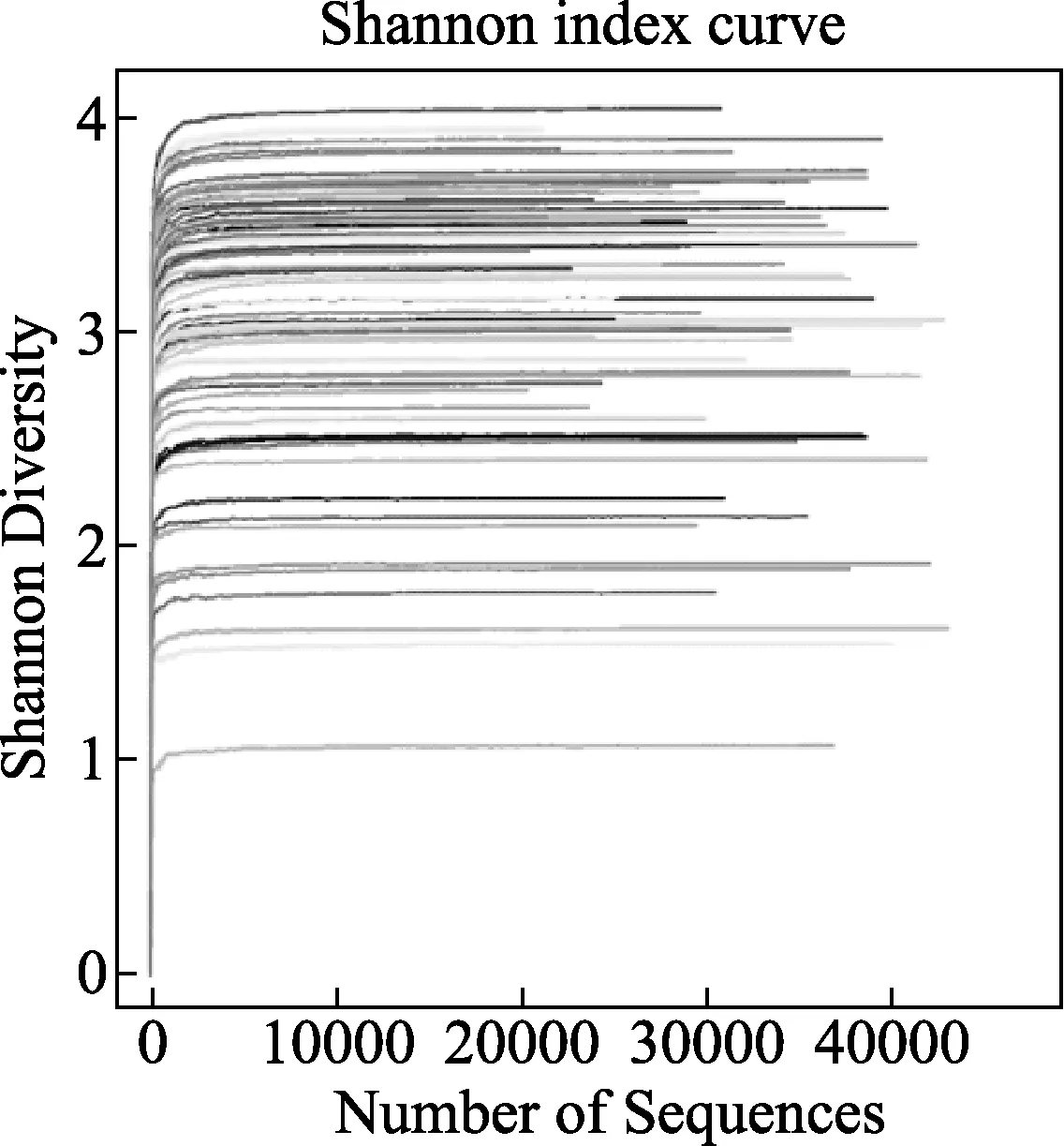
图2 各样本shannon指数曲线图
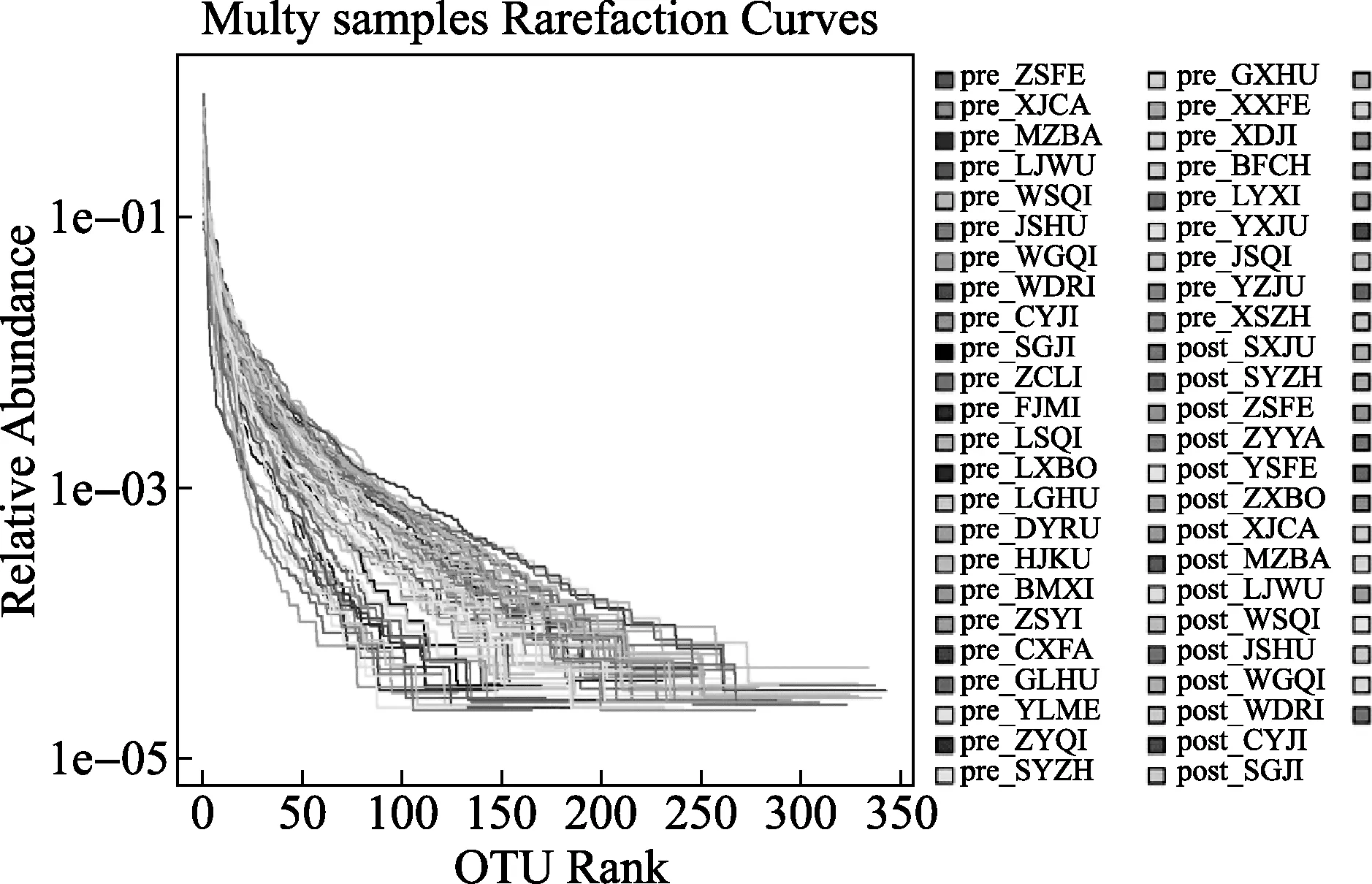
图3 各样本Runk-Abundance曲线图
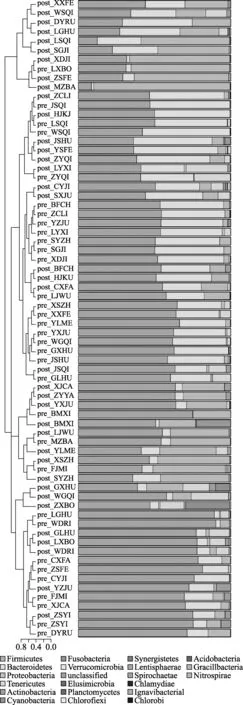
图4 各样本门水平聚类树与柱状图
2.3 肠道菌群测序结果 收集所有受试者粪便后,提取DNA样本以及OUT生成均由测序公司完成,共得到有效样本70例,pre-代表干预前样本,post-代表干预后样本。①Alpha多样性分析:利用统计学软件获得chao指数代表菌群丰度,shannon指数代表菌群多样性,各样本OUTs稀释曲线如图1所示,shannon稀释曲线如图2所示,不同颜色曲线代表不同样本,随测序量增加,各样本稀释曲线趋于平缓,说明样本测试深度足够,样本物种丰富,测序量足够大,能够反映样本中的微生物信息。各样本Runk-Abundance曲线如图3所示,随样本菌群数量增加,各样本菌种丰度减少,当菌种丰度低于1E-04时,曲线接近平台期,大多数样本菌属在100~200之间。②菌群结构及聚类分析:图4所示所有样本在门水平的菌群结构,其中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)在各样本中所占比例较高,为优势菌群;共22例样本中软壁菌门(Tenericutes)比例较高,其中Pre-组8例,占24.2%,Post-组14例,占37.8%;共32例样本防线菌门(Actinobacteria)比例较高,Pre-组4例,占12.1%,Post-组28例,占75.7%;5例样本蓝藻菌门(Cyanobacteria)比例略高,Pre-组2例和Post-组3例,说明干预后各样本菌群比例发生了改变,干预后放线菌门和软壁菌门丰度增加。聚类分析显示pre-组代表基线状态和post-组代表终点状态,总体表现为pre-组和post-组首先在同组样本中聚类,图3所示门水平相似性分析树状图中最上方9例post-组样本聚类在一起,下方接着有7例和8例pre-组样本聚类后合并,说明同组样本的肠道菌群具有较高的相似性。整体树状图中会有pre-组和post-组交叉聚类的地方,这与糖尿病患者肠道菌群的复杂性和混杂因素较多有关。③属水平分析显示,与基线时比较终点时受试者肠道益生菌数量增多者和条件致病菌数量减少的例数均增加,益生菌中防线菌门分支下的双歧杆菌属(Bifidobacterium)数量增多者占62.2%、厚壁菌门分支下的乳杆菌属(Lactobacillus)-嗜酸乳杆菌(L.Lactobacillus)数量增多者占21.6%;条件致病菌中埃希菌属(Escherichia)的大肠埃希菌(Escherichia coli)数量减少者占29.7%,肠球菌属(Enterococcus)数量减少者占43.2%。进一步提示益生菌能够提高部分糖尿病患者肠道菌群中有益细菌比例,同时减少有害菌比例。
3.讨论
肠道共生菌及其代谢产物通过影响宿主的代谢和免疫系统参与代谢异常和疾病的发生。研究发现糖代谢异常患者伴有肠道菌群失衡,一方面革兰氏阴性细菌增多,产生脂多糖(LPS)水平增加,LPS进入人体被免疫细胞识别后产生多种炎症因子,诱导全身慢性炎症的发生发展[3,4];另一方面产丁酸盐的细菌减少,其增加胰岛素敏感性、减轻炎症反应、保护肠道黏膜的屏障作用也随之减弱,进而诱发糖尿病的发生发展[5]。宏基因组(Metagenome)技术是指不经过微生物培养阶段,直接提取环境中总DNA对微生物基因总和进行研究的技术。本研究采用16SrRNA高通道测序技术是宏基因组技术中的主要方法,细菌16SrRNA基因可变区具有菌种特异性,分析可变区序列即可得到各细菌的分类学特征,相比于传统PCR方法更为准确和特异。本研究对2型糖尿病患者给予口服益生菌联合干预24周后,对基线和干预后的肠道细菌通过高通道测序进行分类鉴定和精确定量,结果显示所有受试者各样本测试深度足够,样本物种丰富,能够反映样本中的微生物信息。本研究中2型糖尿病受试者肠道中厚壁菌门、拟杆菌门和变形菌门为优势菌群,干预24周后软壁菌门、防线菌门、蓝藻菌门在干预后样本中增加的例数明显增加,说明干预后各样本菌群结构比例发生了改变。研究显示1型糖尿病患者中放线菌门/厚壁菌门、厚壁菌门/拟杆菌门的比例降低,有益菌群产生丁酸盐的细菌含量减少[6],本研究测序结果与之类似,干预后部分样本中软壁菌门、防线菌门、蓝藻菌门比例显著增加,且厚壁菌门中的益生菌乳杆菌属增加。聚类分析时post-组样本和pre-组样本多数能够同组间聚类,说明本研究中服用益生菌改变了2型糖尿病患者肠道菌群各细菌种类的比例,并且菌群变化有相似之处。
对比基线和终点状态受试者的糖脂代谢指标发现,干预后受试者空腹血糖显著改善,血脂达标率提高,HOMR-IR指数降低,胰岛素抵抗得到改善。终点时受试者肠道益生菌数量增多和条件致病菌数量减少的例数均增加,益生菌中防线菌门分支下的双歧杆菌属(Bifidobacterium)数量增多者占62.2%、厚壁菌门分支下的乳杆菌属(Lactobacillus)-嗜酸乳杆菌(L.Lactobacillus)数量增多者占21.6%,结合本研究方案考虑与益生菌干预有关。长乐胶囊中含两歧双歧杆菌、嗜酸乳杆菌、嗜热链球菌三种益生菌,无降血糖成分;洚糖奇冲剂无直接降低血糖的成分,是通过餐前服用增加饱腹感,减少其他食物的摄入,能很好地控制患者的饮食变异,其中的碳水化合物起到类似益生元的作用,有利于益生菌的吸收和肠道内繁殖。本研究中采取增加益生菌摄入的联合干预,能够有效补充肠道益生菌/益生元,调节脂肪酸的代谢,从而调节2型糖尿病患者的肠道菌群,进而改善终点时的空腹血糖。动物研究显示对高脂喂养的大鼠提前喂饲益生菌,对大鼠2型糖尿病的形成和发展具有一定的预防作用,其降糖作用与改善肠道菌群结构,抑制有害菌繁殖,降低炎性因子TNF-a、IL-6等的表达有关[7]。Amar等发现动物双歧杆菌乳酸菌能够改变高脂饮食诱导的糖尿病小鼠早期的细菌易位,从而降低组织中细胞因子TNF-α、IL-1b、PAI-1和IL-6的表达,改善胰岛素敏感性和葡萄糖代谢[8]。因此现在有很多学者认为益生菌作为一类调节宿主肠道微生态平衡的活性微生物,可通过改变肠道菌群及其代谢产物进而改善机体能量代谢、减轻慢性炎症和氧化应激反应。益生菌的应用已逐渐成为预防和控制2型糖尿病发生发展的研究热点[9]。
本研究通过增加益生菌摄入,患者肝肾功能未见明显异常,受试者无明显不适,安全性较好。虽然研究结果显示干预后肠道菌群发生变化,糖代谢、胰岛素抵抗和脂代谢得到改善,但是由于干预前分组不够严格以及混杂因素较多,不能很好进行相关分析和归因分析,在后续研究中应当进一步严格分组和增加样本量,同时测定炎症指标和氧化应激指标进行相关分析和归因分析。综上,肠道益生菌的摄入能够调节2型糖尿病患者的肠道菌群,促进空腹血糖达标和改善胰岛素抵抗,有利于脂代谢达标。

