沉默热休克蛋白5可增敏青蒿琥酯诱导肝癌细胞铁死亡
王康,张正阳,宋廉,龚爱华,王冬青,朱海涛
(1.江苏大学医学院,江苏镇江212013;2.江苏大学附属医院影像科,江苏镇江212001)
肝癌全球死亡率居肿瘤性疾病第2位,现有的治疗方案包括手术和非手术疗法,效果有限[1]。铁死亡是近年来发现的一种非凋亡、非坏死性细胞死亡方式,其所依赖的杀死肿瘤细胞的信号通路与经典的凋亡、坏死途径完全不同[2-3]。因此,有望用诱导铁死亡的手段来杀死一些耐凋亡、坏死的肿瘤细胞,比如肝癌细胞。青蒿琥酯是青蒿素衍生物的一种,可以通过诱导细胞内活性氧的过量聚集来杀死多种肿瘤细胞[4-5]。研究表明[6-8],青蒿素及其衍生物引起的细胞死亡为非凋亡非坏死性模式;同时有研究表明,青蒿琥酯可以引起胰腺癌细胞的铁死亡[9],但其能否在其他组织来源的肿瘤细胞如肝癌细胞中引起铁死亡目前仍不清楚。热休克蛋白5(heat shock protein family A member 5,HSPA5)是内质网应激相关的一个关键蛋白,同时也是一种分子伴侣,当细胞受到各种有害刺激时,可以保护细胞避免死亡[10]。HSPA5表达与肝癌对铁死亡的诱导剂Erastin、柳氮磺嘧啶的耐药性相关[6,11],但 HSPA5是否与癌症细胞对青蒿琥酯耐药性相关仍不明确。本研究拟探讨青蒿琥酯能否引起肝癌细胞的铁死亡及HSPA5对青蒿琥酯诱导下的肝癌化疗敏感性的影响。
1 材料与方法
1.1 材料
SMMC-7721人肝癌细胞株(中国科学院上海细胞研究所);青蒿琥酯、铁死亡抑制剂ferrostatin-1、凋亡抑制剂 ZVAD-FMK、坏死抑制剂 necrosulfonamide(美国MedChemExpress公司);兔抗人多克隆抗体HSPA5,小鼠抗人多克隆抗体GAPDH,丙二醛检测试剂盒均为美国Abcam公司产品;6孔板、96孔板(美国Corning公司);CCK-8试剂盒(北京智杰方远科技有限公司);蛋白质印迹法全自动凝胶成像仪(中国Sage Creation公司);FACS Calibur流式细胞仪(美国BectonDickin-son公司);HSPA5过表达和干扰慢病毒套装(苏州复百澳生物科技有限公司,病毒滴度约为1×109IU/mL,载体为FV055);C11-BODIPY荧光染料(美国Thermo公司)。进行以下分组:对照组、青蒿琥酯组、青蒿琥酯+ferrostatin-1组、青蒿琥酯+ZVAD-FMK组、青蒿琥酯+necrosulfonamide组,分别与二甲基亚砜、20μmol/L青蒿琥酯、20μmol/L青蒿琥酯+1μmol/L ferrostatin-1、20μmol/L青蒿琥酯+1μmol/L ZVAD-FMK、20 μmol/L青蒿琥酯+0.5μmol/L necrosulfonamide共培养24 h。
1.2 方法
1.2.1 细胞培养 SMMC-7721细胞用DMEM高糖培养基(含10%胎牛血清、100 U/L青霉素、100 mg/L链霉素),于37℃、5%CO2及饱和湿度的细胞培养箱培养。
1.2.2 CCK-8法检测细胞增殖率
1.2.2.1 选取青蒿琥酯最佳浓度 取对数生长期SMMC-7721细胞,接种于96孔板,每孔4 000个细胞,设3个复孔;次日细胞贴壁后,每孔加入100μL反应溶液(90μL无血清培养基+10μL CCK-8试剂),同时设立空白组(只含DMEM)进行校正,置于37℃、5%CO2恒温恒湿培养箱培养2 h;用酶标仪测定450 nm波长处各孔光密度(D)值。
1.2.2.2 检测不同细胞死亡方式抑制剂对青蒿琥酯杀伤SMMC-7721细胞的影响 取对数生长期SMMC-7721细胞,接种于96孔板,每孔4 000个细胞,设3个复孔;次日细胞贴壁后,进行以下分组:对照组、青蒿琥酯组、青蒿琥酯+ferrostatin-1组、青蒿琥酯+ZVAD-FMK组、青蒿琥酯+necrosulfonamide组,分别与二甲基亚砜、20μmol/L青蒿琥酯、20μmol/L青蒿琥酯+1μmol/L ferrostatin-1、20 μmol/L青蒿琥酯+1μmol/L ZVAD-FMK、20μmol/L青蒿琥酯+0.5μmol/L necrosulfonamide共培养24 h;CCK-8法测各组细胞活性(具体实验操作方法同“1.2.2.1”)。
1.2.3 细胞分组及相应指标检测
1.2.3.1 细胞分组 取对数期SMMC-7721细胞,加入胰酶置于37℃、5%CO2培养箱中消化5 min;用含血清培养液重悬制成细胞悬液,接种入2块6孔板,每孔培养基补足至2 mL,于37℃、5%CO2培养箱中培养24 h;观察细胞状态良好,将细胞分为二甲基亚砜组、青蒿琥酯组、青蒿琥酯+去铁胺组,分别用二甲基亚砜、20μmol/L青蒿琥酯、20μmol/L青蒿琥酯+100 mmol/L去铁胺处理24 h。
1.2.3.2 脂质来源活性氧水平检测 弃培养基,PBS冲洗2遍;每孔加入0.5 mL 0.25%胰酶(不含EDTA)消化,显微镜下观察到细胞变圆时加入完全培养基终止消化,并轻轻吹打均匀;将细胞悬液以1 200 r/min,4℃离心5 min;弃上清液,用无血清培养基重悬。每1 mL细胞悬液中加入10 mmol/L C11-BODIPY(581/591)储存液,使其终浓度为10μmol/L,轻轻吹打均匀后放入37℃、5%CO2的培养箱中避光孵育30 min;每隔5 min轻轻摇晃,以使细胞与C11-BODIPY(581/591)充分混匀;用无血清培养基洗涤细胞3次,以去除背景干扰。收集各组细胞悬液至流式管,室温避光孵育5 min以去除死细胞干扰。流式细胞仪检测(激发波长581 nm、发射波长591 nm)各组细胞的平均荧光强度。
1.2.3.3 丙二醛含量检测 弃旧培养基,用PBS冲洗2遍;每孔加入100μL细胞裂解液,充分裂解细胞;将裂解后的样品转移至EP管,1 200 r/min,4℃离心5 min;取上清液,用BCA法测定蛋白浓度;按照产品说明书推荐比例配置丙二醛检测工作液。将0.1mL样品和0.2mL检测工作液旋涡混匀器混匀;100℃加热60min,冷却至室温;4℃1 200 r/min离心15 min,冷却至室温;取200μL上清液于96孔板中测定535 nm处各孔光密度值。按照以下公式计算细胞中丙二醛含量:丙二醛浓度(μmol/mg)=(D测定-D空白)/(D标准-D空白)×10/蛋白质质量浓度(mg/mL)。
1.2.4 HSPA5低表达和过表达细胞株的构建及转染效率验证 取对数期SMMC-7721细胞均匀接种至6孔板,每孔约5×105,接种3孔;用10%含血清DMEM于恒温培养箱培养24 h;待细胞融合率达到70%左右时,分为3组:对照组、HSPA5-shRNA组、Flag-HSPA5组,分别每孔加入50μL空载(Vector)、HSPA5-shRNA、Flag-HSPA5病毒液;混匀后在恒温培养箱中继续培养6 h;更换为10%含血清的常规培养基继续培养48 h。
1.2.4.1 qRT-PCR检测HSPA5 mRNA表达水平
弃培养基,用PBS洗2遍;用Trizol法提取总RNA,反转录为cDNA;以cDNA为模板、GAPDH为内参,定量检测扩增HSPA5的mRNA水平。qRT-PCR反应体系:SYBRGreen 5μL、双蒸水4μL、上下游引物各0.25μL、cDNA 0.5μL,总反应体系为10μL。按如下条件进行反应:95℃预变性3 min;95℃变性10 s;60℃退火 30 s,40个循环。采用 2-△△CT表示目的mRNA的表达水平。HSPA5引物序列:上游5′-CTGTCCAGGCTGGTGTGCTCT-3′;下游5′-CTTGGTAGGCACCACTGTGTTC-3′。
1.2.4.2 蛋白质印迹法检测HSPA5蛋白的表达
收集各组细胞,抽提总蛋白,裂解细胞时加入2×蛋白上样缓冲液,100℃ 煮沸5 min;12 000 r/min,4℃离心10 min;取上清液,100 V行10%SDSPAGE分离蛋白;用半干电转化法300 mA转至PVDF膜(需提前在甲醇中浸泡3 min),转膜2 h;5%BSA室温封闭1 h;加入兔抗HSPA5抗体,小鼠抗GAPDH抗体(内参,稀释比为1∶1 000,TBST为抗体稀释液),4℃孵育过夜;次日用1×TBST洗涤3次,每次10 min;分别加入相应的兔、鼠二抗(稀释比为1∶5 000)室温孵育1 h;TBST洗膜3次,每次10 min;ECL发光试剂显影。采用Image J软件处图像。
1.2.5 细胞转染分组及相关指标检测
1.2.5.1 细胞分组及转染 取对数生长期空载、过表达及干扰HSPA5的SMMC-7721细胞,加入胰酶置于37℃、5%CO2培养箱中消化5 min;用含血清培养液重悬制成细胞悬液,分别接种于96孔板(用于CCK-8检测)或6孔板(用于丙二醛含量检测),每孔4 000个细胞,设3个复孔,每种细胞共种6个孔;次日细胞贴壁后,进行以下分组:二甲基亚砜+空载质粒组、二甲基亚砜+HSPA5-shRNA干扰质粒组、二甲基亚砜+Flag-HSPA5过表达质粒组、青蒿琥酯+空载质粒组、青蒿琥酯+HSPA5-shRNA干扰质粒组、青蒿琥酯+Flag-HSAPA5过表达质粒组;其中,二甲基亚砜+空载质粒组、二甲基亚砜+HSPA5-shRNA干扰质粒组、二甲基亚砜+Flag-HSPA5过表达质粒组与二甲基亚砜共培养24 h,青蒿琥酯+空载质粒组、青蒿琥酯共培养24 h。
1.2.5.2 CCK-8法检测细胞活性 具体实验操作方法同“1.2.2.1”。
1.2.5.3 丙二醛含量检测 具体实验操作方法同“1.2.3.2”。
1.3 统计学分析
采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间均数比较行单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 青蒿琥酯最佳作用条件
与0μmol/L相比,20、40μmol/L青蒿琥酯处理组细胞存活率明显降低(t=6.587,16.400,P均<0.05);其中20μmol/L青蒿琥酯处理SMMC-7721细胞时,药物浓度达到半数致死量。故选20μmol/L青蒿琥酯作为最佳实验浓度用于后续实验。见图1。
2.2 青蒿琥酯促进肝癌细胞铁死亡
由图2可见,青蒿琥酯组细胞活性明显低于对照组(t=5.743,P<0.05),青蒿琥酯+ferrostatin-1组细胞活性明显高于青蒿琥酯组(t=2.857,P<0.05),青蒿琥酯+ZVAD-FMK组和青蒿琥酯+necrosulfonamide组细胞活性与青蒿琥酯组比较,差异均无统计学意义(P>0.05)。由此说明,铁死亡抑制剂可抑制青蒿琥酯的细胞毒作用,而凋亡或坏死抑制剂对青蒿琥酯的细胞毒作用抑制不明显。

图2 CCK-8法检测各组细胞存活率
2.3 青蒿琥酯促进肝癌细胞脂质过氧化反应
与对照组相比,青蒿琥酯处理的SMMC-7721细胞脂质来源活性氧水平和丙二醛水平明显增高(t=7.247,3.236,P均<0.05)。与青蒿琥酯组相比,青蒿琥酯+去铁胺组细胞内脂质来源活性氧和丙二醛水平明显降低(t=4.900,3.472,P均<0.05)。见图3~4。由此表明,青蒿琥酯引起肝癌SMMC-7721细胞内脂质过氧化。同时,这种过氧化可被铁离子螯合剂去铁胺所抑制。
2.4 病毒感染SMMC-7721细胞后HSPA5 mRNA和蛋白的表达
与Vector组相比,HSPA5-shRNA组HSPA5 mRNA和蛋白表达水平明显降低(t分别为12.480,8.141,P均<0.05),而 Flag-HSPA5组 HSPA5 mRNA和蛋白表达明显增加(t分别为18.280,8.632,P均<0.05)。见图5~6。由此表明,SMMC-7721细胞中HSPA5质粒干扰及过表达效率较高。

图3 各组细胞内脂质来源活性氧水平比较

图4 各组细胞内丙二醛水平比较

图5 qRT-PCR法检测HSPA5 mRNA的表达

图6 蛋白质印迹法检测感染病毒后HSPA5蛋白的表达
2.5 干扰HSPA5促进青蒿琥酯杀伤效力
由图7可见,青蒿琥酯组细胞活性明显低于对照组(t=17.09,P<0.05),青蒿琥酯+HSPA5-shRNA组细胞活性明显低于青蒿琥酯组(t=2.841,P<0.05),而青蒿琥酯+Flag-HSPA5组细胞活性明显高于青蒿琥酯组(t=8.491,P<0.05)。青蒿琥酯组细胞丙二醛水平明显高于对照组(t=2.796,P<0.05),青蒿琥酯+HSPA5-shRNA组细胞丙二醛水平明显高于青蒿琥酯组(t=6.720,P<0.05),而青蒿琥酯+Flag-HSPA5组细胞丙二醛水平明显低于青蒿琥酯组(t=14.23,P<0.05)。见图8。
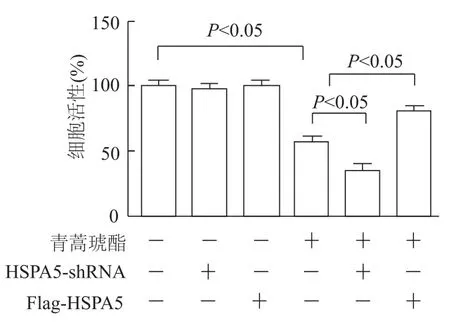
图7 CCK-8法检测各组细胞活性

图8 细胞内丙二醛水平
3 讨论
本研究发现,在人肝癌SMMC-7721细胞中,铁死亡特异性抑制剂ferrostatin-1可消除青蒿琥酯对肝癌细胞的杀伤作用,而凋亡抑制剂ZVAD-FMK或坏死抑制剂necrosulfonamide则起不到显著的杀伤抑制作用;此外在青蒿琥酯的作用下,细胞内的脂质过氧化水平增高,而铁离子螯合剂去铁胺可以消除青蒿琥酯所导致的细胞内脂质过氧化,其机制可能与细胞内的铁离子过载相关。有研究表明,青蒿琥酯可以在人胰腺癌细胞和人正常肝细胞中引起铁死亡[5,12]。这与我们对青蒿琥酯可以诱导肝癌细胞发生铁死亡的猜想相一致。但同时也有研究显示,青蒿琥酯可以引起乳腺癌细胞发生凋亡[13]。这可能是由于不同组织来源的细胞对铁死亡或者凋亡的敏感性不同所导致。
同凋亡坏死一样,在青蒿琥酯诱导的铁死亡中一些基因如HSPA5,可导致肿瘤细胞对青蒿琥酯产生耐药性[14]。HSPA5表达与肝癌对铁死亡诱导剂Erastin、柳氮磺嘧啶的耐药性相关[6,11],但 HSPA5是否与癌症细胞对青蒿琥酯耐药性相关仍不明确。本研究用干扰质粒HSPA5-shRNA抑制HSPA5表达后,肝癌细胞对青蒿琥酯的化疗抵抗能力明显下降;在同样浓度的青蒿琥酯处理下,干扰 HSPA5的SMMC-7721细胞活性明显低于未干扰组,而脂质过氧化水平则高于未干扰组;由此表明,通过抑制肿瘤细胞中HSPA5蛋白表达可能增强青蒿琥酯化疗效果,但HSPA5具体通过何种信号通路和机制来影响青蒿琥酯所调控的铁死亡还需要进一步的研究证实。
本研究中,青蒿琥酯可有效地杀伤肝癌细胞,但只有在较大剂量(40μmol/L)时才能发挥较强的肿瘤杀伤作用。青蒿琥酯作为一种中药提取物,如何把青蒿琥酯控制在安全剂量内,同时又能有效地抑制肿瘤细胞的生长,还有待于后续研究进一步探索。本实验室正在积极尝试各种药物同青蒿琥酯的组合以寻找在较低的用药剂量下即可达到有效抑制肿瘤生长的目的。
综上所述,通过感染HSPA5-shRNA病毒可以增强肝癌细胞对青蒿琥酯的化疗敏感度,其机制可能与铁死亡引起的细胞内脂质成分过氧化相关。

