雌激素受体拮抗剂对泌乳素腺瘤GH3细胞增殖的影响
朱正凯 林少华 李亮明
【摘要】 目的:探讨雌激素受体拮抗剂对泌乳素腺瘤细胞增殖的影响。方法:在同样去激素培养的条件下添加不同浓度雌激素和雌激素受体拮抗剂,应用MTT法检测其对GH3细胞增殖的影响。结果:不同浓度的OHTam对GH3细胞有明显的抑制作用,并且与剂量呈正相关,10-11 mol/L即有抑制作用,10-6 mol/L抑制作用达到最大。E2可显著的刺激GH3细胞增殖,10-12 mol/L即有促进增殖作用,10-9 mol/L作用达到最大,而后随着浓度的升高增殖作用反而逐渐减弱。结论:雌激素受体拮抗剂能显著抑制泌乳素腺瘤细胞的生长,理论上可以用于泌乳素腺瘤的药物治疗。
【关键词】 泌乳素腺瘤; 雌激素; 雌激素受体拮抗剂; GH3细胞
【Abstract】 Objective:To investigate the effect of estrogen receptor antagonists on the in vitro growth of human prolactinomas.Method:Estradiol and estrogen receptor antagonists were added respectively at different concentrations into the culture medium MTT assays were used to detect the effects on the growth and proliferation of GH3 cells.Result:OHTam could inhibit GH3 cell proliferation as dose-dependent manner,when the concentration was 10-11 mol/L,the GH3 cell proliferation was inhibit.If the concentration rises to 10-6 mol/L,it would produce the greatest effect.E2 had significant stimulatory effect on growth of GH3 cells,and the effect worked even at low concentration of 10-12 mol/L.The greatest effect would produce when the concentration was 10-9 mol/L,if the concentration still increases,the proliferation effect would gradually weaken.Conclusion:Estrogen receptor antagonists can inhibit GH3 cell proliferation.In theory,it can be used for the drug treatment of prolactinomas.
【Key words】 Prolactinomas; Estradiol; Estrogen receptor antagonists; GH3 cells
First-authors address:Zhongshan Peoples Hospital,Zhongshan 528400,China
doi:10.3969/j.issn.1674-4985.2019.10.007
泌乳素(Prolactin,PRL)腺瘤是垂体腺瘤中最常见的类型,占所有垂体腺瘤中的40%~60%,其临床表现主要有泌乳、闭经、不孕、头痛、视力障碍、垂体功能低下等。在多巴胺受体激动剂出现之前,临床上治疗方法主要为手术治疗及放射治疗。随着以溴隐亭为代表的多巴胺受体激动剂的发现,多巴胺受体激动剂现已成為泌乳素腺瘤的首选治疗方案。但目前临床上仍有5%~18%泌乳素腺瘤患者对多巴胺受体激动剂耐药,主要发生在大腺瘤当中。临床上将这类肿瘤称为耐多巴胺受体激动剂性泌乳素腺瘤(Dopamine agonist-resistant prolactinomas,DARPs)。目前对于泌乳素腺瘤耐药性的具体机制研究较多,但仍不是十分明确。临床上发现服用大剂量的雌激素可以增加泌乳素腺瘤的发病率,在雌激素治疗过程中泌乳素微腺瘤可发展为大腺瘤。因而雌激素在泌乳素腺瘤发展过程中可能起到了重要作用。也有学者认为给予雌激素受体拮抗剂可以增加DARPs对多巴胺受体激动剂的敏感性,从而提高药物治疗的有效性。目前研究已发现,PRL腺瘤细胞表面存在雌激素受体(estrogen receptor,ER),其与肿瘤细胞的增殖和生物学特性有着密切的关系。本实验将通过在同样培养条件下,了解不同浓度雌激素、雌激素受体拮抗剂对大鼠GH3 垂体腺瘤细胞增殖的影响,现报道如下。
1 材料与方法
1 材料
1.1 实验药物和瘤细胞系 本实验采用的雌激素为雌二醇(estradiol,E2),雌激素受体拮抗剂为4-羟基他莫昔芬(4-hydroxytamoxifen,OHTam),药物的浓度梯度为10-6、10-7、10-8、10-9、10-10、10-11、10-12 mol/L,药物使用无水乙醇溶解,乙醇终浓度小于0.1%。实验采用的PRL腺瘤细胞为GH3大鼠垂体腺瘤细胞株。
1.2 去激素小牛血清的制备 在新生小牛血清中加入人葡聚糖(0.25 g/L),完全溶解后加入活性炭(2.5 g/L),于55 ℃水浴中作用45 min,离心10 min,取其上清液。上述步骤连续处理2次以彻底去除血清中的雌激素。处理好的血清使用金属滤器(0.45、0.22 μm两层滤膜)过滤除菌,然后置入-20 ℃保存。
1.2 方法
1.2.1 细胞培养 采用GH3大鼠垂体腺瘤细胞株,Hams培养基(2 mmol/L谷氨酰胺,100 U/mL青霉素,100 μg/ml链霉素,160 U/L胰岛素),热灭活的10%马血清,2.5%胎牛血清。细胞常规在37 ℃、5%CO2、100%湿度的孵箱中培养。在倒置显微镜下取处于对数生长期、形体良好的细胞进行实验。用多聚赖氨酸包被细胞培养瓶,待GH3细胞贴壁生长,融合度达85%~90%时,去除原培养基,加入适量的PBS(对于100 mm平皿,加入2 mL PBS)漂洗细胞两次。加入1 mL 0.05%胰蛋白酶消化液,37 ℃消化数分钟直至镜下观察细胞变圆且透亮,直接加入2 mL完全培养基终止消化并将细胞从平皿底部轻轻吹下,全部转移至干净的50 mL离心管中,800 r/min离心5 min。弃去上清,加入1 mL完全培养基轻轻吹打直至细胞完全分散。根据实验需要,将适量细胞加入已经加入完全培养基细胞培养皿中。
1.2.2 MTT法检测OHTam和E2对GH3细胞增殖的影响 GH3细胞培养贴壁24 h后,用0.25%胰蛋白酶消化细胞,充分打匀,以5×104 cells/well的浓度接种于6孔板中,细胞贴壁后换液一次,以后分为三组,分别为:(1)对照组为无血清培养液;(2)E2组分别加入浓度为10-7、10-8、10-9、10-10、10-11、10-12 mol/L的E2;(3)OHTam组分别加入浓度为10-6、10-7、10-8、10-9、10-10、10-11 mol/L的OHTam。将打匀好的细胞以1×105 cells/well的浓度接种于96孔板中,细胞贴壁后更换新培养液,加入各组实验用药,培养箱孵育48 h后,各孔加入5 mg/mL MTT 20μL,继续孵育4 h,弃去培养液,每孔加入二甲基亚砜(DMSO)150 μL溶解甲躜(MTT还原产物),再置于酶联免疫检测仪中,以570 nm波长测定吸光度,校正波长为630 nm,计算其生长抑制率和增殖指数。计算公式为:生长抑制率=(对照组吸光度一用药组吸光度)/对照组吸光度;增殖指数=用药组吸光度/对照组吸光度。
1.2.3 ELISA法检测OHTam和E2对GH3细胞PRL分泌的影响 GH3细胞培养贴壁24 h后,换无血清的Hams培养基,培养48 h后分为三组,分别为:(1)对照组为无血清培养液;(2)E2组分别加入浓度为10-7、10-8、10-9、10-10、10-11、10-12 mol/L的E2;(3)OHTam组,分别加入浓度为10-6、10-7、10-8、10-9、10-10、10-11 mol/L的OHTam。加药后在37 ℃、5% CO2继续孵育72 h后收集上清,-20 ℃保存。用大鼠PRL ELISA试剂盒检测收集的上清中的PRL。先加入50 μL标准品、血清标本于相应反应板孔中。每孔加入100 μL酶联物,轻轻混匀30 s,室温60 min。洗板后,每孔加入100 μL显色液,轻轻混匀10 s,室温20 min。每孔加入50 μL终止液。轻轻混匀30 s,30 min内在450 nm处读吸光度值(A450值)。以A450值为纵坐标,以标准品浓度为横坐标,绘制标准曲线。根据血清样品的OD值可在标准曲线上查出其浓度。以对照组PRL基础分泌量为100%,各组测得的激素相对值=实验组A值/对照组A值×100%。
2 结果
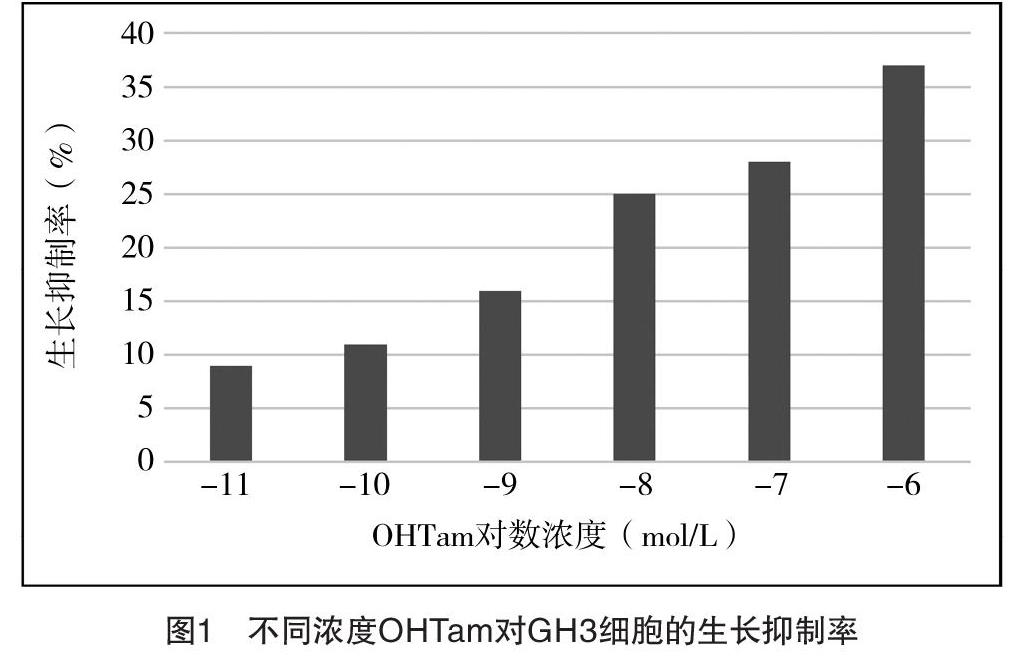
2.1 MTT法检测OHTam和E2对GH3细胞增殖的影响 (1)不同浓度的OHTam对GH3细胞有明显的抑制作用,10-11 mol/L即有抑制作用,10-6 mol/L抑制作用达到最大,具体结果为:10-6 mol/L OHTam对应的生长抑制率为37%,10-7 mol/L OHTam对应的生长抑制率为28%,10-8 mol/L OHTam对应的生长抑制率为25%,10-9 mol/L OHTam对应的生长抑制率为16%,10-10 mol/L OHTam对应的生长抑制率为11%,10-11 mol/L OHTam对应的生长抑制率为9%。从图1中可以看出OHTam对GH3细胞有明显的抑制作用,并且与剂量呈正相关。(2)E2可显著的刺激GH3细胞增殖,10-12 mol/L即有促进增殖作用,10-9 mol/L作用达到最大,而后随浓度的升高增殖作用反而逐渐减弱,具体结果为:10-7 mol/L E2对应的增殖指数为2.1,10-8 mol/L E2对应的增殖指数为2.9,10-9 mol/L E2对应的增殖指数为4.8,10-10 mol/L E2对应的增殖指数为3.9,10-11 mol/L E2对应的增殖指数为3.1,10-12 mol/L E2对应的增殖指数为2.6。
2.2 ELISA法检测OHTam和E2对GH3细胞PRL分泌的影响 (1)不同浓度OHTam对GH3细胞PRL分泌有明显抑制作用,10-11 mol/L即可抑制GH3细胞PRL的分泌,10-6 mol/L抑制作用达到最大,具体结果为:10-6 mol/L OHTam对应的PRL激素相对值为42%,10-7 mol/L OHTam对应的PRL激素相對值为48%,10-8 mol/L OHTam对应的PRL激素相对值为53%,10-9 mol/L OHTam对应的PRL激素相对值为61%,10-10 mol/L OHTam对应的PRL激素相对值为68%,10-11 mol/L OHTam对应的PRL激素相对值为75%;(2)E2可刺激GH3细胞PRL的分泌,10-12 mol/L即可刺激GH3细胞PRL的分泌,10-7 mol/L刺激作用达到最大,具体结果为:10-7 mol/L OHTam对应的PRL激素相对值为254%,10-8 mol/L OHTam对应的PRL激素相对值为218%,10-9 mol/L OHTam对应的PRL激素相对值为185%,10-10 mol/L OHTam对应的PRL激素相对值为165%,10-11 mol/L OHTam对应的PRL激素相对值为148%,10-12 mol/L OHTam对应的PRL激素相对值为137%。
3 讨论
GH3细胞系是由Tashjian AH等在1965年从一只7月龄的雌性Wistar-Furth大鼠的垂体肿瘤中分离建立的。GH3细胞系不是直接来源于GH1细胞系的克隆,而是从原代培养的GH1细胞在大鼠身上传代两次形成的肿瘤中建立的。上皮样的GH3细胞可分泌生长激素和泌乳素,目前广泛应用于对PRL腺瘤的研究。
Spady等[1]通过研究发现,雌激素能够在转录和翻译水平调控PRL基因的表达,最终刺激PRL分泌。雌激素能够增加患泌乳素腺瘤的风险,有病例报道男性接受变性手术后大剂量服用雌激素可导致泌乳素腺瘤[2]。李丹等[3]在体外细胞水平研究发现雌激素可促进GH3细胞增殖和泌乳素的分泌,而雌激素受体拮抗剂则能抑制雌激素的作用。Heaney等[4]研究发现雌激素受体在所有泌乳素腺瘤中均有表达,但表达水平存在差异,侵袭性泌乳素腺瘤的表达水平明显低于平均水平。而国内有学者研究则认为ER在男性及侵袭性泌乳素腺瘤中的表达水平高于女性及非侵袭性泌乳素腺瘤[5]。
雌激素主要通过与ER结合形成复合物而发挥作用。ER主要有两种亚型,即ERα和ERβ。在PRL腺瘤细胞中,ERα和ERβ均有表达。Manoranjan等[6]研究发现PRL腺瘤的耐药病例中ERαmRNA表达高于敏感病例,而ERβmRNA则明显低于敏感病例。Maus等[7]研究认为雌激素是通过影响多巴胺D2受体(dopamine D2 receptor,D2R)与多巴胺的耦合来降低对腺苷酸环化酶的抑制作用,从而促进PRL腺瘤细胞的生长和PRL分泌。D2受体包括两种亚型:D2-LR和D2-SR,其中D2-LR的表达率最高,D2-SR虽然表达率不高,但其耦连腺苷酸环化酶的效率远高于D2-LR。Lamberts等[4]、Heaney等[8]通过研究则认为雌激素可影响D2-SR/D2-LR,增加D2-LR的表达,而D2-LR的亲和力远远低于D2-SR,从而降低PRL腺瘤对多巴胺的应答。Passos等[9]研究发现,ERβ的表达与NGFR的表达呈负线性关系。NFGB和NGFR则可通过激活NFkβ,调节D2R基因,促进PRL腺瘤细胞D2R的表达,从而使DARPS对多巴胺应答[9-10]。这也一定程度上印证了Lamberts和Heaney的观点。
但目前关于雌激素和雌激素受体拮抗剂对泌乳素腺瘤细胞的作用仍存在争议,未达成一致结论。本实验中笔者发现雌激素能显著促进GH3细胞的增殖,但增殖作用与E2的浓度密切相关,在10-9 mol/L作用达到最大,而后随着浓度的升高增殖作用反而逐渐减弱,原因可能与雌激素的负反馈有关,太高浓度的雌激素可能负反馈抑制肿瘤细胞表面ER的表达,从而减弱了雌激素的作用。而雌激素受体拮抗剂OHTam对GH3细胞有明显抑制作用,10-11 mol/L即有抑制作用,10-6 mol/L抑制作用达到最大,并且在一定濃度范围内抑制作用与OHTam浓度呈正相关。不同浓度OHTam对GH3细胞PRL分泌有明显抑制作用,10-11 mol/L即可抑制GH3细胞PRL的分泌,10-6 mol/L抑制作用达到最大,而E2则可刺激GH3细胞PRL的分泌,10-12 mol/L即可刺激GH3细胞PRL的分泌,10-7 mol/L刺激作用达到最大。目前在一些其他类型的肿瘤,如乳腺癌、子宫内膜癌等一些雌激素依赖性疾病当中,雌激素受体拮抗剂可以通过竞争性的与ER耦合,阻碍原癌基因的表达,抑制雌激素诱导的生长因子分泌的增加,从而抑制肿瘤的生长,通过应用雌激素受体拮抗剂取得了显著成效[11-14]。在PRL腺瘤当中,雌激素受体拮抗剂相关作用机制可能有:(1)雌激素通过与ER耦合,在转录水平增加PRL基因的表达,通过一些直接和间接的机制刺激PRL的分泌。雌激素受体拮抗剂则通过竞争性的与ER耦合,拮抗雌激素的作用,从而减少肿瘤细胞PRL的分泌[15]。(2)雌激素受体拮抗剂通过与ER结合,影响细胞表面D2R的表达及多巴胺与D2R的耦合,增加对腺苷酸环化酶的抑制作用,从而减少PRL腺瘤细胞的生长和PRL分泌[7]。无论是哪一种可能的机制,目前对其具体的作用过程都不是十分明确,有待进一步的研究。但雌激素和雌激素受体拮抗剂在PRL腺瘤的作用结果目前十分明确,即雌激素能够刺激PRL腺瘤细胞的增殖和PRL的分泌,而雌激素受体拮抗剂能抑制PRL腺瘤细胞的增殖和PRL的分泌[16-17]。
大量的研究都表明PRL腺瘤的发生、增殖都与ER有着密切的关系,雌激素受体拮抗剂可以有效地抑制PRL腺瘤细胞生长、减少PRL的分泌。对多巴胺受体激动剂敏感的泌乳素腺瘤细胞表面D2R的密度明显大于耐药的[18]。临床上发现对多巴胺受体激动剂耐药的泌乳素腺瘤患者在给予雌激素受体拮抗剂后可以变的敏感。雌激素受体拮抗剂改变PRL腺瘤细胞对多巴胺受体激动剂敏感性的途径可能是通过促进PRL腺瘤细胞表面D2R受体的表达,特别是D2-SR的表达,D2-SR/D2-LR比值上升,从而提高PRL腺瘤对多巴胺受体激动剂的敏感性[19- 20]。
Heaney等通过动物实验发现,皮下注射雌激素受体拮抗剂可降低88%泌乳素水平和减少41%肿瘤的生长[4]。雌激素受体mRNA表达与D2-SR mRNA表达存在在负相关性,而与D2-LR mRNA表达呈正相关性,这似乎也进一步验证了D2-LR/D2-SR比例的改变参与了耐药的发生。理论上通过给予雌激素受体拮抗剂降低肿瘤细胞表面雌激素受体的表达,可以增加DARPs对多巴胺受体激动剂的敏感性[21]。
参考文献
[1] Spady T J,Mccomb R D,Shull J D.Estrogen action in the regulation of cell proliferation,cell survival,and tumorigenesis in the rat anterior pituitary gland[J].Endocrine,1999,11(3):217-233.
[2] Gooren L J,Assies J,Asscheman H,et al.Estrogen-induced prolactinoma in a man[J].Journal of Clinical Endocrinology & Metabolism,1988,66(2):444.
[3]李丹,高华,龚磊,等.氟维司群对泌乳素瘤GH3细胞系增殖和分泌的影响[J].中国微侵袭神经外科杂志,2013,18(10):464-467.
[4] Heaney A P,Fernando M,Melmed S.Functional role of estrogen in pituitary tumor pathogenesis[J].Journal of Clinical Investigation,2002,109(2):277.
[5]李朝曦,淦超,雷琢瑋,等.垂体泌乳素腺瘤雌激素α受体与多巴胺2型受体L亚型表达及意义[J].中国微侵袭神经外科杂志,2015,20(12):529-531.
[6] Manoranjan B,Salehi FScheithauer B W,Rotondo F,et al.
Estrogen receptors alpha and beta immunohistochemical expression:clinicopathological correlations in pituitary adenomas[J].Anticancer Research,2010,30(7):2897.
[7] Maus M,Bertrand P,Drouva S,et al.Differential modulation of D1 and D2 dopamine-sensitive adenylate cyclases by 17 beta-estradiol in cultured striatal neurons and anterior pituitary cells[J].Journal of Neurochemistry,2010,52(2):410-418.
[8] Lamberts S W,Verleun T,Hofland L,et al.Differences in the interaction between dopamine and estradiol on prolactin release by cultured normal and tumorous human pituitary cells[J].J Clin Endocrinol Metab,1986,63(6):1342-1347.
[9] Passos V Q,Fortes M A H Z,Giannellaneto D,et al.Genes Differentially Expressed in Prolactinomas Responsive and Resistant to Dopamine Agonists[J].Neuroendocrinology,2009,89(2):163-170.
[10] Fiorentini C,Guerra N,Facchetti M,et al.Nerve Growth Factor Regulates Dopamine D2 Receptor Expression in Prolactinoma Cell Lines via p75NGFR-Mediated Activation of Nuclear Factor B[J].Endocrine Society,2002,16(2):353-366.
[11] Begam A J,Jubie S,Nanjan M J.Estrogen receptor agonists/antagonists in breast cancer therapy:A critical review[J].Bioorganic Chemistry,2017,71:257-274.
[12] Myung-Jin K,Sung-Il C,Kun-Ok L,et al.Effects of 17β-Estradiol and Estrogen Receptor Antagonists on the Proliferation of Gastric Cancer Cell Lines[J].Journal of Gastric Cancer,2013,13(3):172.
[13] Park J B.The effects of fulvestrant,an estrogen receptor antagonist,on the proliferation,differentiation and mineralization of osteoprecursor cells[J].Molecular Medicine Reports,2013,7(2):555.
[14] Liu J,Yuan D,Zhou Z,et al.Effect of estrogen receptor antagonist on proliferation of human endometrioid carcinoma Ishikawa cells and its possible mechanism[J].Tumor,2018.
[15] Actis A M,Cocca C M,Gutierrez A,et al.Estrogen receptor profiles:changes in mouse and rat mammary tumors by treatment with selective estrogen receptor modifiers[J].Medical Principles & Practice,2004,13(4):220-226.
[16] Faraoni E Y,Camilletti M A,Abeledo-Machado A,et al.
Sex differences in the development of prolactinoma in mice overexpressing hCGβ:role of TGFβ1[J].Journal of Endocrinology,2017,232(3):535-546.
[17] Hajder M,Hajder E,Dervisefendic M,et al.Prolactinomas in infertile women:clinical and endocrine characteristics before and after 24 months of treatment with bromocriptine[J].Medical Archives,2013,67(3):181-184.
[18] Filopanti M,Barbieri A M,Angioni A R,et al.Dopamine D2 receptor gene polymorphisms and response to cabergoline therapy in patients with prolactin-secreting pituitary adenomas[J].Pharmacogenomics Journal,2008,8(5):357-363.
[19] Wu Z B,Zheng W M,Su Z P,et al.Expression of D2RmRNA isoforms and ERmRNA isoforms in prolactinomas:correlation with the response to bromocriptine and with tumor biological behavior[J].J Neurooncol,2010,99(1):25-32.
[20] Shimazu S,Shimatsu A,Yamada S,et al.Resistance to dopamine agonists in prolactinoma is correlated with reduction of dopamine D2 receptor long isoform mRNA levels[J].European Journal of Endocrinology,2012,166(3):383-390.
[21] Cao L,Gao H,Gui S,et al.Effects of the estrogen receptor antagonist fulvestrant on F344 rat prolactinoma models[J].
J Neurooncol,2014,116(3):523-531.
(收稿日期:2018-09-28) (本文編辑:周亚杰)

