赤芝、紫芝和鹿角灵芝醇提物的活性成分及生物活性研究
陈建飞 周爱珠 程 萱 童文彬 刘玉柱 张海燕 胡玉梅 练明姿 周 晶 吕国英 张作法
赤芝、紫芝和鹿角灵芝醇提物的活性成分及生物活性研究
陈建飞1周爱珠2程 萱2童文彬2刘玉柱3张海燕2胡玉梅2练明姿1周 晶2吕国英4*张作法4
(1. 衢州菇乐农业开发有限公司,浙江 衢州 324000;2. 衢州市衢江区农业局,浙江 衢州 324000;3. 浙江方格药业有限公司,浙江 庆元 323800;4. 浙江省农业科学院园艺研究所,杭州 310021)
赤芝、紫芝和鹿角灵芝是三种常见的灵芝。对这三种灵芝的乙醇提取物所作的抗氧化活性比较结果,鹿角灵芝提取物中多酚含量最高,具有较强的抗氧化活性。在提取液0.5~2.0 mg/mL的浓度范围内,赤芝、紫芝和鹿角灵芝的醇提物显示出一定的α-淀粉酶和α-葡萄糖苷酶的抑制活性,且未显现浓度的依赖性。
灵芝;种类;活性成分;生物活性
灵芝属药用真菌,素有“神芝”和“仙草”之美誉,两千多年前在我国汉代的《神农本草经》中就有记载。灵芝中富含多糖类、核苷类、呋喃类、三萜类、生物碱、氨基酸及微量元素等[1]。灵芝及提取物具有多种药理活性,如抗肿瘤,降血糖,提高免疫力,保肝,抗衰老,抗炎等[2~5]。
赤芝、紫芝、鹿角灵芝是三种最常见的灵芝,对这三种灵芝的活性成分研究主要集中在多糖和三萜方面,对醇提物的研究很少。本文是对3种灵芝醇提物的抗氧化活性及降血糖作用的研究结果。
1 材料与方法
1.1 材料与试剂
赤芝、紫芝、鹿角灵芝子实体采自浙江省农业科学院园艺研究所食用菌实验基地。新鲜灵芝材料切碎后置于烘箱中烘干,粉碎并过40目筛后备用。1, 1-二苯基-2-三硝基苯肼(DPPH),福林-酚试剂、五倍子酸、丁基羟基茴香醚(BHA)和2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)均购自Sigma公司,其他试剂为分析纯。
1.2 灵芝有效成分的提取
灵芝粉用30倍量的50%乙醇,加入盐酸(使溶液中盐酸终浓度为1%)在摇床上振荡提取4小时,抽滤获得滤液,对滤渣重复提取一次,合并两次滤液。滤液通过旋转蒸发干燥得到灵芝醇提物,在低温下保存备用。
1.3 总酚含量测定
总酚含量的测定按照鄢贵龙等的方法进行[6]。取0.5 mL不同浓度的灵芝提取液,加入0.5 mL福林酚试剂,剧烈振荡3 min后,加入1.5 mL 15%的NaCO3溶液,静置30 min后于760 nm处测定吸光度值。
1.4 抗氧化活性测定
(1)DPPH清除率测定。灵芝提取液的DPPH
清除活性按照Zhang等的方法进行[7]。取1 mL不同浓度的样品溶液(0.031 25~2.0 mg/mL)加入0.01% DPPH 1 mL混匀,振荡反应90 min,于517 nm波长下测定吸光度值。
(2)ABTS+清除率测定[8]。配制2.45 mmol/L的过硫酸钾溶液,将ABTS溶解于过硫酸钾溶液中来制备ABTS储备液,在室温以及避光的条件下静置12~16 h。将ABTS+储备液加入10 mmol/L,pH 7.4的磷酸缓冲液稀释,使其在734 nm下吸光度达到0.7±0.02。取0.5 mL灵芝提取液加入1.5 mL ABTS+测定液,准确振荡反应30 s后在734 nm下测其吸光度值。
(3)α-淀粉酶抑制活性测定[9]。配制一系列浓度梯度的样品溶液,取样液0.2 mL加入α-淀粉酶(1∶5 000)0.05 mL,摇匀后加入0.1%淀粉溶液0.25 mL,混匀,于37 ℃水浴准确反应7.5 min,取出后立即放入冰水中,2 min后取出,加入0.25 mL碘应用液与1.5 mL纯化水。于660 nm处测吸光值。
(4)α-糖苷酶抑制活性测定[10]。配制一系列浓度梯度的样品溶液,取样液100 μL加糖苷酶100 μL,混匀后于37 ℃水浴10 min,加入100 μL 1.5 mmol/L对硝基苯基-α-D-吡喃葡萄糖苷溶液(PNPG),混匀,于37 ℃水浴20 min,加入0.2 mol/L NaOH溶液1.5 mL终止反应。于400 nm下测吸光值。
2 结果与分析
2.1 不同灵芝总酚的含量
测定结果显示,赤芝、紫芝和鹿角灵芝的总酚含量,以鹿角灵芝最高,为0.72%;紫芝次之,为0.65%;赤芝最低,仅0.53%。
2.2 不同灵芝的DPPH自由基清除活性
DPPH是一种自由基,在517 nm处有一强吸收,被广泛用于生物试样、食品等的抗氧化能力[11]。赤芝、紫芝和鹿角灵芝提取液的DPPH清除能力有浓度依赖性,鹿角灵芝DPPH清除活性较强,赤芝和紫芝DPPH的清除活性差别不大(图1)。赤芝、紫芝和鹿角灵芝提取液的半抑制浓度分别为0.38、0.33和0.22 mg/mL,而BHA的半抑制浓度为0.06 mg/mL。
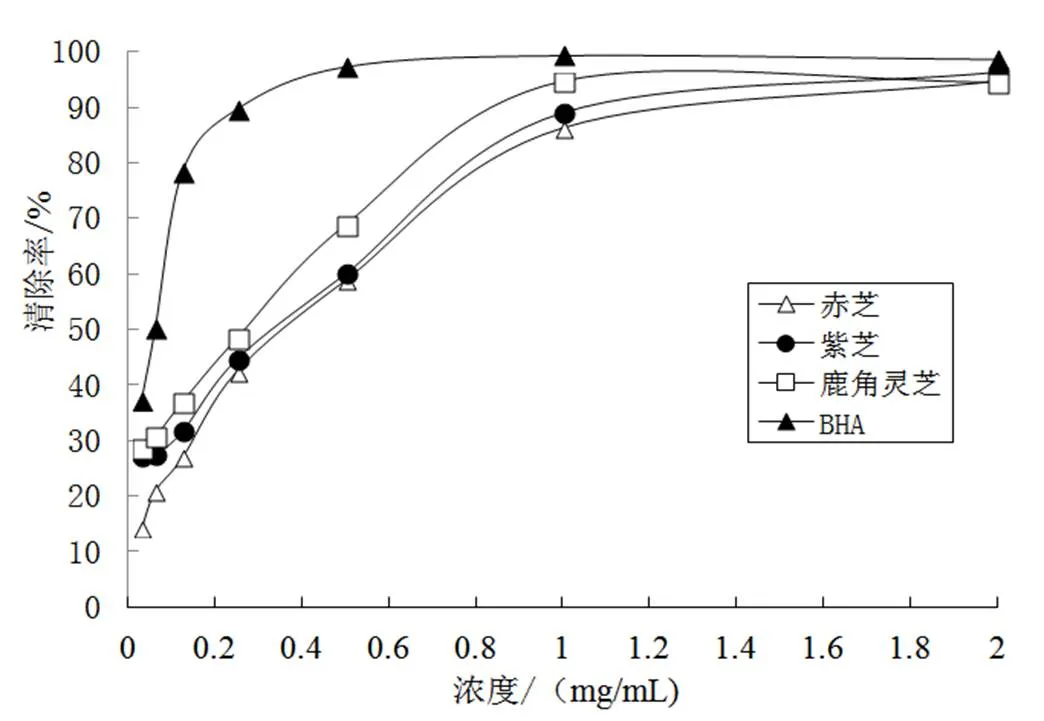
图1 不同灵芝提取物的DPPH自由基清除活性比较
2.3 不同灵芝的ABTS自由基清除活性
如图2所示,赤芝、紫芝和鹿角灵芝提取液的ABTS清除能力随着浓度增加而增加。紫芝和鹿角灵芝的ABTS清除能力较强,赤芝的能力最弱。在0.03~2 mg/mL的浓度范围内,赤芝的ABTS 清除率为19.4%~88.40%;紫芝的ABTS清除率为7.10%~93.30%;鹿角灵芝的ABTS清除率为14.5%~93.90%,而在此浓度范围内,BHA的清除率为35.9%~99.69%。

图2 不同灵芝提取物的ABTS自由基清除活性比较
2.4 不同灵芝提取液的α-淀粉酶抑制作用
从图3可见,不同灵芝醇提液α-淀粉酶抑制活性与样品浓度无明显关系,在低浓度时(0.5和1.0 mg/mL)时,赤芝的α-淀粉酶抑制活性较高,但浓度为2 mg/mL时,α-淀粉酶抑制活性的大小顺序依次为鹿角灵芝、赤芝、紫芝。

图3 不同灵芝提取物的α-淀粉酶抑制活性比较
2.5 不同灵芝提取液的α-葡萄糖苷酶抑制作用
图4表明,不同灵芝醇提液的α-糖苷酶抑制作用随着浓度增大稍有提高但不明显。其中,鹿角灵芝的α-糖苷酶抑制活性较强。在低浓度时(0.5和1.0 mg/mL)时,紫芝的α-葡萄糖苷酶抑制活性高于赤芝,而在高浓度时,赤芝的活性反高于紫芝。

图4 不同灵芝提取物的α-葡萄糖苷酶抑制活性比较
3 讨 论
本研究使用2种评价体系比较赤芝、紫芝和鹿角灵芝的体外抗氧化活性。DPPH法和ABTS法的评价体系的结果有所不同,原因可能在于提取物中成分复杂,造成3种灵芝的活性成分抗氧化能力的差异。其中,鹿角灵芝的抗氧化活性较强,这与总酚含量的测定结果基本一致。多酚类化合物由于其苯环上的羟基极易失去氢电子,故酚类物质有较强的抗氧化能力。目前,多酚含量与其抗氧化活性的相关性已有很多报道[12,13]。前期研究发现,灵芝中的酚类物质主要有4-羟基苯甲酸、肉桂酸、香豆酸等[14],而这些酚酸类物质的抗氧化活性已经得到了证实[15]。可见这些酚酸类物质在灵芝的抗氧化活性中有着重要作用。不同灵芝的多酚类物质与其抗氧化活性的不同,为以灵芝为原料的功能性食品开发提供科学依据。
糖尿病是一种常见的多病因并有遗传倾向的内分泌紊乱性疾病,其发病率有逐年增长趋势,已成为当今威胁人类健康的第三大疾病。通过抑制糖苷酶和淀粉酶的活性是一种预防糖尿病的重要手段[16]。α-淀粉酶抑制剂属于糖苷水解酶抑制剂的一种,其能有效阻止体内食物中碳水化合物的消化和水解,减少糖分的摄取量,可明显降低血脂和血糖含量[17]。本研究表明,不同灵芝的提取液显示了一定的淀粉酶抑制活性,这对于控制餐后血糖水平和保护身体机能有较大的应用价值。α-葡萄糖苷酶是治疗2型糖尿病的靶点之一,此酶是碳水化合物水解的关键酶[18]。而此酶的抑制剂能够降低多糖水解,延缓肠道对碳水化合物的吸收,达到抑制高血糖的效果。本研究表明,鹿角灵芝的α-糖苷酶抑制活性较强,具有较强的抑制高血糖的效果。
[1] 李保明, 华正根, 王洪庆, 等. 不同生长期灵芝子实体三萜酸和多糖含量的测定[J]. 食药用菌, 2016, 24: 51-53.
[2] 冯道俊. 灵芝的化学成分、功效及药理作用[J]. 特种经济动植物, 2006, 9(8): 39-40.
[3] 邓海林, 吴佩颖, 王建新. 灵芝的研究进展[J]. 时珍国医国药, 2005, 16: 141-143.
[4] 刘高强, 丁重阳, 王晓玲. 灵芝三萜类化合物抗癌作用机制研究进展[J]. 菌物学报, 2007, 26: 470-476.
[5] 李卫东, 林志彬. 灵芝的扶正固本及对“亚健康”者的保健作用[J]. 食药用菌, 2016, 24: 29-32.
[6]鄢贵龙, 纪丽莲, 罗玉明, 等. 超声-微波协同提取野马追中抗氧化活性成分[J]. 南京工业大学学报(自然科学版), 2013, 35(1): 71-75.
[7] Zhang Q, Zhang Z, Cheung H. Antioxidant activity of Rhizoma Smilacis Glabrae extracts and its keys constituent-astilbin [J]. Food Chemistry, 2008, 115: 297-303.
[8]樊锦艳, 王秋颖, 薛梅, 等. 桑黄胞外多糖生产培养基的初步研究[J]. 食品科技, 2004(2): 93-95.
[9] Lordan S, Smyth TJ., Soler-Vila A., Stanton C, Ross RP. The α-amylase and α-glucosidase inhibitory effects of Irish seaweed extracts[J]. Food Chemistry, 2013, 141: 2170-2176.
[10]胡竟一, 雷玲, 刘亚欧, 等. 桑叶的α-葡萄糖苷酶抑制作用研究[J]. 中药药理与临床, 2006, 6(22): 44-45.
[11] Zhang Z, Lv G, He Wet al. Effects of extraction methods on the antioxidant activities of polysaccharides obtained from[J]. Carbohydrate Polymers, 2013, 98: 1524-1531.
[12] 刘丽香, 梁兴飞, 孙怡, 等. 苦丁茶提取物多酚含量和抗氧化活性的测定[J]. 茶叶科学, 2008, 28: 289-293.
[13] Zhang Z, Jin Q., Lv G, et al. Comparative study on antioxidant activity of four varieties ofwith different colour[J]. International Journal of Food Science and Technology, 2013, 48: 1057-1064.
[14] Heleno SA., Barros L., Martins A et al. Fruiting body, spores andproduced mycelium offrom Northeast Portugal: A comparative study of the antioxidant potential of phenolic and polysaccahridic extracts[J]. Food Research International, 2012, 46: 135-140.
[15] Reis FS, Martins A, Barros L et al. Antioxidant properties and phenolic profile of the most widely appreciated cultivated mushrooms: a comparative study betweenandsamples[J]. Food and Chemical Toxicology, 2012, 50: 1201-1207.
[16] Tundis R, Loizzo MR, Menichini F. Natural products as α-amylase and α-glucosidase inhibitors as their hypoglycemic potential in the treatment of diabetes: an update[J]. Mini-Reviews in Medicinal Chemistry 2010, 10: 315-331.
[17] Cho ML, Han JH, You SG. Inhibitory effects of fucan sulfates on enzymatic hydrolysis of starch[J]. LWT-Food Science and Technology, 2011, 44(4): 1164-1171.
[18] Chen GL Guo MQ. Rapid screening for α-glucosidase inhibitors from Gymnema sylvestre by affinity ultrafiltration-HPLC-MS[J]. Frontiers Pharmacology, 2017, 30: 95-99.
浙江省食用菌新品种选育专项(2016C02057)
吕国英,博士,浙江省农业科学院副研究员,主要从事食药用菌研究工作,E-mail:bdzlgy@sohu.com。
S567.3+1
B
2095-0934(2019)04-264-04

