芪苈强心胶囊中生物碱在大鼠体内的药动学行为
张 瑜, 张富赓, 朱明丹, 张少强, 杜武勋*, 肖学凤*
(1. 天津中医药大学, 天津301617; 2. 天津市环湖医院, 天津300350; 3. 天津中医药大学第二附属医院, 天津300150)
慢性心力衰竭是各种心血管疾病的终末阶段和主要死因之一, 其发病涉及多个组织、 器官系统的病理损害, 是21 世纪心血管领域主要挑战之一[1]。芪苈强心胶囊首次收载于2015 年版《中国药典》中, 由黄芪、 附子、 人参、 丹参、 葶苈子等11 味中药组成, 具有益气温阳、 活血通络、 利水消肿的功效, 能提高慢性心力衰竭患者运动耐性和生活质量, 可作为治疗慢性心力衰竭的联合用药[2], 附子作为方中君药, 对患者血流动力学改变和心室重构具有保护作用[3], 其主要成分二萜类生物碱既是药效成分, 又是毒性成分[4], 双酯型生物碱(乌头碱、 新乌头碱、 次乌头碱) 对心脏的毒性作用表现为致心肌细胞凋亡、 致心律失常和低血压等[5-7], 但该成分在低浓度时对心肌细胞也有保护作用[8], 而水解去掉一个酰基后转化成单酯型生物碱(苯甲酰乌头原碱、 苯甲酰新乌头原碱、 苯甲酰次乌头原碱), 毒性降低, 生物活性减弱[9-10]。因此, 分析芪苈强心胶囊中生物碱的体内代谢过程时, 对保证药物安全性和有效性具有重要意义。
课题组前期已对芪苈强心胶囊中生物碱进行定量研究, 本实验在此基础上建立HPLC-MS/MS 法测定血浆中乌头碱、新乌头碱、次乌头碱、苯甲酰乌头原碱、 苯甲酰新乌头原碱、 苯甲酰次乌头原碱血药浓度, 并研究大鼠灌胃给药后上述成分的药动学行为, 以期为阐释药物体内过程、筛选药效物质、临床合理用药提供实验依据。
1 材料
1.1 仪器 LC-20A 液相色谱仪, 配置SIL-20AC恒温自动进样器、 CBM-20A 控制器、 CTO-20A 柱温箱、 Analyst Software 色谱工作站(1.5.2 版本)、岛津LC-20AD 泵(日本岛津公司); API4000Qtrap质谱仪(美国应用生物系统公司); MIKRO220R型低温高速离心机(德国Hettich 公司); Sorvall RC-6Plus 离心机 (美国Thermo Scientific 公司);Targin VX-02 多管涡旋振荡器(北京踏锦科技有限公司); XS205 电子天平[梅特勒-托利多仪器(上海) 有限公司]。
1.2 试药 芪苈强心胶囊(乌头碱0.003 mg/g、新乌头碱0.003 mg/g、 次乌头碱0.004 mg/g、 苯甲酰乌头原碱0.023 mg/g、 苯甲酰新乌头原碱1.072 mg/g、 苯甲酰次乌头原碱0.896 mg/g) 由石家庄以岭药业股份有限公司提供 (批号140805)。 次 乌 头 碱 (110798-201308, 含 有 量98.6%)、 新 乌 头 碱 (110799-201307, 含 有 量98.3%)、 苯甲酰乌头原碱(111794-201304, 含有量97.5%)、 苯甲酰次乌头原碱(111796-201304,含有量94.6%)、 苯甲酰新乌头原碱 (111795-201303, 含 有 量 96.3%)、 丁 螺 环 酮 (内 标,101059-201101, 含有量99.8%) 对照品均购自中国食品药品检定研究院; 乌头碱(P23S7F21639,含有量≥98.0%) 对照品购自上海源叶生物科技有限公司。 甲醇为色谱纯; 醋酸铵、 甲酸为分析纯;水为超纯水。
1.3 动物 健康雄性SD 大鼠, 体质量(220±20) g,由解放军军事医学科学院实验动物中心提供, 在天津中医药大学动物房内饲养, 温度(22±2)℃, 湿度(50±10)%, 适应性喂养1 周后进行实验, 研究经天津中医药大学伦理委员会批准。
2 方法与结果
2.1 色谱条件 Agilent ZOBRAX XDB-C18色谱柱(4.6 mm×50 mm, 3.5 μm); 以水(含5 mmol/L醋酸铵) (A) -甲醇(0.1%甲酸) (B) 为流动相, 梯度洗脱 (0.01 ~1 min, 2% B; 1 ~2 min,2% ~60% B; 2 ~3 min, 60% ~98% B; 3 ~4 min,98%B; 4~4.01 min, 98% ~2%B; 4.01 ~5.5 min,2%B); 体积流量0.45 mL/min; 柱温40 ℃; 进样量10 μL。
2.2 质谱条件 电喷雾离子源(ESI), 正离子模式下检测, 扫描方式为多反应监测(MRM); 气帘气(CUR) 体积流量20 L/min; 喷雾电压(IS)5 000 V; 离子源温度 (TEM) 550 ℃; 雾化气(GAS1) 体积流量60 L/min; 加热辅助气(GAS2)体积流量55 L/min。 质谱参数见表1。

表1 各生物碱质谱参数Tab.1 MS parameters for various alkaloids
2.3 溶液制备
2.3.1 对照品溶液 精密称取乌头碱、 新乌头碱、次乌头碱、 苯甲酰乌头原碱、 苯甲酰新乌头原碱、苯甲酰次乌头原碱对照品适量, 二甲基亚砜(DMSO) 溶解配制成2.00 mg/mL, 精密量取适量, 甲醇-水(1 ∶1) 稀释, 即得(分别含乌头碱、 新乌头碱、 次乌头碱、 苯甲酰次乌头原碱0.1、 0.2、0.5、 1、 2、 5、 20、 50、 100、 200 ng/mL, 苯甲酰乌头原碱、 苯甲酰新乌头原碱0.25、 0.5、 1.25、2.5、 5、 12.5、 50、 125、 250、 500 ng/mL)。
2.3.2 内标溶液 精密称取丁螺环酮对照品适量,甲醇-乙腈(1 ∶1) 溶解摇匀, 即得(20 ng/mL),置于4 ℃下保存备用。
2.4 血浆处理 取血浆50 μL, 加入浓氨水溶液(浓氨水∶水=1 ∶1) 10 μL、 内标溶液10 μL、 乙酸乙酯500 μL, 涡旋2 min, 15 000 r/min 离心10 min, 取上清液400 μL, 氮气吹干, 测定前以100 μL 50%甲醇复溶, 在“2.1” “2.2” 项条件下进样10 μL 测定。
2.5 方法学考察
2.5.1 专属性试验 取空白血浆(等体积甲醇代替内标溶液)、 空白血浆+对照品(乌头碱、 新乌头碱、 次乌头碱、 苯甲酰次乌头原碱质量浓度为0.01 ng/mL, 苯甲酰乌头原碱、 苯甲酰新乌头原碱质量浓度为0.025 ng/mL)、 灌胃给药(1.3 g/kg)后20 min 大鼠血浆, 按“2.4” 项下方法处理, 在“2.1” “2.2” 项条件下进样测定, 结果见图1。 由图可知, 乌头碱、 新乌头碱、 次乌头碱、 苯甲酰乌头原碱、 苯甲酰新乌头原碱、 苯甲酰次乌头原碱、丁螺 环 酮 保 留 时 间 分 别 为3.71、 3.68、 3.73、3.60、 3.53、 3.63、 3.58 min, 生物碱和内标能完全分离, 不受血浆中杂质、 内源性物质干扰, 方法专属性良好。
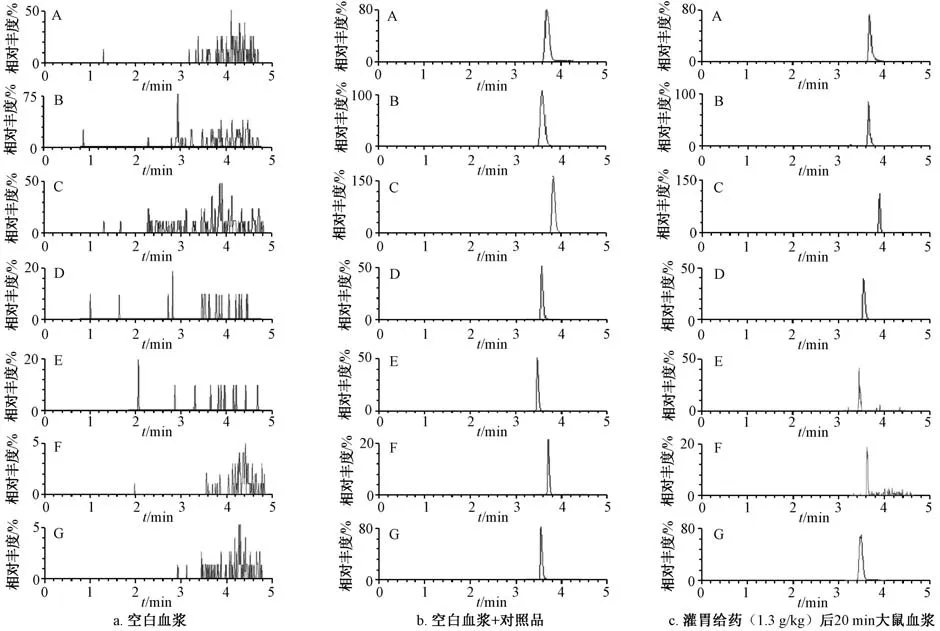
图1 各生物碱MRM 色谱图Fig.1 MRM chromatograms of various alkaloids
2.5.2 线性关系考察 取大鼠空白血浆50 μL,加入对照品溶液, 得到乌头碱、 新乌头碱、 次乌头碱、 苯甲酰次乌头原碱质量浓度为0.01、 0.02、0.05、 0.1、 0.2、 0.5、 2、 5、 10、 20 ng/mL, 苯甲酰乌头原碱、 苯甲酰新乌头原碱质量浓度为0.025、 0.05、 0.125、 0.25、 0.5、 1.25、 5、12.5、 25、 50 ng/mL。 按“2.4” 项下方法处理,在“2.1” “2.2” 项条件下进样测定。 以溶液质量浓度为横坐标(X), 对照品与内标峰面积比值为纵坐标(Y) 进行回归, 结果见表2, 可知各生物碱在各自范围内线性关系良好。
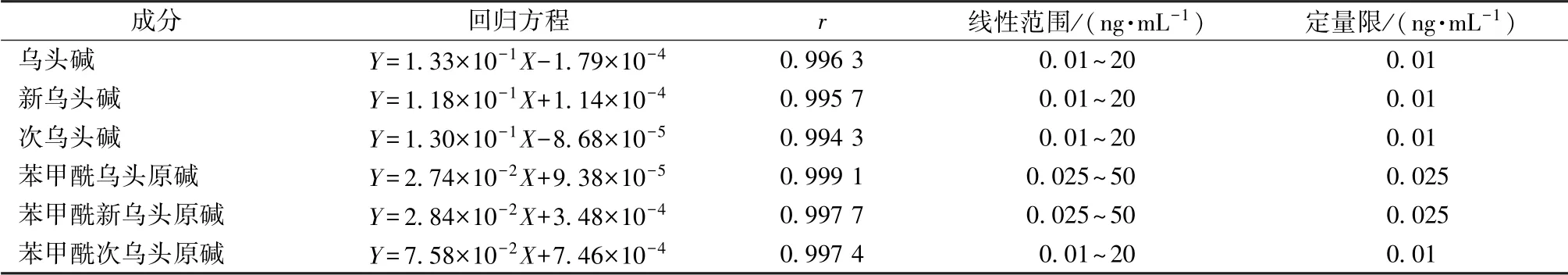
表2 各生物碱线性关系Tab.2 Linear relationships of various alkaloids
2.5.3 精密度、 准确度试验 取大鼠空白血浆, 加入低、 中、 高质量浓度对照品溶液, 得到含乌头碱(0.02、 0.5、 16 ng/mL)、 新乌头碱(0.02、 0.5、16 ng/mL)、 次乌头碱(0.02、 0.5、 16 ng/mL)、 苯甲酰乌头原碱(0.05、 1.25、 40 ng/mL)、 苯甲酰新乌头原碱(0.05、 1.25、 40 ng/mL)、 苯甲酰次乌头原碱(0.02、 0.5、 16 ng/mL) 的质控样品, 按“2.4” 项下方法处理, 在“2.1” “2.2” 项条件下进样测定, 于同1 d 内连续进行6 次, 计算日内精密度; 连续进行3 d, 计算日间精密度, 结果见表3, 可知该方法精密度、 准确度良好。
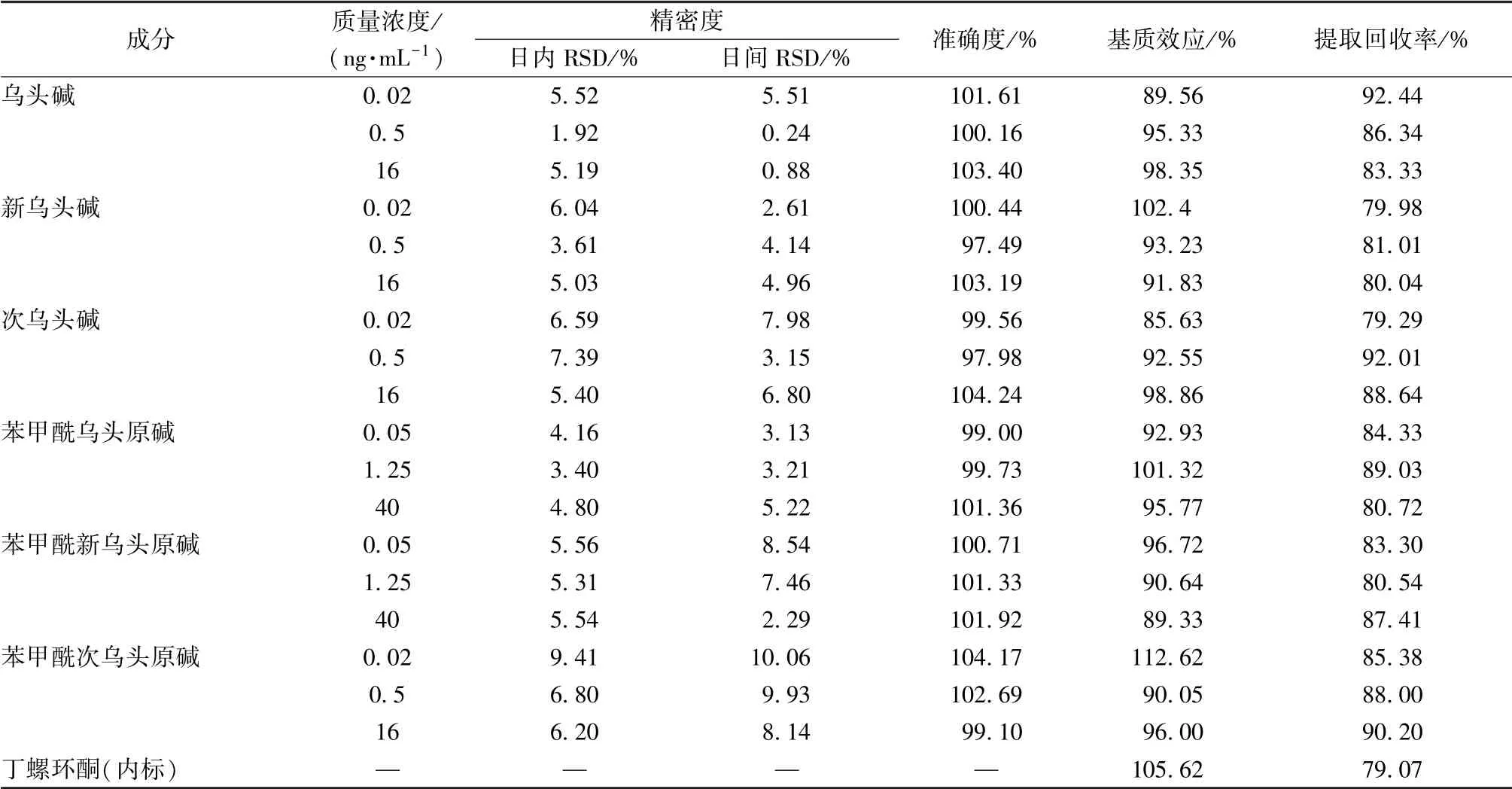
表3 各生物碱精密度、 准确度、 基质效应、 提取回收率试验结果(n=6)Tab.3 Results of precision, accuracy, matrix effect and extraction recovery tests for various alkaloids (n=6)
2.5.4 提取回收率、 基质效应 取“2.5.3” 项下质控样品, 每个质量浓度平行6 份, 按“2.4”项下方法处理, 在“2.1” “2.2” 项条件下进样测定, 得到成分峰面积(A); 以甲醇代替空白血浆,其余操作同上, 得到成分峰面积(B); 取大鼠空白血浆, 按“2.4” 项下方法处理后加入质控样品, 在“2.1” “2.2” 项条件下进样测定, 得到成分峰面积(C), 以A、 B 比值计算基质效应, A、C 比值计算提取回收率, 结果见表3, 可知大鼠血浆中内源性物质对检测无影响, 提取回收率符合相关要求。
2.5.5 稳定性试验 取“2.5.3” 项下质控样品,考察冻融稳定性(-20 ℃下冻融3 次)、 处理后稳定性(自动进样器中放置24 h)、 短期稳定性(室温下放置24 h)、 长期稳定性 (-80 ℃下放置30 d), 结果见表4, 可知稳定性良好。
2.6 药动学行为研究 取6 只大鼠, 实验前禁食12 h, 自由饮水, 灌胃给予1.3 g/kg 药物混悬液(0.5% CMC-Na 配制), 于给药后0.083、 0.167、0.333、 0.667、 1、 1.5、 2、 3、 4、 6、 8、 12、24 h经目内眦静脉丛取血0.5 mL, 样品置于肝素钠抗凝管中, 4 ℃、 12 000 r/min 下离心10 min,分离血浆, 置于-20 ℃冰箱中待测, 血药浓度-时间曲线见图2, 再通过DAS 3.0 软件计算药动学参数, 结果见表5。 由此可知, 灌胃给药后血浆中附子主要生物碱(乌头碱、 新乌头碱、 次乌头碱、 苯甲酰乌头原碱、 苯甲酰新乌头原碱、 苯甲酰次乌头原碱)均能检测到, 其中新乌头碱最快达峰, 其次是乌头碱和次乌头碱, 再次是苯甲酰新乌头原碱和苯甲酰次乌头原碱, 苯甲酰乌头原碱最慢; 苯甲酰新乌头原碱达峰血药浓度(Cmax) 和药时曲线下面积(AUC0~t) 明显高于其他成分; 乌头碱、 苯甲酰乌头原碱、 苯甲酰次乌头原碱半衰期(t1/2) 较长, 而新乌头碱、 次乌头碱、 苯甲酰新乌头原碱相对较短。

表4 各生物碱稳定性试验结果(n=6)Tab.4 Results of stability tests for various alkaloids (n=6)
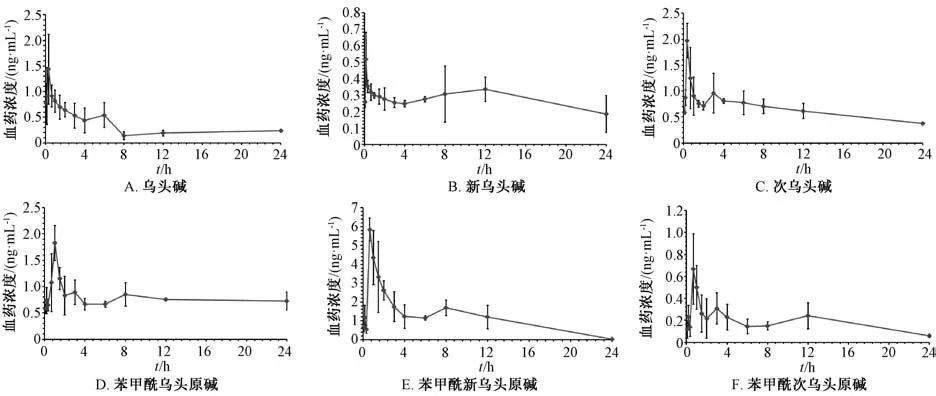
图2 各生物碱血药浓度-时间曲线Fig.2 Plasma concentration-time curves for various alkaloids

表5 各生物碱药动学参数(n=6)Tab.5 Pharmacokinetic parameters for various alkaloids (n=6)
3 讨论
复方中药药动学研究是中医药现代化的核心,也是中药药效物质基础、 活性成分体内过程、 药动-药效相关性等研究领域的重要组成部分, 可为临床合理用药和安全性评价提供实验依据[11-12]。芪苈强心胶囊作为首个经循证医学证实的对慢性心力衰竭确有疗效的中成药[13], 其药效物质基础研究和安全性探讨仍是需要解决的关键问题, 附子作为该制剂君药占复方总量的5.929%[14], 其主要药效成分生物碱也是毒性成分, 故研究大鼠灌胃给药后双酯型生物碱(乌头碱、 新乌头碱、 次乌头碱)和单酯型生物碱(苯甲酰乌头原碱、 苯甲酰新乌头原碱、 苯甲酰次乌头原碱) 血药浓度和药动学行为时, 能为芪苈强心胶囊的临床合理应用和安全性监控提供依据。
前期研究表明[15], 芪苈强心胶囊中单酯型生物碱总平均含有量是双酯型生物碱的199.1 倍, 本实验在此基础上对其体内代谢过程进行分析, 发现后者在大鼠体内吸收速度快于前者; AUC 反映药物进入人体循环的相对量, 是衡量药物利用程度的重要参数[16], 本实验表明苯甲酰乌头原碱、 苯甲酰新乌头原碱的AUC0~∞明显高于双酯型生物碱,这可能与其含有量有关[15], 但单酯型生物碱平均AUC0~∞仅是双酯型生物碱的1.86 倍, 提示后者在正常机体内的吸收情况优于前者。
4 结论
本实验建立HPLC-MS/MS 法测定大鼠灌胃芪苈强心胶囊后双酯型生物碱(乌头碱、 新乌头碱、次乌头碱)、 单酯型生物碱(苯甲酰乌头原碱、 苯甲酰新乌头原碱和苯甲酰次乌头原碱) 血药浓度,经方法学考察发现该方法符合生物样品测定要求,可用于生物体内药动学研究; 双酯型生物碱在大鼠体内吸收速度和吸收程度明显优于单酯型生物碱,可为指导该制剂临床合理用药、 保证有效性和安全性提供科学依据。

