响应面优化白花酸藤果浸泡酒抗氧化活性及成分分析
李思敏,张言,高定烽,熊华斌,高云涛
(云南民族大学 化学与环境学院,昆明 650500)
白花酸藤果为紫金牛科酸藤子属植物,又名牛脾蕊(广东)、羊公板仔(海南岛)、水林果、枪子果(云南)、马桂郎(云南傣语),分布于广东、海南、云南等地,生长在海拔50~2000 m的林内、灌木丛、路边,在云南普洱、思茅等地均可见。民间以其根(中药名:咸酸)、果(藏药名:齐当嘎)入药,治妇女闭经、小儿头疮、跌打损伤、绦虫等[1]。随着生活水平的提高,人们对食品保健和营养价值的关注度越来越高。信维平[2]从果蔬中分离出抗氧化物质,可对饮料调味和作为预防癌症等疾病的功能性食品。农仲文等[3]通过对山竹果皮中活性物质做浸泡酒的研究,发现酒中活性成分高,抗氧化作用好。杨占南等[4]对鱼腥草作为酒的调味品进行了研究,发现酒中含有丰富的营养及药理成分物质,具有保健功能。但是,鲜见对白花酸藤果浸泡酒的研究报道。本试验在单因素分析基础上利用响应面法对白花酸藤果浸泡酒的抗氧化活性进行了分析,为进一步开发利用白花酸藤果浸泡酒调味提供了理论技术依据。
1 材料与方法
1.1 材料与试剂
试验所用白花酸藤果:购自云南省普洱市,该地区属于低纬高原南亚热带季风气候区。
95%乙醇(分析纯)、乙醇(优级纯)、DPPH(1,1-diphenyl-2-picryhydrazyl):美国Sigma公司;实验室用水为超纯水。
1.2 仪器与设备
SJIA-2012型超声波细胞破碎机 宁波双嘉仪器有限公司;8453型紫外可见分光光度计 美国安捷伦公司;FA2004型电子分析天平 上海上平仪器有限公司;水浴锅 力辰科技有限公司;Agilent 7890A气相色谱仪。
1.3 试验方法
1.3.1 白花酸藤果提取物最大吸收峰的测定
按照液固比为10∶1(mL/g)的比例加入95%的乙醇,取3.0 g的白花酸藤果,置于60 ℃水浴中萃取2 h,以4000 r/min离心萃取液10 min,静置后取上清液,备测。备测样品均用对应的溶剂稀释50倍,再进行200~800 nm的光谱扫描,得到白花酸藤果溶液的吸收光谱和最大吸收峰。
1.3.2 白花酸藤果乙醇浸泡液对DPPH的清除效果
准备200 mL的烧杯,并准确称取6份3.0 g的白花酸藤果置于其中,再配制酒精体积分数为0%、10%、30%、50%、70%、95%的液体,按液固比为10∶1加入液体和白花酸藤果,瓶口以保鲜膜封口,置于60 ℃的水浴中浸提2 h,然后取滤液离心,离心条件与1.3.1中相同。取10 mL配制好的DPPH(A=0.7±0.1)溶液于比色管中,加入0.5 mL的白花酸藤果滤液,测定其吸光度,并计算溶液对DPPH的清除率。
1.3.3 不同超声功率的白花酸藤果溶液对DPPH的清除效果
取6个200 mL的烧杯,并精确称取3.0 g的白花酸藤果共6份分别置于其中,按液固比为10∶1并以保鲜膜封口后置于60 ℃的水浴中浸提2 h,然后取出烧杯,设置超声时间为20 min,分别以超声功率150,300,450,600,750,900 W提取,然后取滤液离心,离心条件与1.3.1中相同。取10 mL配制好的DPPH(A=0.7±0.1)溶液于比色管中,加入0.5 mL的白花酸藤果滤液,测定其吸光度,并计算溶液对DPPH的清除率。
1.3.4 不同超声时间的白花酸藤果溶液对DPPH的清除效果
取6个200 mL的烧杯,并精确称取3.0 g的白花酸藤果共6份分别置于其中,按液固比为10∶1以保鲜膜封口后置于60 ℃的水浴中浸提2 h,然后取出烧杯,设置超声功率为900 W,分别设置超声时间为5,10,20,30,40,50,60 min进行提取,然后取滤液离心,离心条件与1.3.1中相同。取10 mL配制好的DPPH(A=0.7±0.1)溶液于比色管中,加入0.5 mL的白花酸藤果滤液,测定其吸光度,并计算溶液对DPPH的清除率。
1.3.5 不同液固比的白花酸藤果溶液对DPPH的清除效果
取6个200 mL的烧杯,并精确称取3.0 g的白花酸藤果共6份分别置于其中,按液固比(mL/g) 5∶1、10∶1、15∶1、20∶1、25∶1、30∶1加入95%的乙醇开展实验,以保鲜膜进行封口,每个平行组均置于60 ℃水浴中浸提2 h,然后取滤液离心,离心条件与1.3.1中相同。取10 mL配制好的DPPH(A=0.7±0.1)溶液于比色管中,加入0.5 mL的白花酸藤果滤液,测定其吸光度,并计算溶液对DPPH的清除率。
2 结果与分析
2.1 提取物的最大吸收峰
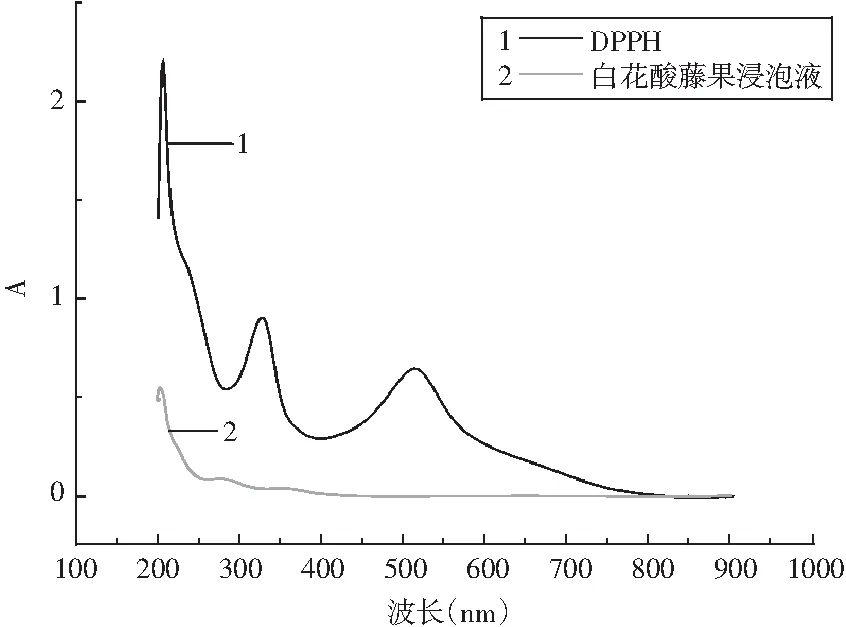
图1 提取物的最大吸收峰Fig.1 The maximum absorption peak of extracts
由图1的UV-Vis吸收光谱扫描结果可知,白花酸藤果溶液的吸收光谱在300~800 nm之间并没有吸收峰,DPPH溶液在328,517 nm处出现2个较强的特征吸收峰,而白花酸藤果溶液在202 nm处出现较强的特征吸收峰。所以本试验选用的白花酸藤果溶液的最大吸收波长为202 nm。
2.2 不同提取温度的白花酸藤果溶液对DPPH的清除效果
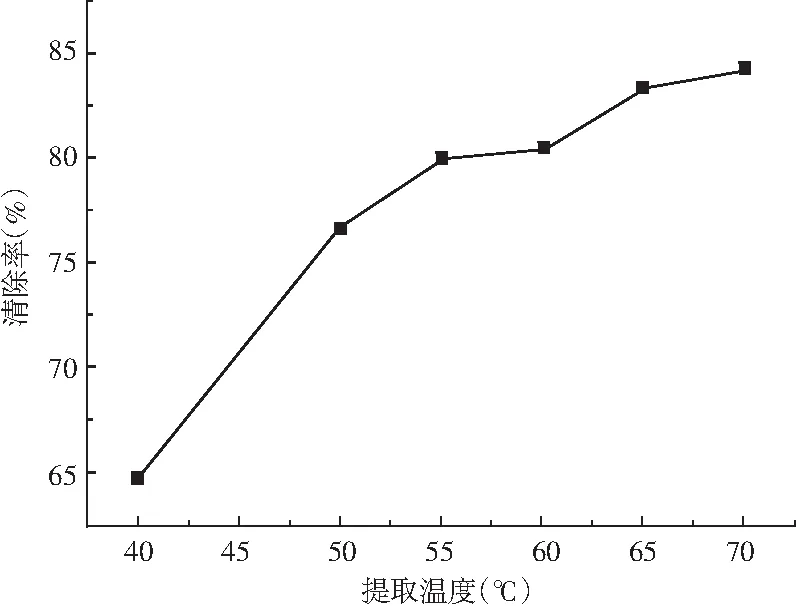
图2 不同提取温度的白花酸藤果溶液对DPPH自由基的清除Fig.2 The effect of Embelia ribes solution with different extraction temperatures on DPPH free radical scavenging
由图2可知,在整个提取温度区间的白花酸藤果溶液对DPPH的影响随提取温度的升高而升高,即提取温度对白花酸藤果提取的影响是逐步上升的。但60 ℃之后的白花酸藤果溶液,随着提取温度的升高,清除率的变化速率减慢。如对绿茶多糖体外抗氧化活性的研究显示,提取温度不但会影响多糖的提取率,而且会影响多糖的抗氧化活性[5]。这主要是因为许多抗氧化物质对温度都比较敏感,在高温条件下容易导致活性的降低。所以,考虑到白花酸藤果浸泡酒的保健价值,本研究在后续步骤中选用60 ℃作为提取温度。
2.3 白花酸藤果乙醇浸泡液对DPPH的清除效果

图3 白花酸藤果乙醇浸泡液对DPPH自由基的清除Fig.3 The effect of ethanol soaking solution of Embelia ribes on DPPH free radical scavenging
在10∶1的液固比、60 ℃的水浴条件下加热2 h,研究了不同乙醇体积分数对DPPH清除的影响。由图3可知,随着液体中乙醇含量的增加,在50%~100%内,清除率呈上升趋势,证明用乙醇对白花酸藤果进行浸泡,能使白花酸藤果内的抗氧化成分析出,其析出效果远高于水。当乙醇体积分数高于70%时,有略微下降趋势,这是由于某些有效成分溶于水,随着乙醇体积分数的升高,提取液对DPPH的清除率会略微降低。由于生活中常见的酒度数多为50度左右,这种酒浸泡调味后不但具有较好的饮用口感[6,7],而且广受消费者欢迎。故本试验选用体积分数为50%的乙醇溶液作为浸提液。
2.4 不同液固比的白花酸藤果溶液对DPPH的清除效果

图4 不同液固比的白花酸藤果溶液对DPPH自由基的清除Fig.4 The effect of Embelia ribes solution with different liquid-solid ratios on DPPH free radical scavenging
由图4可知,液固比在10∶1~30∶1,清除率随液固比的增加呈下降趋势,液固比在10∶1时对DPPH的清除率达到最大值,液固比大于10∶1时,清除率反而随液固比的增加而显著变化,这是由于随着白花酸藤果占比减小,溶解增加,白花酸藤果溶液的浓度越来越低,提取液中的有效成分被稀释,所以清除率下降。
2.5 不同超声功率的白花酸藤果溶液对DPPH的清除效果
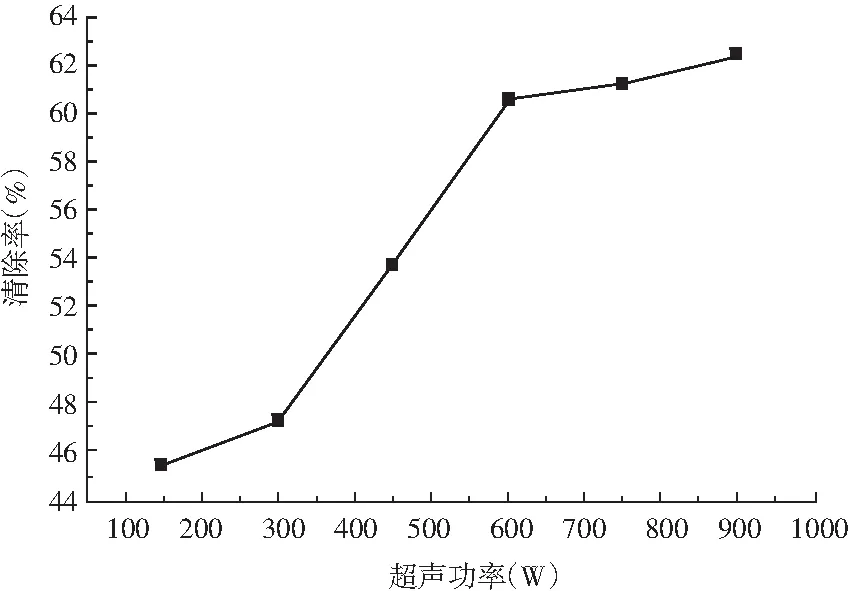
图5 不同超声功率的白花酸藤果溶液对DPPH自由基的清除Fig.5 The effect of Embelia ribes solution with different ultrasonic power on DPPH free radical scavenging
许多研究显示,超声技术有助于植物提取过程中抗氧化物质的释放[8],增加抗氧化物质的利用价值,故本研究对超声辅助提取白花酸藤果的各参数进行了优化。由图5可知,超声功率在整个区间范围内的清除率呈整体上升趋势。相对于超声功率为600~900 W时的清除率上升较为缓慢。
2.6 不同超声时间的白花酸藤果溶液对DPPH的清除效果
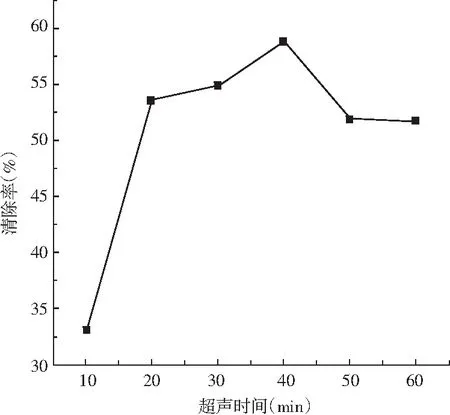
图6 不同超声时间的白花酸藤果溶液对DPPH自由基的清除Fig.6 The effect of Embelia ribes solution with different ultrasonic time on DPPH free radical scavenging
在液固比10∶1、超声功率900 W的条件下,研究了不同超声时间对DPPH清除的影响。由图6可知,在10~40 min,随着超声时间的延长,清除率呈直线上升趋势;当时间超过40 min后清除率出现下降趋势,可能是在超声功率900 W、超声时间40 min后对白花酸藤果的组织结构造成破碎现象[9],白花酸藤果原有的色素融入了试液中,增加了色素积累,导致清除率降低。
2.7 超声辅助提取的响应面法优化
2.7.1 CCD设计及其试验结果
本研究利用响应面分析建立了影响因素与响应值之间的关系,从而选择出最优工艺[10]。在探究对DPPH清除的过程中,适当超声的引入有利于提高乙醇对白花酸藤果有效物质的浸出,从而使清除率增加,由此可见,超声功率是构建白花酸藤果乙醇浸出物对DPPH清除的关键性因素,故选取超声功率作为响应面分析的影响因素。此外,在单因素试验中,一定范围内的超声功率和超声时间对清除率的影响较为显著,故将其作为响应面分析的影响因素。因此,采用Design Expert 8.1.6软件中的Central Composite Design(CCD)法对清除体系中超声功率、超声时间和提取温度对DPPH清除率的影响进行探究。根据CCD设计原理,超声功率、超声时间和提取温度各设置3个水平,见表1。
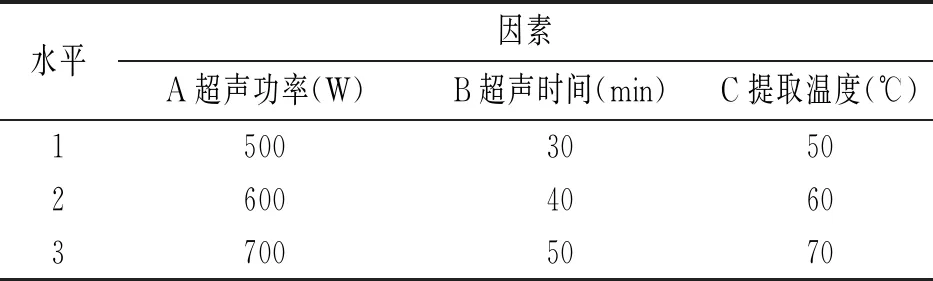
表1 响应面优化超声辅助清除DPPH试验的因素与水平值Table 1 The factors and levels of ultrasound-assisted DPPH scavenging test optimized by response surface method
根据CCD试验设计,以超声功率、超声时间和提取温度3个因素作为自变量A,B,C,以白花酸藤果乙醇的浸出物对DPPH的清除率作为响应值R,通过Design Expert 8.1.6分析软件获得的试验方案及采用该方案获得的试验结果见表2。
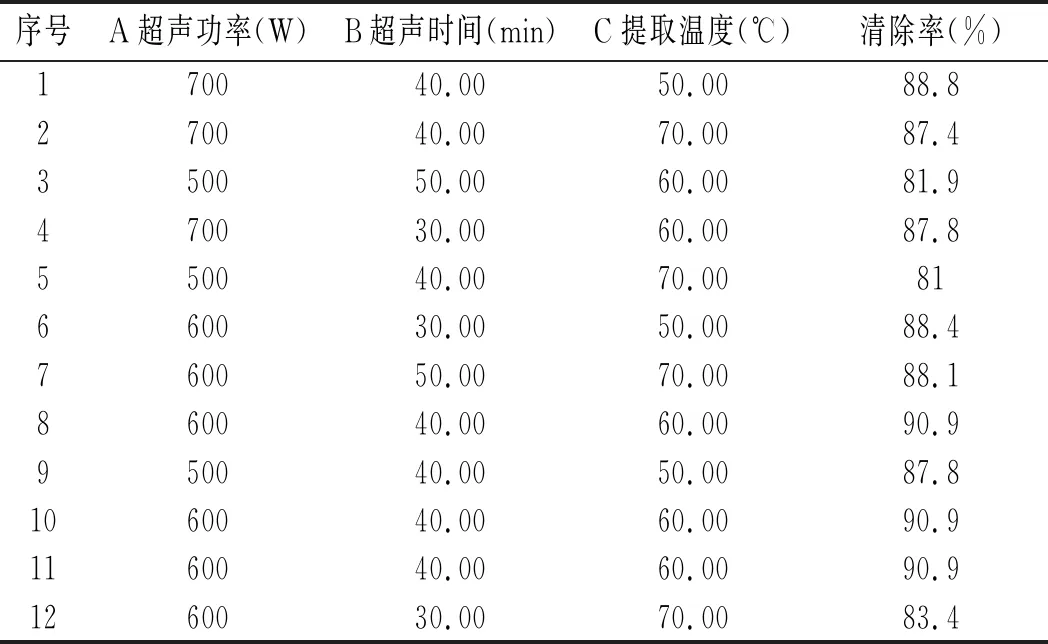
表2 CCD试验设计及试验结果Table 2 CCD experimental design and experimental results
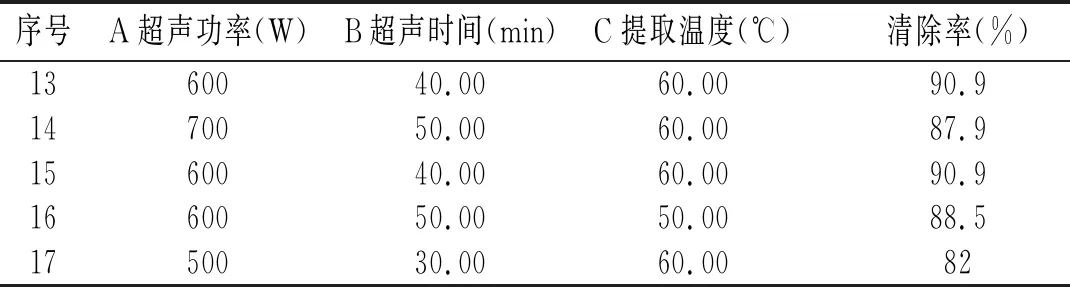
续 表
2.7.2 回归和方差分析
以白花酸藤果乙醇浸出物对DPPH的清除率为响应值,在响应面分析软件中对超声功率、超声时间和提取温度进行回归拟合,响应值R清除率与各影响因子间的回归方程为:
R清除率=90.90+4.28A+1.23B-2.95C+0.050AB+2.60AC+2.40BC-4.68A2-3.83B2-1.22C2。
所得模拟方程具有较好的相关性,相关系数为R2=0.9495。此外,对回归模型进行了方差分析,结果见表3。

表3 清除DPPH回归方差分析结果Table 3 The results of regression variance analysis of DPPH scavenging
注:“*”表示P<0.05;“**”表示P<0.01;“***”表示P<0.001。
所建立模型的P<0.0001,具有极显著性;失拟项的P>0.1,无显著性,由此可见,所建模型可用于色素提取的响应面分析。此外,A、C、AC、BC、A2、B2、C2项的P值均小于0.05,表现出显著性,这表明超声功率、超声时间和提取温度均为清除DPPH过程中影响清除率的主要因素,其中,A、A2、B2项的P<0.001,即超声功率和超声时间对DPPH清除率的影响极为显著,而C项的P<0.01,表明提取温度对DPPH清除率的影响效果要明显弱于超声功率和超声时间。BC、C2项的P<0.05,这表明超声时间和提取温度对DPPH清除率的影响在一定程度上表现出交互作用,而其他因素间则无此效应。
2.7.3 响应面分析
超声功率(A)、超声时间(B)和提取温度(C)3 个因素对DPPH清除的3D响应面图(a,b,c)见图7。
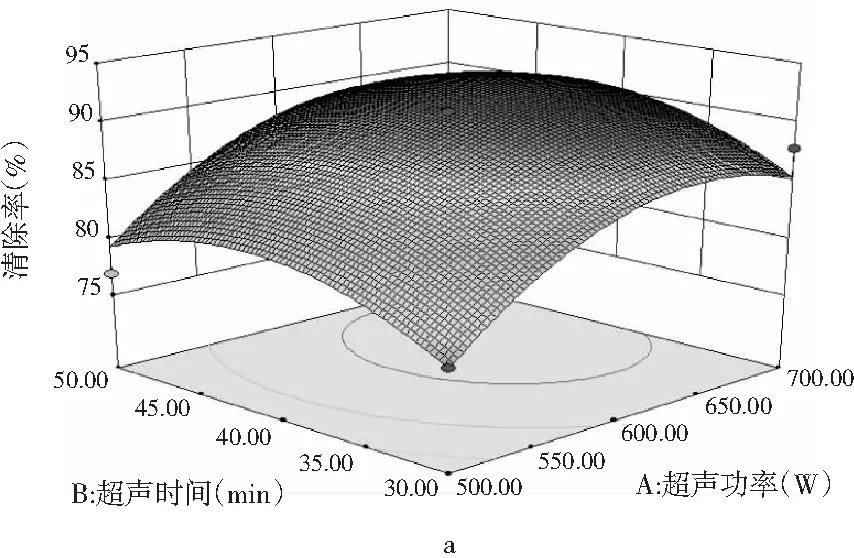
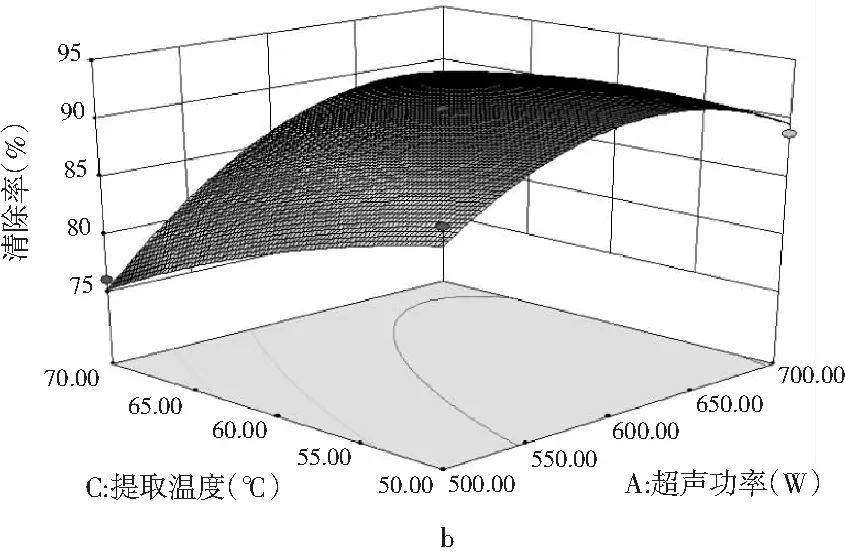

图7 各因素及其交互作用对超声辅助提取影响的响应面图Fig.7 Response surface diagrams of the influence of various factors and their interactions on ultrasound- assisted extraction
由图7中a可知,在B因素方向,响应面曲线较为平缓,说明超声时间对DPPH清除率的影响较小,随超声时间的增加,色素提取有增加的趋势,但增加的程度并不大,影响并不十分显著,而沿A因素方向则出现了较为明显的变化,响应面曲线较陡,超声功率引起清除率的变化较大,说明超声功率对DPPH清除率的影响大于超声时间。
图7中b则显示了A因素(超声功率)和C因素(提取温度)对DPPH清除率的影响。由 3D响应面图可知,在A因素方向响应面曲线有一定的坡度,但是在C因素方向,响应面曲线较为平缓,说明提取温度对DPPH清除率的影响较小,随着提取温度的增加,对DPPH清除率有增加的趋势,但增加的程度并不大,影响并不十分显著。由此可见,A因素变化对结果的影响要高于C因素,即相对于提取温度,超声功率的影响更大。
由图7中c可以比较 B因素(超声时间)和C因素(提取温度)对DPPH清除率的影响。由两因素3D响应面图中响应面曲线的陡峭程度可以看出,B,C两因素的影响也存在较大差异,相对于超声时间,提取温度的影响较弱一些。响应面分析直观反映了各因素的影响情况,其效果优于单因素试验,综合分析可以发现,3个因素对清除率的影响有所不同,其程度大小为:超声功率>超声时间>提取温度。
此外,通过响应面分析模型对DPPH清除率条件进行了优化分析,预测的最优条件是超声功率617 W、超声时间38 min、提取温度50 ℃,预测的最优清除率为92.86%。通过试验检验最优预测条件下的提取效果,清除率与预测值相接近,达到90.9%,相差仅1.96%,说明该方案是可行的[11]。通过引入超声技术和对参数的优化,白花酸藤果的自由基清除率得到了明显的改善,这与核桃抗氧化肽和雪莲薯多糖的研究结果相一致[12,13]。
2.8 白花酸藤果浸泡酒的GC-MS分析
本研究采用气相色谱仪对白花酸藤果浸泡液以及浸泡液清除DPPH自由基的成分进行了分析,并利用气质色谱联用仪[14]对色谱中出现的各峰进行了解析,结果见表4和表5。白花酸藤果在色谱级的乙醇中浸泡24 h的气相色谱图见图8。

表4 白花酸藤果溶液成分分析 Table 4 Component analysis of Embelia ribes solution

表5 加入白花酸藤果后的DPPH自由基成分分析Table 5 DPPH free radical component analysis after adding Embelia ribes

图8 白花酸藤果溶液气相色谱图Fig.8 Gas chromatogram of Embelia ribes
由图8和表4可知,从浸泡液中分离出了3种物质。把浸泡液加入DPPH自由基溶液中的气相色谱图见图9,从中分离出了2种物质。表5显示在10 mL DPPH自由基中加入500 μL的浸泡液,相对于浸泡酒的气相色谱峰有2种物质的气相色谱峰消失,分别为叶绿醇、棕榈酰胺,并且也有新物质二苯胺的气相色谱峰出现。从气质图中可以看出浸泡液中的很多成分都可以使DPPH自由基分解。
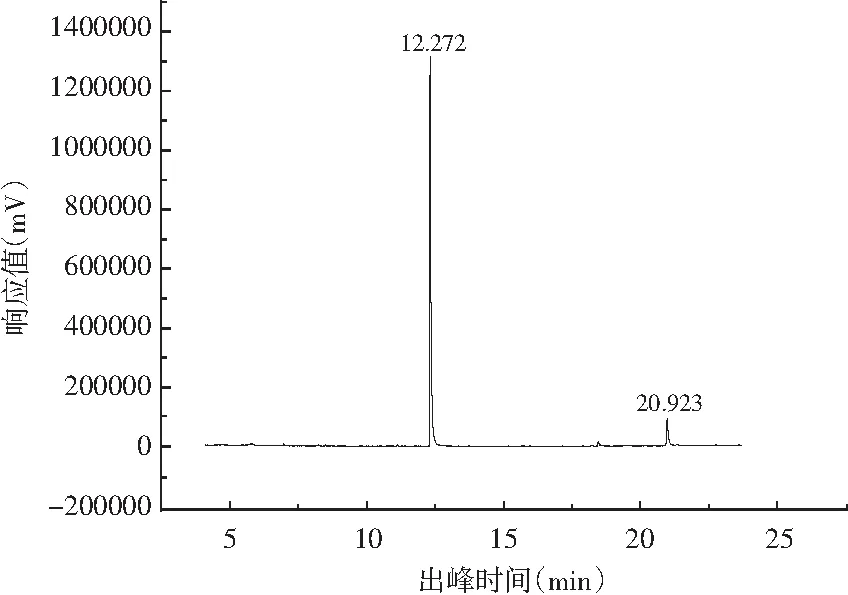
图9 加入白花酸藤果后的DPPH自由基气相色谱图Fig.9 Gas chromatogram of DPPH free radical after adding Embelia ribes
3 结论
白花酸藤果浸泡酒提取的最优条件是液固比10∶1、乙醇体积分数50%、超声功率617 W、超声时间38 min、提取温度50 ℃。使白花酸藤果浸泡酒的抗氧化作用充分发挥,有利于提高酒的风味。
响应面优化后预测的最优清除率为92.86%,通过实验测得的清除率为90.9%,与预测值仅相差1.96%。
白花酸藤果浸泡酒中含有较高的抗氧化活性成分,有利于清除人体内杂余自由基,可作为特色优势资源进一步开发利用。

