CO在超临界水中的转化以及碱性钾盐的影响
丁启忠, 张 军,*, 赵 亮, 陆柒安
(1. 东南大学 能源热转换及其过程测控教育部重点实验室, 江苏 南京 210096;2. 南京林业大学 材料科学与工程学院, 江苏 南京 210037)
水煤气转化反应(CO+H2O↔CO2+H2)是合成氨、合成甲醇等制氢工业中一个重要的基本反应[1],同时也是生物质超临界水气化制氢中氢气生成的主要路径之一[2]。在超临界水体系中,由于多个水分子参与过渡态分子,改变了反应路径,降低了反应的活化能,从而使得水密度对反应速率影响很大[3]。因此,CO在超临界水中的转化与在常态水中的转化存在区别。为此,一些学者对超临界水条件下的水煤气转化反应进行了研究,提出了各自的动力学模型,并对水密度(即压力)对反应的影响进行了重点研究[4-6]。但这些研究基本上采用的是在反应器入口进行气液混合的进气方式,由于这种方式下气液混合时间短,易导致混合不均匀。
另一方面,生物质中含有较高含量的碱金属盐(主要是钾盐)[7]。Elliott等[8-10]采用高压反应釜在200-400 ℃条件下比较了各种碱金属盐(如K盐、Na盐等)对水煤气转化反应的影响;Schuchardt等[11]采用间歇式反应器在200-350 ℃、初压7 MPa条件下研究了NaOH和Na2CO3对水煤气转化反应的影响;Akgül等[12]在连续式反应器上研究了亚临界条件(230-300 ℃,10和23 MPa)下KHCO3及NaHCO3对水煤气转化反应的影响。这些结果均表明,碱金属盐对水煤气转化反应具有催化作用,且催化能力不仅与阳离子有关,也与阴离子有关。在生物质超临界水气化过程中钾盐会以多种形式存在[13],因此,为更好了解生物质超临界水气化反应过程,需深入探究钾盐对水煤气转化反应影响的规律。
为解决气水混合不均匀的问题,本研究构建了CO高压溶解的进气系统,对超临界水条件下CO的转化规律进行了研究。同时,针对生物质超临界水气化中钾盐的多样性以及对钾盐催化机理认识的不确定性,选择三种碱性不同且存在相互转化的碱性钾盐(KHCO3、K2CO3和KOH等),研究了它们在不同工艺参数(反应温度、压力、停留时间)条件下对超临界水中水煤气转化过程影响的程度及规律,并对碱性盐的催化机理进行了讨论。
1 实验部分
1.1 实验装置
实验装置示意图见图1。该实验系统由四部分组成,分别是加料装置、反应器、冷却管路和样品采集系统。反应器由长600 mm,φ16 mm×4.5 mm的不锈钢管制成,其材质为316 L;反应器温度由布置在反应器中心外壁面的一个K型热电偶进行控制,系统的设计温度为650 ℃;反应系统的压力通过柱塞泵及背压阀来控制,系统的设计压力为40 MPa;在背压阀前安装有两级过滤器,以保证背压阀的安全。
反应器前后各有一套管式冷却装置,前面的冷却装置为保护柱塞泵的安全,后面的冷却装置装在背压阀前,以方便反应产物的排出。反应产物经冷却后依次流经两级高精度过滤器过滤从背压阀排出,然后进入气液分离器,气相产物从上方排出,反应残液由下方排出。利用气体采样袋对气体产物进行收集,并采用皂膜流量计对气体流量进行测量。
为使气水混合均匀,这里采用溶解的方法,即通过高压将CO溶解在水中,然后将溶解有CO的水通过柱塞泵送入反应器。CO溶解时储液缸中水面上方的CO分压控制在10 MPa,同时保持缸内温度为20 ℃,并在3 h后达到溶解平衡。根据实验前多次标定后得到的CO气体溶解量为CO/H2O(物质的量比)=0.0006。
1.2 实验流程
CO溶解:将去离子水或用去离子水配制的钾盐溶液(K+浓度为0.0015 mol/L)加入到储液缸中,通入CO,在CO分压10 MPa下保持3 h,完成CO的溶解。
预加热:在储液罐加入去离子水,开启高压柱塞泵将去离子水送入系统,加热系统,调节背压阀,直到设定的温度和压力。
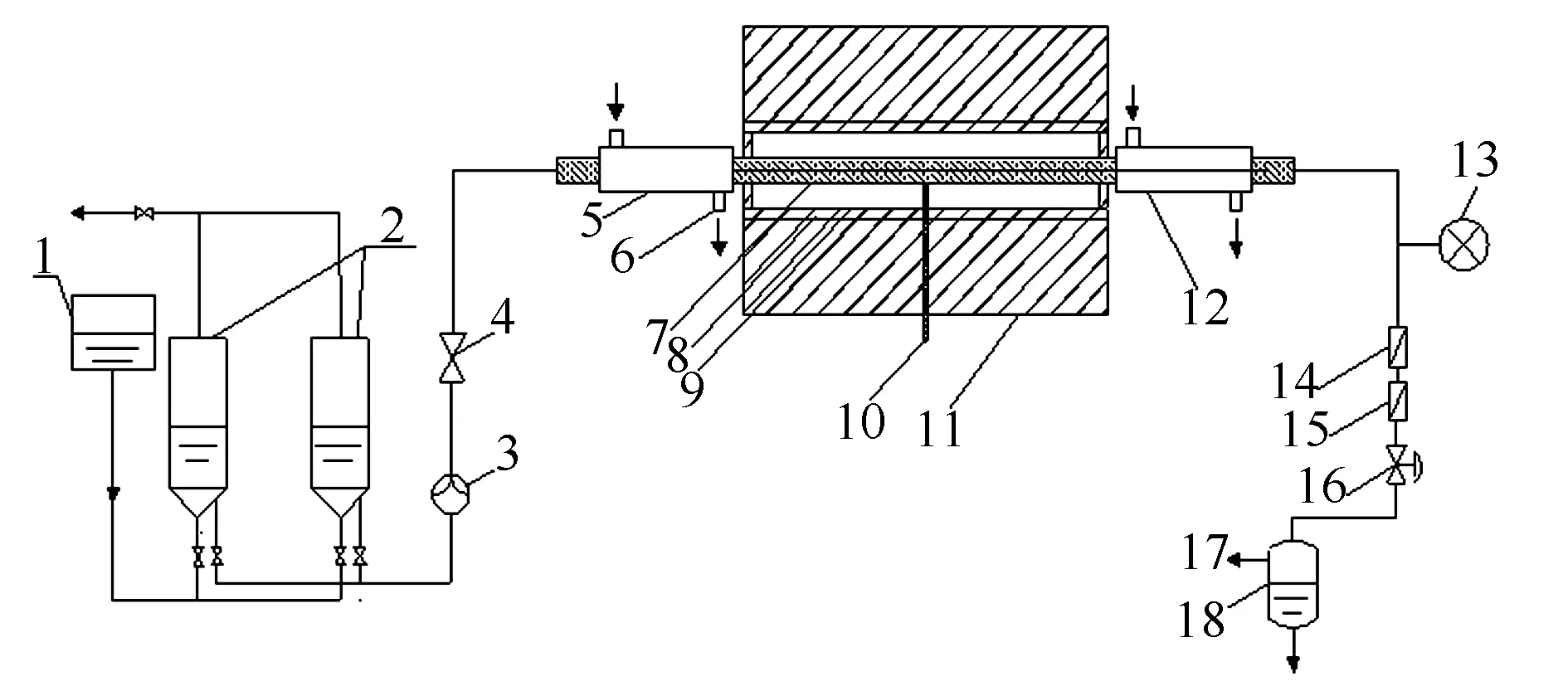
图 1 连续式超临界水反应系统示意图
实验:将储液罐切换至高压储液缸,此时含有CO气体的溶液泵入系统进行反应。待反应器的出气量达到基本稳定后,借助分液漏斗进行气液分离并开始收集气体产物,并采用皂膜流量计对气体流量进行测量。
气体经收集后利用福立GC9790plus型气相色谱仪进行定性定量分析。分析采用TCD热导检测器,以高纯氦气作为载气。色谱柱为Porapak Q、分子筛柱串联;六通阀进样;检测器温度为250 ℃;所用标准混合气体由南京特种气体厂有限公司提供。
在进行变压力和变温度实验中,通过调节反应器入口的溶液流量来保证反应时间的一致。在连续式超临界水反应系统中,反应停留时间t的计算公式为:
t=vρ/F
(1)
式中,v为反应段容积,ρ为实验温度和压力条件下的物料密度,F为物料的质量流量。由于本研究中CO/H2O(物质的量比)=0.0006,CO的含量很少,ρ值取实验条件下H2O的密度。
实验中所用的原料:CO浓度为99.99%,南京上元工业气体厂;KOH/KHCO3/K2CO3,分析纯,成都市科龙化工试剂厂。
2 结果与讨论
对气体产物的气相色谱分析表明,超临界水中水煤气转化的气体产物为H2、CO及CO2气体,未检测到CH4气体及C2-C3气体。本实验主要是研究CO在超临界水下的转化规律,因此,实验结果采用CO转化率(xCO)来进行讨论,其定义如下:
(2)
式中,nCO,0为单位时间进入反应器的CO摩尔数(mol/min);nCO为单位时间流出反应器的CO摩尔数(mol/min);Qgas为气体产物的总流量(mL/min);QH2O为水的流量(mL/min);φCO为气体产物中CO的体积分数(%)。
2.1 无催化条件下CO的转化规律
2.1.1 影响转化的因素
图2为无催化剂添加时,压力对CO转化率的影响。

图 2 压力对CO转化率的影响Figure 2 Conversion of CO under different pressures at 600 ℃ and CO/H2O (mol ratio) = 0.0006
从图2中可以看出,在23-25 MPa,随着压力的升高,CO转化率先快速增加,但在压力达到25 MPa之后,CO转化率的增加减缓,且在27 MPa后压力对CO转化率基本没有影响。这可能是因为在临界压力附近(23-25 MPa),反应的活化体积(ΔV≠)负值非常大,根据(∂lnK/∂P)T=-ΔV≠/RT,此时压力的增加可显著提高反应的速率;当压力高于临界压力(>25 MPa)时,活化体积负值大幅减小,从而压力对反应速率的影响减弱[4]。
图3为450-600 ℃、25 MPa、3-6 s时CO转化率的变化。由图3可以看出,在所有的时间范围内,随温度的升高,CO转化率增加,但在550 ℃之后,温度的影响减弱。在所有的温度范围内,随停留时间的延长,CO转化率增加,但在5 s之前,时间的影响较小,而5 s 之后,时间的影响显著增大,而在高温(600 ℃)时,时间的显著影响提前发生。

图 3 温度对CO转化率的影响Figure 3 Conversion of CO along with reaction time under different temperatures at 25 MPa and CO/H2O=0.0006 (mol ratio)
2.1.2 反应机理分析
Yasaka等[14]认为,低温下(170-330 ℃)水煤气转化反应分三个阶段: CO首先和H2O反应转化为中间产物HCOOH; HCOOH随后开始分解生成H2、CO2;最后HCOOH和H2、CO、CO2达到平衡。本研究采用离子色谱法检测了反应的液相产物,结果显示,在450 ℃时检测到HCOOH液相产物中甲酸根离子的浓度较高(图4),为46.5 mg/L,600 ℃时没有检测到HCOOH的存在。这表明,甲酸是水煤气转化反应的中间产物,随着温度升高,甲酸快速分解,所以没有检测到甲酸。
2.1.3 反应动力学
根据图3数据,对水煤气转化的反应动力学进行了求解。该反应为CO的一级反应[4-6],因此,反应的速率方程表示为:
d[CO]/dt=-k[CO]
(3)
由公式(3)可得,[CO]=[CO]0e-kt,所以当-ln([CO]/[CO]0)即-ln(1-x)(x为CO转化率)对时间作图时,应得到直线,具体见图5。由直线的斜率可以得到各反应温度下的反应速率常数k。
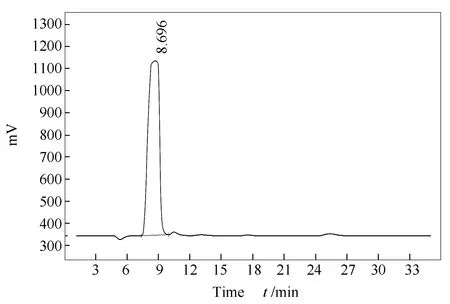
图 4 甲酸根的液相产物分析结果谱图Figure 4 Ion chromatography spectra of formic acid at 450 ℃, 25 MPa, with a residence time of 6 s and CO/H2O (mol ratio)= 0.0006

图 5 -ln(1-x)随反应时间的变化Figure 5 Plot of -ln(1-x) against residence time for the WGSR at 25 MPa and CO/H2O (mol ratio)=0.0006
由阿伦尼乌斯公式k=k0exp(-Ea/RT),可得lnk=-Ea/RT+lnk0。以lnk对1/T作图时, 可得一直线,从其斜率可以求得反应的活化能Ea。将不同温度下的lnk与1/T作图, 具体见图6。由图6得到阿伦尼乌斯方程为
k=103.75×exp(-0.66×105/RT)(s-1)
(4)
式中,R为气体常数。此处得到的反应活化能为66 kJ/mol,而之前研究得到的活化能在98-145 kJ/mol[4-6]。其原因一是本研究采用溶解的方式,使得气液混合均匀,从而降低了活化能,提高了反应速率。另外,之前的研究中CO/H2O物质的量比为0.01-0.03[4-6],本研究的CO/H2O(物质的量比)=0.0006;而研究表明,在超临界水条件下水煤气转化反应也受CO/H2O物质的量比的影响[5],CO/H2O物质的量比减小,活化能明显降低,反应速率增加。

图 6 水气变换反应速率的阿伦尼乌斯图Figure 6 Arrhenius plot of rate constant for the noncatalytic WGSR in supercritical water
2.2 碱性钾盐对CO转化的影响
2.2.1 不同温度时钾盐的影响
图7为添加不同的钾盐时CO转化率随温度的变化。
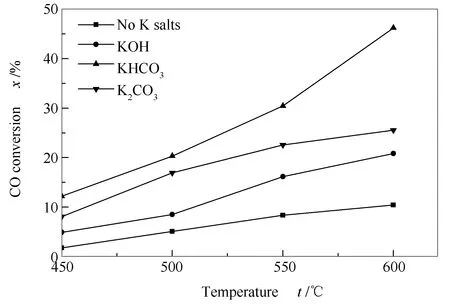
图 7 不同温度时钾盐对CO转化率的影响Figure 7 Effect of potassium salts on the conversion of CO at 25 MPa and with a residence time of 6 s and CO/H2O (mol ratio) = 0.0006450-600 ℃, [K+]=0.0015 mol/L
由图7可知,碱性钾盐的添加对CO转化率有显著的影响。在所有的温度范围内,三种钾盐均提高了CO转化率,表明这些碱性钾盐对水煤气转化反应具有催化作用。钾盐的影响与温度有关,在所研究的温度范围内,随温度的升高碱性钾盐的催化作用加强。
由图7还可知,所研究的三种钾盐的催化效果存在差别,在所有的温度范围内,特别是在高温时,KHCO3展现出了明显高于其他两种成分的催化效果,而KOH的催化效果最差,由此表明,阴离子的种类会影响到CO的催化转化路径。
2.2.2 不同压力时钾盐的影响
不同压力下CO的转化率见图8。在不同的压力区间,压力的影响也有所不同。在23-25 MPa,压力增加,CO转化率明显增加,但与无钾盐添加时相比,压力的增加对CO转化的影响要略微明显些。这可能是由于添加钾盐后离子强度增加,溶液的极性也增大,反应的活化体积(ΔV≠)绝对值也进一步加大,使得压力对反应速率的影响增大[15]。
由图8可知,当压力高于25 MPa后,压力对反应速率的影响减小,这是由于反应的活化体积绝对值变小的缘故。但添加K2CO3时,在27 MPa之后CO转化率出现急剧增加,这可能是由于压力升高,水的离子积增加[16],促进了K2CO3生成KHCO3的离子反应,使得两种盐对CO转化的影响程度接近。
由图8不同压力下的结果也可知,不同钾盐的影响程度从大到小依次为:KHCO3>K2CO3>KOH。

图 8 不同压力时钾盐对CO转化率的影响Figure 8 Effect of potassium salts on the conversion of CO at 600 ℃ and with a residence time of 6 s and CO/H2O (mol ratio)= 0.0006 [K+]=0.0015 mol/L
2.2.3 不同停留时间时钾盐的影响
图9为添加不同的钾盐时CO转化率随反应停留时间的变化。随着停留时间的延长,CO转化率总体上表现出增加的趋势。

图 9 不同停留时间时钾盐对CO转化率的影响Figure 9 Effect of potassium salts on the conversion of CO at 600 ℃, 25 MPa and CO/H2O (mol ratio) = 0.0006 [K+]=0.0015 mol/L
2.2.4 反应机理讨论
从上述实验结果可以看出,在超临界水条件下,三种碱性钾盐在钾离子浓度相同的情况下对水煤气转化的催化能力不同,总体上KHCO3的催化能力最强,其次是K2CO3,而KOH的催化能力最差。
Elliott等[9]及Onsager等[17]提出了各自的碱性盐催化反应机理。Elliott等[9]提出的反应机理如下:
(5)
CO+OH-→HCOO-
(6)
(7)
H2CO3→H2O+CO2
(8)
HCHO→H2+CO
(9)

Onsager等[17]提出了新的反应路径:
(10)
OH-+CO→HCOO-
(11)
(12)
(13)
根据上述反应路径,碱性盐催化活性的不同主要取决于无机阴离子水解生成的OH-浓度也即碱性的不同。无机阴离子的种类和浓度不同,生成的OH-浓度也不同。在超临界水中,除水煤气转化反应外,三种钾盐可能参与的反应主要有:
(14)
(15)
(16)
(17)
(18)
由于常温常压下K2CO3与KHCO3为弱碱,而KOH为强碱,KHCO3或K2CO3溶液中OH-浓度明显低于KOH溶液中的OH-浓度;在超临界水中,H2CO3为强酸[18],其对应碱的碱性比常温下要弱,因此,KHCO3或K2CO3溶液中OH-浓度进一步减小。部分OH-也会发生式(15)中的反应,与CO2生成K2CO3,使得KOH溶液OH-浓度下降,但添加KHCO3或K2CO3后水煤气转化反应也会生成更多的CO2,使得这两种溶液中OH-浓度比KOH下降更多。所以,添加各种钾盐后,OH-浓度由高到低为KOH>K2CO3>KHCO3,CO2的产生并不会改变OH-浓度的顺序。
而上述机理(式(10)-(13))认为,OH-浓度增加,催化活性增加,这很难解释KHCO3的催化作用最强的现象。因此,Onsager等[17]的机理也不合理,不同碱性盐对反应的影响并不取决于碱性的不同。
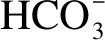
(19)
(20)
(21)
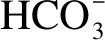
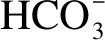
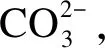
综上分析,碱性盐对水煤气转化反应的影响并不取决于碱性的不同,而是存在其他的反应路径。K2CO3和KOH的催化作用是通过转化到KHCO3来实现的。由于转化过程受温度、压力、时间和CO2分压的共同影响,因此,在超临界水条件下生成的KHCO3展现出不同的变化,最终使得三种碱性钾盐对水煤气转化展示出不同的催化效果。
3 结 论
无催化条件下,提高反应温度、延长反应停留时间均可提高CO转化率,而低压下(23-25 MPa),升高压力对CO转化率影响较大,高压下(>25 MPa),升高压力对CO转化率影响较小;无催化水煤气转化的反应动力学方程为k=103.75×exp(-0.66×105/RT)(s-1)。
添加碱性钾盐时,KOH、K2CO3、KHCO3均提高了CO转化率,各种钾盐对CO转化率的促进程度从大到小依次为:KHCO3>K2CO3>KOH。提高反应温度、延长反应停留时间均提高CO转化率,而压力的影响比较复杂。


