高表达抗PD-1单克隆抗体细胞株工艺开发的研究
张勇,覃鸿妮,谢钰珍,王倩文
(1.苏州工业园区服务外包职业学院,江苏苏州 215123;2.苏州智享众创孵化管理有限公司,江苏苏州 215123)
程序性死亡受体1(Programmed death 1,PD-1)是一种重要的免疫抑制分子,属于免疫球蛋白超家族[1]。PD-1主要在激活的T细胞和B细胞中表达,功能是抑制细胞的激活,这是免疫系统的一种正常的自稳机制,因为过度的T/B细胞激活会引起自身免疫病,所以PD-1是人体的一道护身符[2-4]。但是,肿瘤微环境会诱导浸润的T细胞高表达PD-1分子,肿瘤细胞会高表达PD-1的配体PD-L1和PD-L2,导致肿瘤微环境中PD-1通路持续激活,T细胞功能被抑制,无法杀伤肿瘤细胞[5-7]。PD-1的抗体可以阻断这一通路,部分恢复T细胞的功能,使这些细胞能够继续杀伤肿瘤细胞。以PD-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义。其配体PD-L1也可作为靶点,相应的抗体也可以起到相同的作用[2]。本研究以PD-1分子为靶点,以中国仓鼠卵巢(CHO)细胞为宿主,构建高表达抗PD-1单克隆抗体的细胞株,优化细胞株筛选工艺,得到稳定高表达PD-1细胞株,且蛋白质量与原研药一致。
1 材料与方法
1.1 试验材料
重组工程细胞株的构建,采用自Invitrogen购入的FreedomTMCHO-STM kit。该试剂盒包含表达载体pFreedomTM CHO1.0和宿主细胞CHO-S。细胞生长过程中使用化学限定培养基CD FortiCHO 培养基,呈悬浮态生长。
1.2 试验方法
1.2.1 目的基因的合成
根据信号肽氨基酸序列得出目的基因序列,设计引物通过PCR方法合成目的基因。
(1)目的信号肽序列及引物序列。
Heavy chain METDTLLLWVLLLWVPGSTG(信号肽)
Light chain METDTLLLWVLLLWVPGSTG(信号肽)
(2)扩增引物序列。
重链 01-H-F:5’-CTTCCTAGGGCCACCATGGGCTG GAGCCTGATCCT-3’
01-H-R:5’-attGTATACTCACTTGCCCAGGGAGAG GCTCA-3’
轻链 01-L-F:5’-CTTGATATCGCCACCATGGATTTT CAGGTGCAAAT-3’
01-L-R:5’-ATTTTAATTAATCAGCATTCGCCCCGA TTAAAGGACTTGG-3’
1.2.2 表达质粒的构建
由Primer软件设计2对特异性引物(本实验所有引物均由苏州金维智生物科技有限公司合成),引物经过1轮PCR扩增,得到H链目的片段,将H链目的片段通过T4连接的方法克隆到经过AvrII和BstZ17I双酶切过的 Freedom ®pCHO 1.0载体上,命名为pCHO1.0-H。引物经过第2轮PCR扩增,得到L链目的片段,将L链目的片段通过T4连接的方法克隆到经过EcoRV 和PacI双酶切过的pCHO1.0-H载体上,命名为pCHO1.0-PD-1。
1.2.3 重组工程细胞株的构建
电转染的方法将抗体表达质粒pCHO1.0-PD-1转入宿主细胞,利用Puromycin和MTX筛选系统对细胞进行加压筛选和克隆化,从而得到高表达PD-1抗体的克隆。通过比较克隆的生长特征及所表达蛋白的性质,最终确定细胞株。重组工程细胞株的构建采用自Invitrogen购入的FreedomTMCHO-STM kit,将转染48小时后的细胞悬液过滤后传代至T75方瓶。所用筛选培养基分别为含有 10 μg/ml Puro、100 nmol/L MTX。将方瓶置于37℃,8% CO2的培养箱中静置培养。7天后开始每3~4天检测细胞活率,当细胞活率大于30%或细胞活率较最近一次检测有所增加时,将细胞以1×106个/ml的密度传代至125 ml摇瓶。当细胞活率大于85%,细胞密度大于1×106个/ml时,第一阶段筛选完成。对第一阶段加压放大得到的3个细胞群和第二阶段加压放大得到的3个细胞群采用6孔板5天静止培养的方法进行高产细胞群的筛选。6孔板5天静止培养方法:以0.3×106个/ml的细胞密度接种至6孔板,接种体积为3 ml,第5天结束,收获上清液。利用生物膜干涉技术检测抗体表达量,筛选出抗体表达量最高的细胞群。
1.2.4 细胞株的鉴定
对表达量最高的2个克隆进行基因组目的基因测序及支原体、无菌检测。并对2个克隆所表达抗体进行理化性质分析。
1.2.4.1 目的基因测序
用 TIANamp Genomic DNA Kit试剂盒、按照厂家提供的方法,分别提取初步稳定性实验中连续传代至第9代的细胞的基因组DNA,以基因组DNA作为模板,用表中位于目的基因侧翼区的引物进行PCR,分别获得携带全长IBI308重链基因及轻链基因的PCR产物。将PCR产物进行DNA测序。
1.2.4.2 支原体检测及无菌检测
使用支原体PCR检测试剂盒,对2个细胞株进行初步支原体检测。检测方法详见试剂盒说明书。若待测样品存在支原体污染,检测结果应获得290 bp的PCR条带。
1.2.4.3 LC/MS法产品分子量检测
切糖样品处理:样品用 New England Biolabs公司的 PNGase F(P0704S)切糖,取 50 μg样品用超纯水稀释至90 μL,加入10×G7缓冲液(随酶提供)10 μL、PNGase F 2 μL,37 ℃孵育 24 h。孵育后的样品转移至离心浓缩柱中,以13 000 r/min速度离心15 min,再以 1 000×g的速度回收蛋白 3 min 后加 8 mol/L 的盐酸胍 100 μL 和 1 mol/L DTT 3 μL,37 ℃孵育1 h以还原二硫键。然后脱盐并稀释至1 mg/mL,上LC-MS分析。处理的样品采用LC-MS检测。
不切糖轻重链分子量检测样品处理:取样品50 μg至离心浓缩柱中,加水至 500 μL,以 13 000 r/min速度离心 15 min,再以 1 000×g的速度回收蛋白3 min 后加 8 mol/L 的盐酸胍 100 μL 和 1 mol/L DTT 3 μL,37 ℃孵育1 h以还原二硫键。然后脱盐并稀释至 1 mg/mL,上 LC-MS 分析。
1.2.4.4 蛋白SEC纯度(SEC-HPLC法)
用超纯水将样品稀释至2 mg/mL,置于进样瓶中,接上分析柱,设置方法参数为:流速0.5 mL/min,柱温 25 ℃,进样量 50 μL,即蛋白 100 μg,每个样品重复进样2次,检测波长280 nm,分析时间30 min。检测完成后,采用峰面积归一化法计算各样品主成分的百分比。
1.2.4.5 初步传代稳定性检测
复苏原始细胞株进行初步传代稳定性研究。将复苏后细胞连续培养59天(约60个细胞世代)。传代过程中使用添加1% Anti-Clumping Agent、1 000 nmol/L MTX的生长培养基,接种密度为0.3×106~ 0.8×106个 /mL,接种体积为 30 mL。每周一、三、五传代。观察传代过程中2个细胞株的细胞密度、细胞活率和倍增时间。
1.2.4.6 抗体表达量检测
2个原始细胞株连续传代约60世代后,分别对M0(原始细胞)、M1(连续传代一个月)、M2(连续传代两个月)的细胞进行14天流加培养实验,检测蛋白表达量。
2 结果与分析
2.1 抗体表达质粒pCHO1.0-PD-1的构建
采 用AvrII/BstZ17I和EcoRV/PacI对 质 粒pCHO1.0-PD-1进行酶切鉴定,确认酶切位点及质粒片段大小正确。如图1所示,用AvrII/BstZ17I进行双酶切,目的片段大小为 1 400 bp,用 EcoRV/PacI进行双酶切,目的片段大小为750 bp,目的片段大小正确,所以酶切位点及质粒片段大小正确。对最终表达质粒pCHO1.0-PD-1进行目的基因测序分析,对比结果显示与理论序列一致。
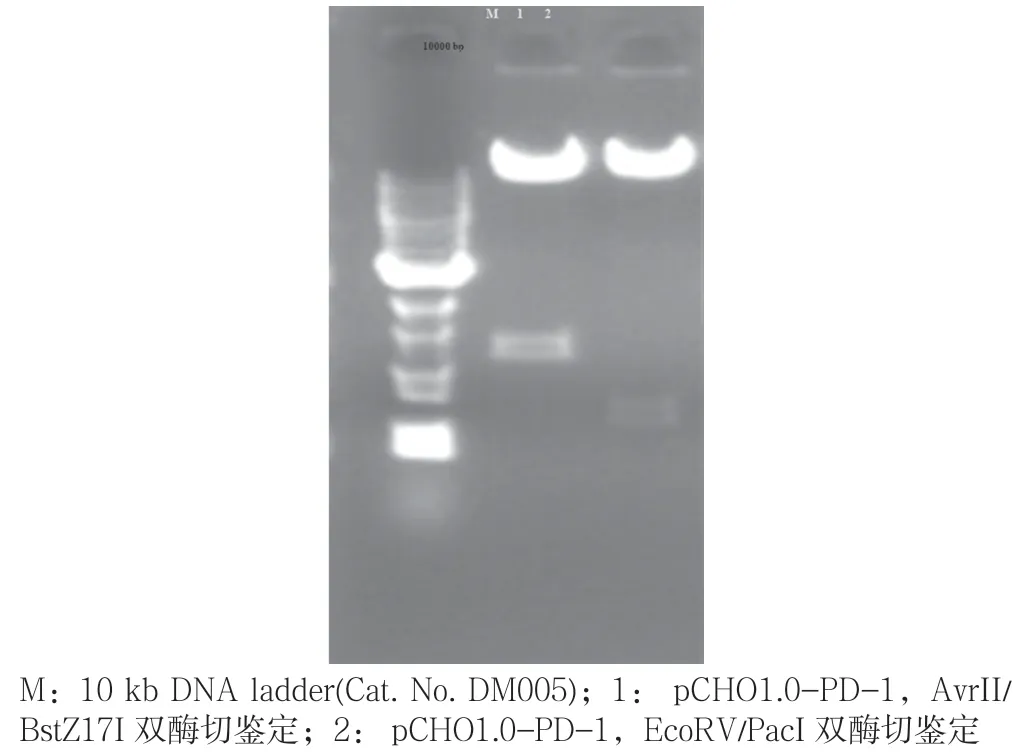
图1 Lbcpf1片段PCR扩增电泳图
2.2 高表达PD-1的重组工程细胞株构建
2.2.1 筛选高表达细胞群
对第一阶段加压放大得到的3个细胞群和第二阶段加压放大得到的3个细胞群采用6孔板5天静止培养,收获上清液,利用生物膜干涉技术检测抗体表达量。结果表明:以1(第二轮加压)、2(第二轮加压)二个细胞群抗体表达量较高,分别为20.3 mg/L、25.5 mg/L。
2.2.2 筛选阳性单克隆
利用有限稀释法对表达量最高的细胞群18(10/100~50/1000)进行单克隆筛选,在培养第20天时用利用生物膜干涉技术检测上清内的抗体表达量,表达量最高的分别为19.38 mg/L和18.27 mg/L,最低的为5.76 mg/L。筛选出表达量最高的48个克隆,24孔板培养5天后,最高的表达量分别为19.14 mg/L和 17.75 mg/ L,最低的为 10.72 mg/L。筛选出表达量最高的24个克隆,6孔板培养5天后,将表达量高的前18个克隆扩增培养,进行14天流加培养实验,检测其中的蛋白量,结果如图2,从图中可以看出克隆01C90和01C42的表达量是最高的两个,分别为2 091 mg/L 和 2 028 mg/L。

表1 细胞群静止表达量
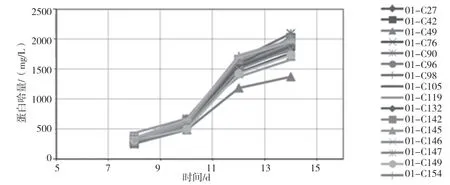
图2 14天流加培养蛋白量
2.3 细胞库的鉴定
2.3.1 支原体检测及无菌检测
如图3所示,样品1和样品2在290 bp处无条带出现,而3号阳性对照在290 bp处有明显的条带,所以支原体检测结果为阴性。用滤膜过滤法检测细胞库,无菌检测结果为阴性。
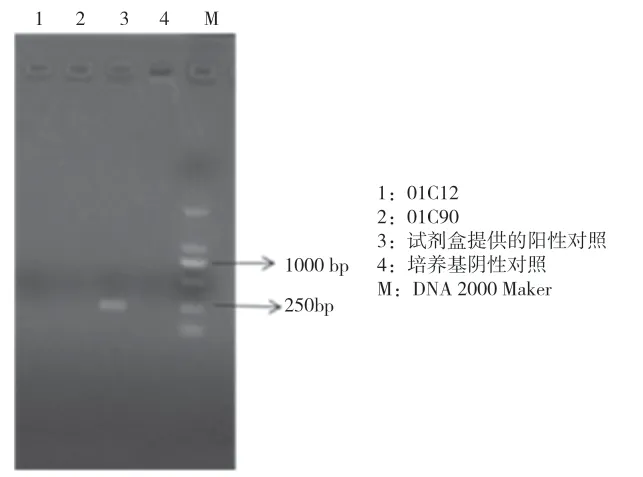
图3 支原体检测
2.3.2 LC/MS法产品分子量检测
采用LC-MS法测定了克隆01C42和01C90的切糖轻重链分子量和不切糖轻重链分子量。检测结果表明:两个克隆的实测分子量无明显差异,均为23 745.0,与理论分子量差异在方法误差范围内。重链未切糖实测分子量无明显差异,均为507 166.2,与含有G0F糖型的理论分子量差异在方法误差范围内,重链切糖实测分子量48 270.9,与理论分子量差异在方法误差范围内。因此认为两个克隆的轻重链分子量相同,且与理论值一致。
2.3.3 蛋白SEC纯度(SEC-HPLC法)
原始细胞库2个原始细胞株所表达抗体的SEC检测结果,结果显示,经Protein A亲和柱纯化后,2个原始细胞株所表达的抗体的SEC纯度均高于98%。说明这2个原始细胞株在抗体SEC纯度上均表现优异。
2.3.4 初步传代稳定性
将复苏后细胞连续培养59天(约60个细胞世代)。60个世代的初步传代过程中2个克隆01C42和01C90的抗体表达量均未降低,倍增时间维持在20~30 h,细胞活率均高于95%。
2个原始细胞株连续传代约60世代后,分别对M0(原始细胞)、M1(连续传代一个月)、M2(连续传代两个月)的细胞进行14天流加实验检测蛋白表达量。表2所示为不同世代的2个细胞株14天累积的抗体表达量。图4为不同世代的2个细胞株在14天流加培养实验中的抗体表达量。
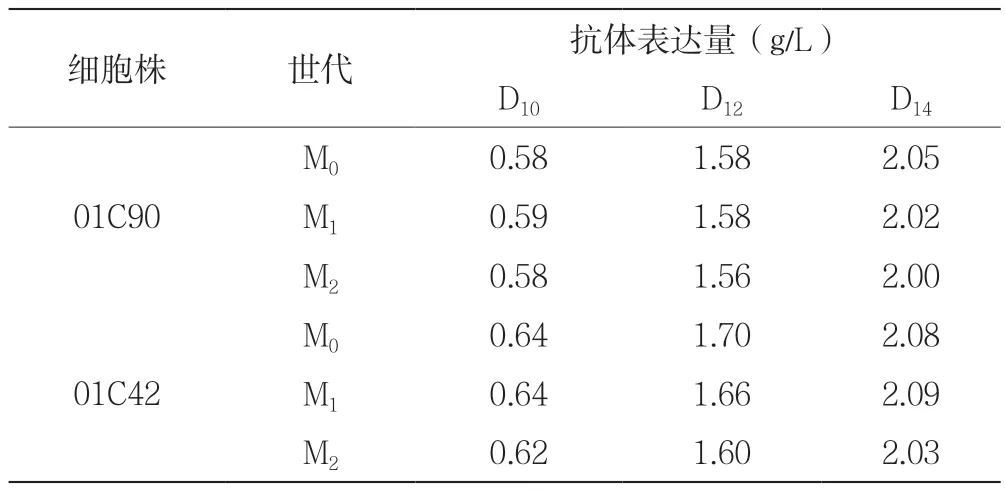
表2 不同世代的原始细胞株抗体表达量
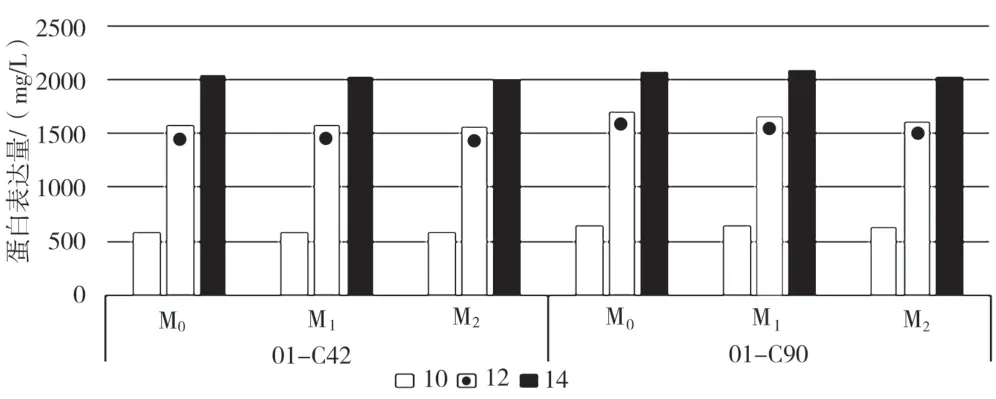
图4 不同世代的原始细胞株抗体表达量
3 讨论与结论
3.1 讨论
运用悬浮细胞CHO表达抗PD-1的抗体,无论从表达上还是稳定性都有着比较强的优势,首先在质粒构建中,将重链和轻链插到同一个载体上,保证了重链和轻链的比例为1∶1,可以实现共表达,轻重链在一个载体上,再同PD-1基因共转染,对后面的基因扩增筛选提供基础。采用悬浮培养,使用化学成分确定的培养基CD培养基化学成分简单,制备方便,能很好的支持重组CHO细胞的生长,进而可以达到高密度培养,可达8×106~10×106vc/mL,批次培养的总细胞密度可达 100×106~ 150×106vc/mL,高密度的生长优势促使细胞粉笔的产量达到一个较高的水平,单纯的批次培养最高表达产量可达1g/L,为后续的工艺降低生产成本,减少下游工艺开发的复杂性,另外悬浮培养对于大规模生产有很大优势,如可连续扩大生产量,有利于细胞与培养基中的营养物质和气体充分接触,而且易于控制培养条件(温度、pH、氧气分压和二氧化碳等),培养条件稳定,趋于均一,便于进行定量研究,于在连续密封的系统中进行,减少了操作步骤和污染的机会,可以长期连续培养,既可节省人力,又使细胞能持续维持在对数生长期。单克隆抗体是特异性很强的药物,如果可以很好的解决免疫原性的问题,它应用于肿瘤或其他疾病应比其他药物的副作用低得多。从长远来看,作为治疗用品,有着广阔的前景,从商业的角度来讲,治疗性抗体的市场也将是巨大的,随着基因组学和蛋白组学的发展,越来越多的基因及其相关蛋白的发掘,与肿瘤和其他疾病相关的抗原就成为了治疗性抗体研究的主要靶标,治疗性单抗将在人类疾病治疗中扮演重要角色[8-10]。
3.2 结论
通过构建表达质粒PD-1、细胞转染、加压筛选、有限稀释获得高表达PD-1抗体的单克隆。14天流加培养抗体表达量最高的2个克隆01C42和01C90抗体表达量为2.03 g/L和2.09 g/L。2个亚克隆所携带的目的基因序列与理论序列完全相同,所表达抗体的分子量与理论分子量一致。经protein A亲和柱纯化后的抗体纯度均高于98%,60个世代的初步传代过程中2个克隆的抗体表达量均未降低,倍增时间维持在20~30 h,细胞活率均高于98%。

