一株猪细小病毒7群的鉴定和分离
张 志,张丽丽,2,刘 爽,吴发兴,李晓成,王树双
(1.中国动物卫生与流行病学中心,青岛266032;2.青岛农业大学,青岛 266019)
猪细小病毒(Porcine parvovirus,PPV)属于细小病毒科,是一种单股非囊膜线性DNA病毒,基因组大小为4~6.3 kb,由5'端非翻译区、非结构蛋白、结构蛋白和3'端UTR组成[1]。PPV主要引起猪的木乃伊胎、不孕不育、早期胚胎死亡、死胎等繁殖障碍症状,是影响养猪业的重要病原之一。数十年来,随着PPV疫苗的普遍应用,猪细小病毒病的危害逐渐减轻,多呈散发和零星发生[2]。但是,近十年间,随着检测技术的提高和新型检测技术的运用,又陆续从猪体内发现和鉴定了6种不同的细小病毒(PPV2~7)[3-8],根据细小病毒的分子遗传演化特征,国际病毒分类专业委员会重新对细小病毒进行了分类,将细小病毒亚科调整为8个属,这些PPV分别属于不同的细小病毒属,其中,传统的PPV1仍然归属于经典的Prothoparvovirus属,PPV2~3则归属于Tetraparvovirus属,PPV4~6属于Copiparvovirus属[9]。PPV-7是2016年首次从美国健康猪的棉拭子中通过基因组测序发现的新的PPV,它与细小病毒的其他属之间的同源性较低,其病毒的ORF与狐蝠细小病毒2和火鸡细小病毒TP1-2012/HUN[8]毒株之间的同源分别为42.4%和37.9%,因此Palinski等[8]建议把这3种病毒归为一个新的属Chapparvovirus。2017年,我国Xing等[10]提取广东某2个商品代猪场的猪血清DNA,运用PCR方法从中检测到了PPV-7,表明我国已经有PPV-7的感染,但发病猪群的病料中能否直接检测出PPV-7尚未知。为此,本研究从我国某些猪场中采集了病料,进行PPV-7检测,进一步对阳性样品进行了病毒分离鉴定,结果证实我国猪群存在新的PPV-7感染。
1 材料和方法
1.1 样品来源20份猪病料样品,采集自福建省、山东省、河南省等省份的发病猪群。其中10份来自流产胎儿,10份来自保育仔猪。
1.2 主要试剂宝生物染料法荧光定量试剂盒(RR390A)、Premix Ex-Taq酶、pMD18-T载体和DH5α感受态细胞为宝生物工程(大连)有限公司产品,病毒DNA提取试剂盒(DNAZol)、DMEM培养基、胎牛血清、胰酶等为Life公司产品,PK-15细胞由中国动物卫生与流行病学中心畜病监测室保存。
1.3 引物设计参考PPV-7基因组序列(Genbank登录号:KU563733)和参考文献[10]的检测方法,设计引物,详见表1。引物由宝生物工程(大连)有限公司合成。

表1 本文使用的引物Table 1 Primers used in this study
1.4 real-time qPCR检测方法根据DNAZol说明书从猪样品中提取基因组DNA,作为PPV-7 real-time qPCR的模板。real-time qPCR反应体系:Premix EX-Taq反应液12.5 μL,PPV7-F1(10 μmol/mL)、PPV7-R1(10 μmol/mL)和荧光探针PPV7-P1(5 μmol/mL)各1 μL,待测DNA样品 2 μL,用ddH2O 补充至25 μL;real-time qPCR的反应扩增条件:95℃预变性3 min,95℃变性5 s、60℃延伸14 s,共45个循环,60℃读取荧光。
1.5 常规PCR检测方法对real-time qPCR方法检测PPV-7阳性样品再进行常规PCR扩增。常规PCR扩增引物为PPV7-3430F和PPV7-3675R,序列见表1,预期扩增246 bp大小的序列。常规PCR的反应体系:25 μL 2×Premix,1 μL PPV7-3430F(10 μmol/mL),1 μL PPV7-3675R(10 μmol/mL),2 μL样品DNA模板,补充ddH2O至50 μL。PCR的反应程序:95℃预变性3 min,95℃变性 30 s、55℃ 退火30 s,72℃ 延伸30 s,共33个循环,72℃延伸10 min,然后电泳观察扩增结果。
1.6 测序和测序结果分析将常规PCR扩增产物与pMD18-T载体连接,并转化DH5α感受态细胞,筛选阳性质粒并测序。选择GenBank中已登录的PPV1~6等其他6种不同属的细小病毒毒株和2株PPV-7毒株的序列作为参考毒株序列(表2),利用DNAStar和CLUSTALW1.83等软件进行核苷酸序列比对、同源性分析,利用MEGA 5.0软件构建系统进化树,并以Bootstrap值1000验证进化树的可信度。
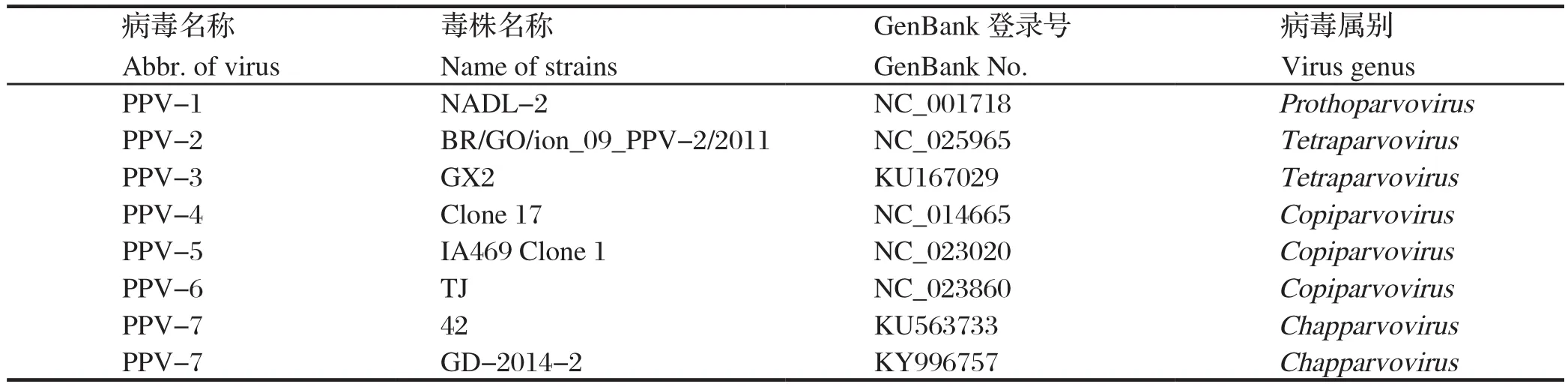
表2 本文构建同源进化树选择的参考毒株Table 2 Some reference strains selected to construct the homology tree in this study
1.7 其他病原的检测采用参考文献[11]方法,同时检测1.4提取的样品DNA中是否存在猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒2型(Porcine circovirus 2,PCV 2)、猪伪狂犬病病毒(Pseudorabies virus,PRV)、牛病毒性腹泻病毒(Bovine viral diarrhea-mucosal disease virus,BVDV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪乙型脑炎病毒(Porcine encephalitis virus,PEV)。
1.8 病毒分离和传代将PPV-7的阳性样品同步接种PK-15细胞,3 d后将接种细胞冻存,然后再继续同步接种PK-15细胞,如此连续传代5次,记录有无细胞病变。
2 结果
2.1 样品中PPV-7的检测结果real-time qPCR方法检测10个流产胎儿样品和10个保育仔猪样品显示,10个流产胎儿样品中未检测到PPV-7,但10个保育仔猪样品中有1份样品阳性,详见图1。同时,常规PCR方法的检测结果显示,该样品可以扩增出1条246 bp左右的特异性条带,而其他样品均未扩增出特异性条带,见图2。
2.2 序列分析将扩增产物连至PMD18-T载体,筛选阳性质粒,送去测序。结果显示,该序列长度为246 bp,与PPV1~6的同源性分别为36.1%、32.9%、37.0%、39.8%、40.2%、30.9%,与另外2株PPV7(42和GD-2014-2)的同源性分别为99.6%和98.0%,见图3,这表明该毒株为PPV-7属的病毒。本研究获得的PPV-7毒株序列与PPV-7 2株参考毒株类似,在第3059处发生一段10 bp的缺失,而PPV-1、PPV-4、PPV-5和PPV-6等属只有6个bp的缺失,PPV-2和PPV-3在此位置无缺失,见图4。从遗传进化树上也可以看出,本文所得到的阳性样品中的病毒与PPV-7的其他株病毒属于同一个进化分支,见图5。
2.3 其他病原的检测结果对样品中的CSFV、PCV2、PRV、BVDV、PRRSV、PEV 6种病原体检测结果均为阴性。
2.4 PPV-7的细胞分离结果将鉴定PPV-7阳性样品接种至PK-15细胞,培养3 d均未发现明显的细胞病变,连续传代5次后,均未发现明显的细胞病变,接毒细胞与阴性正常细胞的形态没有明显差异。但取上清液进行real-time qPCR时发现,每一代次的上清液均可以检测出PPV-7,而且不同代次之间的Ct值有所变化。第1~5代的Ct值分别为24.04、27.21、29.56、29.39、31.12,Ct值呈逐渐下降的趋势,这表明PPV-7尽管能在PK-15细胞上生长和增殖,但适应性并不好,所以其滴度不高。
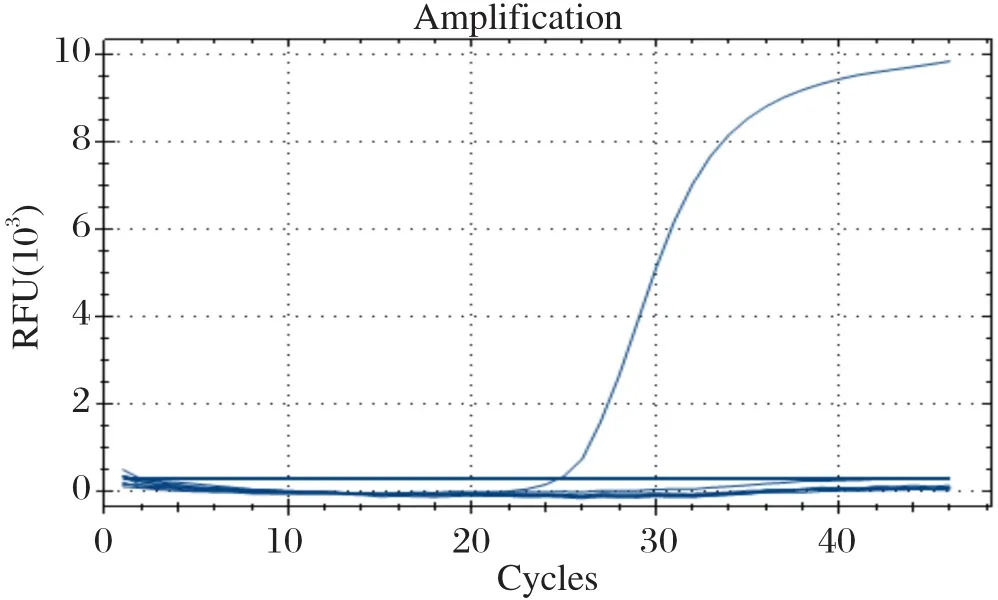
图1 20份样品中PPV-7的real-time qPCR检测结果Fig.1 Ampli fication of PPV-7 from 20 samples by real-time qPCR
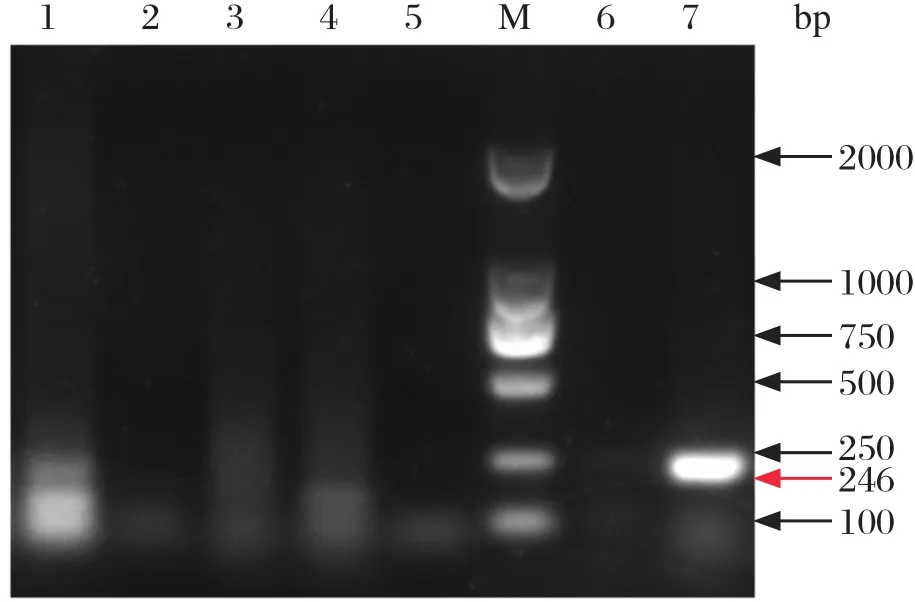
图2 样品中PPV-7的PCR检测结果Fig.2 PPV-7 detection of samples from nursery piglets byPCR
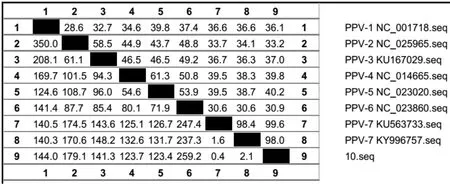
图3 不同细小病毒毒株同源性比较Fig.3 The homology analysis of different PPV strains
3 讨论
近年来,二代测序、三代测序等高通量测序技术得到了快速发展,这些新技术在新病原检测上的应用日益广泛,由此一些新病原体不断被发现[12-13]。在猪细小病毒中,PPV-7和PPV-6都是首先利用高通量检测技术发现的新型猪细小病毒[8,14],随后开展的病毒全基因组测序和流行病学研究也是基于此,高通量测序技术已经成为开展疫病流行病学监测和调查等研究工作必不可少的技术之一。本研究最初设计时拟先对20份样品进行PPV-7的检测,如果没有发现PPV-7,则进行高通量测序,结果检测出阳性样品,其序列与PPV-7参考株42和GD-2014-2间的同源性分别为99.6%和98.0%,根据病毒分类规则,如果病毒之间的同源性超过了85%,则属于同一种病毒,这表明该病毒为PPV-7。并且该样品中同时没有检测到猪瘟等多种病毒,下一步拟通过高通量测序技术,进一步确证该样品中存在哪些病原体。
细小病毒感染的宿主众多,猪、鸭、鹅、虎、犬等都可以感染[15-17],这就导致细小病毒的分类比较复杂,根据ICTV的分类[9],细小病毒亚科分为8个属,除此以外还有一些细小病毒的分类地位没有确定,Palinski等[8]建议新建一个属Chapparvovirus,将PPV-7归于其中,但由于目前的PPV-7毒株较少,这一新的细小病毒属尚存在争议。本文新发现的PPV-7病毒为该属的确立提供了更多的证据。

图4 不同细小病毒毒株序列的对比分析Fig.4 The comparison of DNA sequences among PPV strains
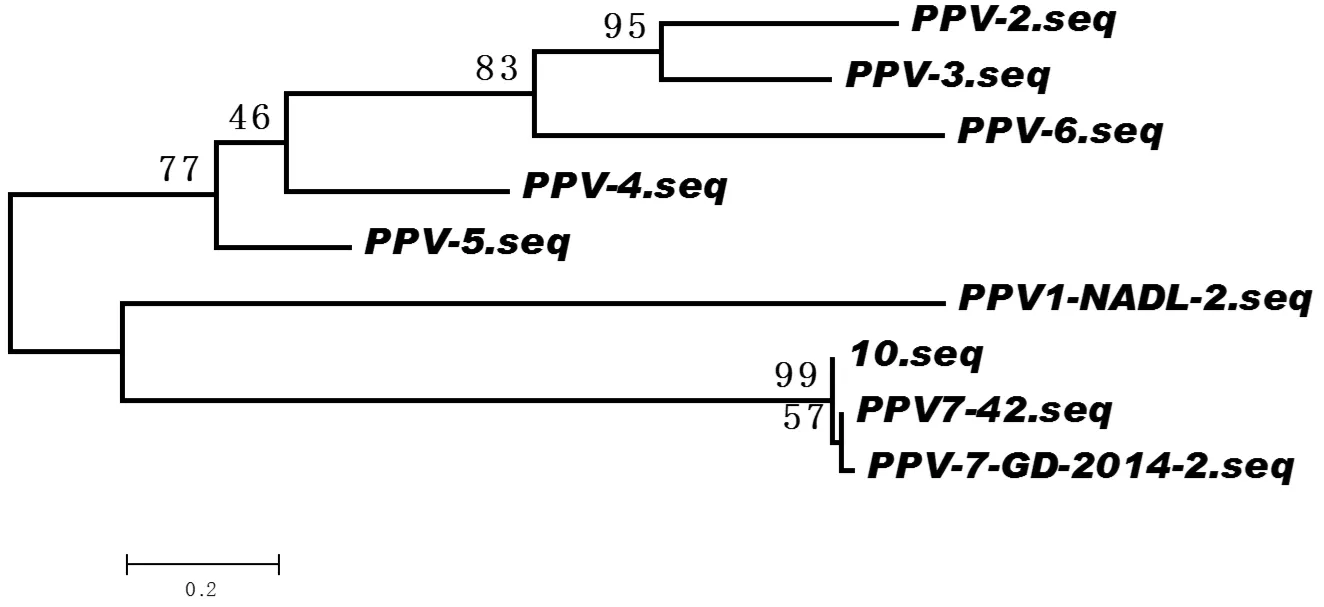
图5 不同细小病毒毒株的进化树分析(ML法)Fig.5 The phylogenetic tree of different PPV strains using maximum likelihood estimators
经典PPV引起猪的临床症状主要是流产、死产、木乃伊、死胎和不育[18],因此本研究在选择样品时,分别选择了10份流产胎儿和10份保育仔猪的样品进行检测,结果保育仔猪样品中检测到了PPV-7,而流产胎儿没有检测到PPV-7,这是否意味着流产并不是PPV-7引起的主要症状?由于本研究采集的样品较少,这一推测还需要更多的实验数据验证。对于近年来发现的PPV-2~7等几种新细小病毒属来说,不但这些病毒的组织分布比较广泛、组织亲嗜性也不相同,如PPV-4首先从肺灌洗液中发现,PPV-5首先发现于肺组织中,PPV-6首先从流产胎儿中发现,PPV-7首先发现于成年猪的直肠棉拭子和血清中,而且除了PPV-1以外,其他属病毒的致病性尚不明确,不同属之间病毒的致病性差别也较大[7,19-20]。本研究采集的病料来自流产胎儿和保育仔猪,结果发现保育仔猪中也可以检测到PPV-7,这一结果提示,在PPV-7采样监测时选择保育仔猪的样品似乎更好。
美国学者Palinski等[8]报道,采集的不同样品中,PPV-7的感染率不同,95份血清中2份检测到PPV-7,29份直肠和鼻腔棉拭子中5份检测到PPV-7,29份肺灌洗液中4份检测到PPV-7。而我国Xing等[10]从2个猪场的64份血清中21份检测到PPV-7,而这些血清均来自2014年,至今已有3年的历史,这表明我国的PPV-7感染至少可以追溯到3年以前。更令人担心的是,3年来国内无人对PPV-7的感染和流行状况做过任何研究,也没有采取过任何相关措施。
另外,PPV的生长和增殖的细胞比较多,如PK-15、PT、PFT和PK等[21],本研究在不清楚PPV-7生长特性的前提下参照经典PPV-1毒株的分离和培养方法,用PK-15细胞对PPV-7阳性样品进行了同步接毒和连续盲传,但盲传至5代时仍未见到明显的细胞病变,而上清液中仍然可以检测PPV-7核酸,说明PPV-7能在PK-15细胞中增殖,但PK-15不是其最佳的培养细胞或者在PK-15细胞上的培养条件还需要改进和提高,从而增加病毒的滴度。

