利用BiFC技术研究柔嫩艾美耳球虫顶膜抗原1结构域Ⅰ与棒状体颈部蛋白2互作关系
严 茗 ,黄 兵 ,赵其平 ,韩红玉 ,朱顺海 ,赵宗平 ,陈 婷 ,吕 凌 ,董 辉
(1.上海师范大学生命与环境科学学院,上海 200234;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点实验室,上海 200241)
球虫病是一种严重危害养鸡业发展的全球性寄生虫病,全世界每年因球虫病造成的损失及防治费用达20亿英镑[1]。目前,防治球虫病仍以抗球虫药物为主,但随着药物的不断使用,球虫抗药性日益严重,加上兽药残留引起的食品安全问题也日益受到人们的重视[2],迫切需要更为理想的球虫病防治方法。鸡球虫的生活史包括细胞外的孢子生殖和细胞内的裂殖生殖和配子生殖[3],其中子孢子入侵宿主细胞是建立感染体系最为重要的阶段[4],阻断子孢子的入侵将是防治球虫病的有效方法。所以,筛选、鉴定与球虫子孢子入侵相关的关键分子,对阐明球虫入侵的分子机制、研制抗球虫病疫苗和防治新型药物等具有重要意义。
顶膜抗原1(apical membrance antigen 1,AMA1)是顶复器门原虫中一种高度保守的微线体I型蛋白[5],最早从诺氏疟原虫(Plasmodium knowlesi)[6]裂殖子的顶端复合体中发现,随后在弓形虫(Toxoplasma)[7]、牛巴贝斯虫(Babesia bovis)[8]、犬新孢子虫(Neospora caninum)[9]、小泰勒虫(Theileria parva)[10]、艾美耳球虫(Eimeria)[11]中有相继报道。在疟原虫和弓形虫中的研究表明,AMA1是顶复器门原虫入侵关键结构——运动连接环(moving junction,MJ)的重要组成成分[12],其胞外区与棒状体颈部蛋白2(rhoptry neck protein 2,RON2)的羧基端结合后,再与其他棒状体颈部蛋白连接形成复合物,结合在MJ上,对虫体入侵宿主细胞至关重要[13]。因此,AMA1与RON2发生互作是顶复器门原虫MJ依赖型入侵的关键步骤,且在顶复器门原虫中是保守的[14]。
相比弓形虫与疟原虫,鸡球虫AMA1蛋白的研究还很少,至今尚无确定的互作蛋白的报道。本研究旨在利用双荧光互补实验(bimolecular fluorescence complementation,BiFC)技术,分析柔嫩艾美耳球虫AMA1结构域Ⅰ(Eimeria tenellaapical membrance antigen 1 domainⅠ,EtAMA1-DⅠ)与棒状体颈部蛋白2(Eimeria tenellarhoptry neck protein 2,EtRON2)之间互作关系,为深入研究EtAMA1及EtRON2在球虫入侵过程中的功能与作用机制奠定基础。
1 材料与方法
1.1 主要材料与试剂柔嫩艾美耳球虫(资源编号:CAAS21111611)、pBiFC-bFos(deltaZIP)VC155、pBiFC-bFos(delta)VC155、pBiFCVC155、pBiFC-bJunVN155、pBiFC-VN155、仓鼠肾细胞(baby hamster kidney,BHK)由中国农业科学院上海兽医研究所动物原虫病创新团队保存。大肠杆菌TOP10感受态细胞、琼脂糖凝胶DNA回收试剂盒、2×TaqPCR Master Mix、质粒小提试剂盒购自天根生化科技(北京)有限公司;GeneRacerTM Kit、限制性内切酶EcoRⅠ和BgI II 购自TaKaRa公司;胃蛋白酶购自生工生物工程(上海)股份有限公司;BSA、透明质酸酶购自与Sigma公司;胎牛血清(fetal bovine serum,FBS)、Opti-MEM、DEME购自美国Gibco公司;M-MLV Reverse Transcriptase Kit、Lipofectamine 2000 购自Invitrogen 公司;FITC标记山羊抗兔IgG购自Jackson Immuno Research公司;去内毒素大提质粒试剂盒购自于Thermo scientific 公司。
1.2 引物设计根据NCBI中EtAMA1基因的结构域Ⅰ序列(GenBank登录号:LN610018.1)和EtRON2基因的N端序列(GenBank登录号:XM013375678),并结合pBiFC-VC155、pBiFC-VN155真核质粒载体中含有的酶切位点,应用Primer Premier 5.0软件分别设计带有双酶切位点的引物,EtAMA1-DI-UP:5'-GCGAATTCATGGGGCCACCCCCGTCTTTGG CAAAAAC-3',EtAMA1-DⅠ-LOW:5'-GCAGA TCTGCACTTGGTCTCCCAGTCG-3'(划线碱基分别为EcoRⅠ和BgIII位点),EtRON2-UP:5'-GC GAATTCGGGCCACCATGGGGGTTTTCTCCCGCC TG-3',EtRON2-LOW:5'-GCAGATCTGTTGAG AATCATCTCCGTGGCGTC-3'(划线碱基分别为EcoRⅠ和BgIII位点)。预计扩增获得的EtAMA1-DⅠ和EtRON2的序列长度分别为492 bp 和1395 bp。
1.3 cDNA模板的制备取保存6个月内的柔嫩艾美耳球虫孢子化卵囊接种2周龄无球虫鸡,接种后7 d收集盲肠中的卵囊,置于2.5%重铬酸钾溶液中培养至孢子化。参照索勋等[15]方法纯化孢子化卵囊,参考文献[16]方法纯化子孢子,采用Trizol方法提取子孢子总RNA。取少量RNA经1%琼脂糖凝胶电泳分析,结果由上到下出现3条大小不一的条带,分别依次为28S、16S和5S,表明总RNA提取合格。用M-MLV Reverse Transcriptase Kit将符合要求的总RNA反转录为cDNA。
1.4 目的基因EtAMA1-DⅠ和 EtRON2的PCR扩增以反转录成功的cDNA第一条链为模板,利用合成的特异性引物进行PCR扩增,反应体系:cDNA模板3 μL,2×TaqPCR Master Mix 25 μL,上、下游引物各1 μL,ddH2O 20 μL,总体积共50 μL。扩增EtAMA1-DⅠ反应体系:94℃预变性2 min;94℃变性30 s,56℃退火40 s,72℃延伸2 min,共35个循环;72℃延伸10 min。EtRON2扩增条件:94℃预变性2 min;94℃变性30 s,58℃退火40 s,72℃延伸2 min,共30个循环;72℃延伸10 min。用1%琼脂糖凝胶进行结果分析,回收目的片段。回收产物在16℃条件下与pGEM-T-easy 载体连接3 h,转化大肠杆菌感受态细胞(TOP10),37℃过夜培养后挑取白色单菌落,PCR鉴定后测序,并对所获得的序列进行生物信息学比对分析。
1.5 真核重组表达质粒的构建分别将测序结果正确的克隆质粒pGEM-EtAMA1-DⅠ和pGEMEtRON2、真核表达载体pBiFC-VN155和pBiFCVC155用EcoRⅠ和BgIII进行双酶切。将回收的目的片段EtAMA1-DⅠ、EtRON2分别与双酶切的真核表达载体pBiFC-VN155、pBiFC-VC155连接。将鉴定正确的真核重组质粒命名为pBiFC-VN155-EtAMA1-DⅠ和pBiFC-VC155-EtRON2。
1.6 真核重组质粒的转染按照去内毒素大提质粒试剂盒说明书,提取构建成功的真核重组表达质粒pBiFC-VN155-EtAMA1-DⅠ、pBiFC-VC155-EtRON2和真核质粒空载体,以备转染用。转染前,将BHK细胞接种于6孔板,置于37℃、5%CO2培养箱中培养至80%时,参照Lipofectamine 2000脂质体说明书进行转染。置于37℃、5%CO2细胞培养箱中继续培养6 h,将Opti-MEM转染细胞液更换为含5%FBS的DMEM培养基,继续培养30 h。
1.7 间接免疫荧光鉴定(indirect immunofluorescence assay,IFA)真核重组质粒在BHK细胞中表达取1.6转染后36 h的BHK细胞,去除培养基,用2%多聚甲醛在室温下固定20 min,PBS洗涤3次。滴加2 mL 1%TritonX-100室温放置20 min至细胞透明,PBS洗涤3次,加入2%BSA-PBS,4℃封闭过夜。移去封闭液,用PBS洗涤干净后,每孔加入以1∶50稀释的抗柔嫩艾美耳球虫子孢子蛋白兔血清,37℃放置3 h,用PBS洗去未结合的多抗,加入1∶500稀释的FITC标记绿色荧光抗兔二抗,37℃避光孵育1 h,用PBS浸泡洗涤干净后,置于倒置荧光显微镜下观察。
1.8 双分子荧光互补技术(bimolecular fluorescence complementation,BiFC)检测EtAMA1-DⅠ与EtRON2互作关系将BHK细胞接种于6孔板中,培养至孔内细胞增殖到80%。分别设置实验组(pBiFC-VN155-EtAMA1-DⅠ和pBiFCVC155-EtRON2)、阳性对照组(pBiFC-bJunVN155和pBiFC-bFos(deltaZIP)VC155)、阴性对照组(pBiFC-bFos(delta)VC155和pBiFC-bJunVN155),将两质粒共转染BHK细胞。转染完毕后,加入无血清的Opti-MEM培养基置于37℃、5%CO2培养箱中培养6 h,更换培养基为完全培养基继续培养30 h,取出6孔板置于倒置荧光显微镜下观察。
2 结果
2.1 EtAMA1-DⅠ和EtRON2的PCR扩增以柔嫩艾美耳球虫子孢子cDNA为模板,利用含酶切位点的特异性引物进行PCR扩增,回收目的条带与pGEM-T-easy载体连接。结果显示,EtAMA1-DⅠ约在500 bp、EtRON2约在1500 bp处均出现明显的条带,分别与预期结果492 bp和1395 bp相符合(图1)。经BLAST比对,发现所获得的492 bp和1395 bp基因片段分别与EtAMA1基因(GenBank登录号:LN610018.1)和EtRON2基因(GenBank登录号:XM013375678)序列相似性为100%,证明已成功扩增两个目的基因。
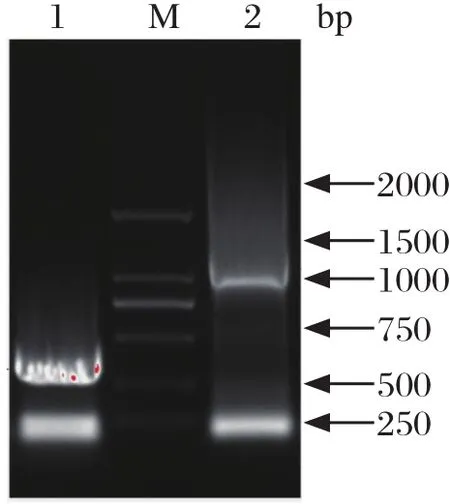
图1 EtAMA1-DⅠ和EtRON2的PCR扩增结果Fig 1 The PCR results of EtAMA1-DⅠ and EtRON2 M: DNA分子量标准(DL2000); 1: EtAMA1-DⅠ; 2: EtRON2 M: DNA Marker DL2000; 1: EtAMA1-DⅠ; 2: EtRON2
2.2 真核重组质粒构建及鉴定重组克隆质粒以及真核表达载体pBiFC-VN155和pBiFC-VC155经EcoRⅠ和BgIII酶切,回收目的片段,构建真核重组质粒pBiFC-VN155-EtAMA1-DⅠ和pBiFC-VC155-EtRON2,双酶切鉴定为阳性(图2),测序结果显示目的片段正确插入到载体当中,无移码和突变现象。

图2 重组质粒pBiFC-VN155-EtAMA1-DⅠ和pBiFCVC155-EtRON2的双酶切鉴定Fig.2 Identi fication of the recombinant plasmids pBiFCVN155-EtAMA1-DⅠ and pBiFC-VC155-EtRON2 by restriction enzymes digestion
2.3 IFA鉴定真核重组表达质粒在BHK细胞中表达分别将鉴定正确的真核重组质粒pBiFC-VN155-EtAMA1-DⅠ、pBiFC-VC155-EtRON2转染BHK细胞,培养箱中培养30 h后,取出细胞进行固定、透明、封闭、抗体孵育,与只转染真核空载体pBiFCVN155的阴性对照组比对。结果显示,转染pBiFCVN155-EtAMA1-DⅠ和pBiFC-VC155-EtRON2的BHK细胞可清晰观察到特异的绿色荧光,而转染真核空载体pBiFC-VN155的BHK细胞无任何可见的绿色荧光(图3),表明pBiFC-VN155-EtAMA1-DⅠ和pBiFC-VC155-EtRON2在BHK细胞成功表达了EtAMA1-DⅠ和EtRON2。
2.4 BiFC检测EtAMA1-DⅠ与EtRON2的互作关系将成功构建的真核重组质粒pBiFC-VN155-EtAMA1-DⅠ和pBiFC-VC155-EtRON2进行BiFC实验,结果发现真核重组质粒共转染组和阳性对照组的BHK细胞均产生绿色荧光,而阴性对照组无荧光(图4),说明EtAMA1-DⅠ与EtRON2之间存在互作关系。
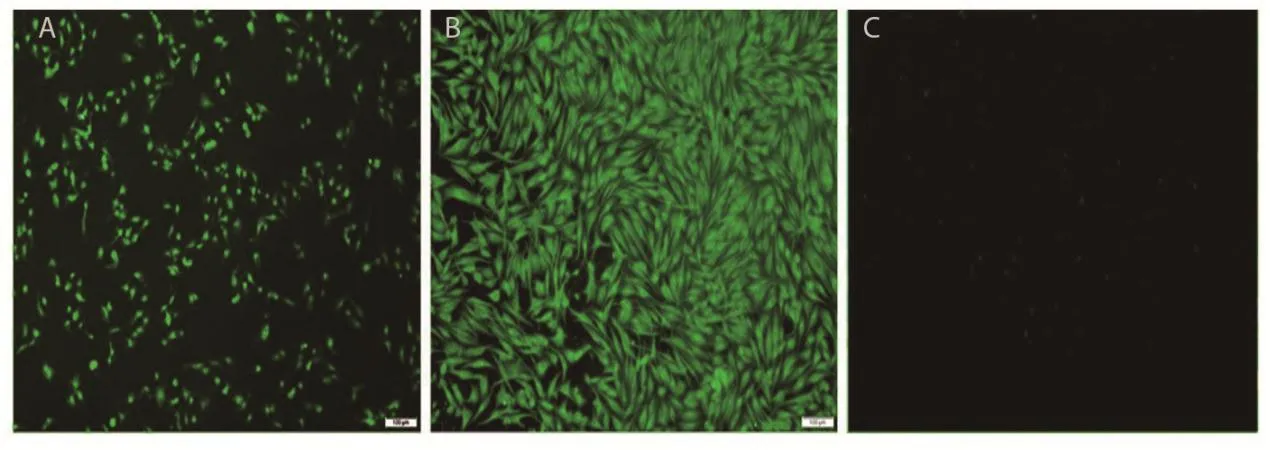
图3 间接免疫荧光检测Fig.3 IFA detection
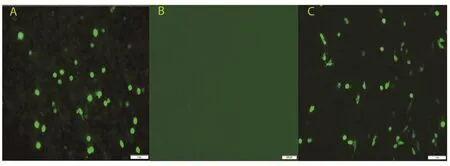
图4 BiFC分析EtAMA1-DⅠ与EtRON2之间互作关系Fig.4 Interaction analysis between EtAMA1-DⅠ and EtRON2 by BiFC
3 讨论
AMA1是微线体分泌的一类高度保守的蛋白,由N端胞外区(ectodomain)、跨膜区(transmembrnae domain)和C端胞浆区(cytoplasmic domain)组成[5]。胞外区含有16个半胱氨酸[17],形成8对分子内二硫键,根据二硫键的位置关系,可将胞外区分为3个相对独立的二硫键依赖的亚区(subdomain)[18],即区域Ⅰ、Ⅱ和Ⅲ(DⅠ、DⅡ和DⅢ)。在疟原虫和弓形虫中的研究表明,AMA1与棒状体颈部蛋白(hoptry neck proteins,RONs)复合物结合形成运动连接环(moving junction,MJ),是虫体成功入侵宿主细胞的关键。AMA1是通过RON2与其他RON蛋白连接形成复合物(RON2/4/5/8),结合在MJ上,对虫体入侵宿主细胞至关重要[19]。AMA1的胞外区与RON2之间的相互作用在顶复器门原虫是保守的[20]。
EtAMA1含有536个氨基酸(amino acid,aa),其中第1~23个aa为信号肽,第24~106个aa为前导序列,第107~446个aa为胞外区,第447~469个aa为跨膜区,470~536个aa为胞内区[21]。其中胞外区分为DⅠ(107-271)、DⅡ(289-373)和DⅢ(397-440)结构域,分别含有3对、2对和3对二硫键[22]。本实验室通过研究EtAMA1不同结构域对柔嫩艾美耳球虫子孢子入侵的影响,发现浓度在200 μg/mL时,DⅠ结构域抗体能明显抑制子孢子的入侵,表明DⅠ在子孢子入侵宿主过程中发挥重要作用。EtRON2的ORF全长4206 bp,编码1401个aa。我们利用在线软件(www.predictprotein.org)对其连接位点(binding sites)进行了预测,发现其共有5个蛋白-蛋白连接位点,分别在第1、65、113、405、421和1401位氨基酸,主要位于氨基酸的N端。本文对EtAMA1-D I与EtRON2 N端之间的潜在互作关系进行了研究。
目前,用于两蛋白互作的验证方法主要包括酵母双杂交技术、GST-pulldown技术、免疫共沉淀、BiFC等,其中BiFC技术把荧光蛋白在指定位置处分割为2个不发荧光的N片断和C片断,然后将2个片段分别连接在1对目标蛋白上,在细胞内共表达或体外融合,若两个目标蛋白互作,则促进荧光片段在空间上也开始相互吸引并靠拢,最后重新构成完整的具有活性的可发出荧光的蛋白[23],若不互作,则不发荧光的2个片段不能自发组装成完整的发光蛋白[24]。由于该技术实验步骤简单,无需试剂检测,可在活细胞生理状态下借助荧光显微镜直接观察,使得BiFC 技术被广泛应用到互作蛋白的验证中。利用这一技术,曹建美[25]发现玉米MAPK5与bZIP72蛋白在植物细胞核内发生相互作用。葛静怡等[26]初步验证氧化低密度脂蛋白(Lox-LDL)可以诱导血凝素样氧化低密度脂蛋白受体-1(LOX-1)与血管紧张素Ⅱ 1 型受体(AT1 受体)特异性相互作用。王丰青等[27]发现烟草中介体亚基Med8与Med18、Med6与Med18以及Med8与Med6之间存在互作。
尽管重组质粒在原核中表达可收集到大量蛋白,但原核表达载体自身缺乏对蛋白的修饰加工装置,因此合成的蛋白不具有天然构像和活性[28]。本文采用真核表达技术构建真核重组质粒pBiFCVN155-EtAMA1 DⅠ和pBiFC-VC155-EtRON2,转染至BHK细胞中进行表达,利用IFA从蛋白水平检测到构建的真核重组质粒都成功转入BHK细胞,且细胞形态无变化,说明构建的重组质粒在真核细胞中具有翻译表达的能力,为后续的BIFC实验奠定了扎实的基础。目前,将目的基因成功导入真核细胞内的最为常见转染方法有磷酸钙法、显微注射、电穿孔法以及脂质体介导等[29]。本次实验用到的Lipofectamine 2000脂质体,是一种带正电荷阳离子的新型商品化的转染试剂,在转染过程中使用的细胞量较少,转染后细胞损伤度低,易操作,与传统脂质体相比,它的转染效能较高且转染基因高表达,在实验研究中广泛被应用[30]。
我们利用构建的真核重组质粒pBiFC-VN155-EtAMA1-DⅠ、pBiFC-VC155-EtRON2进行共转染,BiFC结果显示,实验组和阳性对照组的BHK细胞中均出现特异性的绿色荧光,而阴性对照组无绿色荧光,表明EtAMA1-DⅠ与EtRON2之间存在互作关系,该研究结果为深入研究EtAMA1及EtRON2在球虫入侵过程中的功能与作用机制奠定基础。

