NDRV σC蛋白互作的宿主因子筛选及生物信息学分析
肖 容,杜夏夏,李传峰,马文戈,米晓云,刘光清,周海龙,陈宗艳
(1.海南大学农林学院,海口570228;2.中国农业科学院上海兽医研究所,上海 200241;3.新疆畜牧科学院,乌鲁木齐830000)
禽呼肠孤病毒(Avian reovirus,ARV)属于呼肠孤病毒科,正呼肠孤病毒属,能感染多种禽类,传播范围广泛[1]。禽呼肠孤病毒感染水禽的报道最初仅见于番鸭,称为番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)[2],研究表明ARV和MDRV对我国的北京鸭以及其他品种鸭不具有感染性[3]。随着养鸭业的不断发展,呼肠孤病毒病感染不同品种鸭也见报道,但是由于流行区域、发病种群和发病时间的不同,呼肠孤病毒感染鸭表现出不同程度的差异。2008年刘红等[4]从广州某处病鸭中分离到1株呼肠孤病毒DRV-GZ株,2009年陈少莺等[5]发现1株鸭呼肠孤病毒(Duck reovirus,DRV),此毒株与典型的MDRV在致病性和基因结构上存在差异。2011年,本实验室通过对安徽太湖县鸭疫情诊断分析,鉴定该疫情是由新型鸭源呼肠孤病毒引起,命名为NDRV-TH11(Novel duck reovirus,NDRV-TH11)株[6]。与以往报道的DRV相比,NDRV-TH11致病性更强、感染范围更广、病死率更高、宿主谱更广,给养鸭业带来了严重的经济损失。目前,仍然不断存在NDRV的分离报道[7-9]。
禽呼肠孤病毒无囊膜包被,具有二十四面体双层衣壳,基因组由10个双链RNA基因片段组成(L1、L2、L3、63 M1、M2、M3、S1、S2、S3和S4),10个基因节段编码至少10个结构蛋白(λA、λB、λC、μA、μB、σA、σB、σC、μBN和μBC)和5个非结构蛋白(μNSC、μNS、σNS、P10和P17)[10]。σC蛋白是由S1基因节段编码的一种结构蛋白,能与宿主细胞受体特异结合启动病毒感染过程,而且该蛋白能诱导细胞产生特异性中和抗体,在持续性免疫选择压力下,该编码基因最容易发生变异以适应比较大的进化压力。此外,σC基因含有侵染宿主细胞膜表面的受体结合位点(Arg-gly-Asp,RGD),是病毒感染的关键因子。
病毒与宿主细胞之间存在着多种多样的蛋白相互作用,形成密不可分的蛋白网络,这些蛋白网络对于调控病毒复制、启动宿主天然免疫反应,发挥着重要的功能。鉴定宿主细胞蛋白与病毒蛋白之间的相互作用是研究病毒蛋白的功能以及在复制过程中作用的关键步骤[11]。为了能更深入的了解与σC蛋白相互作用的宿主蛋白,本研究运用免疫共沉淀法并结合质谱分析技术,筛选出可能与σC蛋白互作的宿主蛋白因子,再结合GO注释、KEGG代谢通路注释,分析预测这些所筛选出的宿主细胞蛋白在病毒的复制和致病过程中所发挥的作用,以期为防控DRV提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞、病毒和载体 鸭胚原代成纤维细胞(duck embryo primary fibroblasts,DEFs)从10日龄鸭胚中制备;真核表达质粒pCMV-HA由本实验室保存;NDRV-TH11毒株由本实验室分离、鉴定及保存。
1.1.2 主要试剂 Anti-HA单克隆抗体购自Sigma-Aldrich 公司,Lipofectamine 2000转染试剂与免疫共沉淀试剂盒购自Thermo Fisher Scientific公司。
1.2 方法
1.2.1 质粒的构建 以NDRV-TH11基因组cDNA为模板,进行σ C基因扩增。上游引物F:5'-CGGAATTCATGGATCGC AACGAGGTGATAC GCC-3',下游引物R:5'-CCGCTCGAGCTAGCCC GTGGCGACGGTGAAGCGTAA-3'。将获得的基因片段插入pCMV-HA载体中,经菌落PCR、双酶切及测序鉴定阳性质粒,命名为pCMV-HA-σC。
1.2.2 间接免疫荧光实验(indirect immunoinfluscent assay,IFA) 将DEFs培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2的培养箱中进行培养。等细胞密度大于90%时,以Lipofectamine 2000将构建的pCMV-HA-σC质粒转染DEFs,转染后36 h进行IFA。PBS清洗3次,用4%多聚甲醛将细胞固定,清洗3次后,以0.5%TritonX-100室温通透15 min,5%脱脂乳37℃封闭2 h,加入Anti-HA抗体4℃孵育过夜后,清洗3次,加入DIPA室温染核10 min后,清洗3次,使用激光共聚焦显微镜进行观察。
1.2.3 免疫共沉淀 将DEFs培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2的培养箱中进行培养。当细胞密度大于90%时,以Lipofectamine 2000将pCMV-HA-σC质粒转染DEFs,转染后36 h收样。同时将pCMV-HA空载体及空细胞作为对照组。具体操作参见免疫共沉淀试剂盒说明书。
1.2.4 银染 将免疫共沉淀的样品加入SDS-PAGE蛋白胶分离,之后用ddH2O清洗2次,加入固定液固定10 min,用10%的乙醇和超纯水各洗涤2次,加入增敏剂孵育1 min,用ddH2O冲洗2次后加入银染增强液染色30 min,快速洗涤2次后加入显影剂,显影至条带清晰,加入少量终止液,稍微混匀,弃去液体,再加入一定体积终止液彻底终止反应。根据实验结果,切取差异条带进行质谱分析和鉴定。
1.2.5 质谱分析 将切取的条带样品脱色完全后冻干,加入40 μL胰蛋白酶缓冲液进行超滤管酶解(filter aided sample preparation,FASP),37℃作用18 h,然后将酶解产物通过毛细管高效液相色谱进行脱盐及分离后进行质谱分析。得到的质谱数据用软件Mascot 2.1和Proteome Discoverer 1.4进行查库鉴定及定量分析。
1.2.6 生物信息学分析 分子生物分析软件包括DNAMAN、Oligo7等;同时采用http://www.geneontology.org、http://www.kegg.jp/等在线分析。
2 结果
2.1 重组真核表达质粒构建以NDRV-TH11总cDNA为模板,设计引物扩增得到σC目的片段,将扩增的目的片段进行纯化后,连接至真核表达载体pCMVHA上,经过菌落PCR、双酶切鉴定以及目的序列测定,将鉴定阳性的重组真核表达质粒命名为pCMVHA-σC。
2.2 间接免疫荧光实验结果以Lipofectamine 2000将pCMV-HA-σC转染DEFs,转染后36 h进行间接免疫荧光实验,结果显示,pCMV-HA-σC可在细胞表达,并主要分布在细胞质中,见图1。

图1 间接免疫荧光实验结果Fig.1 The indirect immunoin fluscent assay results
2.3 免疫共沉淀及银染结果pCMV-HA-σC转染DEFs36 h后,收取细胞样品,用Anti-HA单克隆抗体进行免疫共沉淀,并对共沉淀产物进行SDSPAGE及银染,共找出7条差异条带,见图2。

图2 免疫共沉淀及银染结果Fig.2 The immunoprecipitation and silver staining infected results
2.4 质谱分析将找出的7条差异条带进行脱色并冻干及酶解,酶解产物经毛细管高效液相色谱脱盐及分离后进行质谱分析。结果显示,共鉴定出100个可以与σC进行相互作用的蛋白。将获得的原始质谱数据使用Mascot软件中的串级质谱数据搜索功能(MS/MS Ions search)进行搜索鉴定,筛选获得了6个差异表达量均上升3倍以上与σC蛋白相互作用的宿主细胞相关蛋白(表1)。
2.5 宿主细胞蛋白的生物信息学分析
2.5.1 GO(gene ontology)注释 对质谱筛选出的所有蛋白进行GO注释。GO由细胞结构、分子功能以及生物过程三部分组成。细胞结构分析显示:与σC蛋白互作的宿主细胞蛋白主要分布于细胞器、大分子复合体以及细胞膜等;分子功能显示:与σC蛋白互作的宿主细胞蛋白具有结合能力和酶活性;生物过程结果显示:与σC蛋白互作的宿主细胞蛋白主要参与细胞的代谢过程、应激反应过程、生理调节过程以及免疫过程等,见图3和表2。
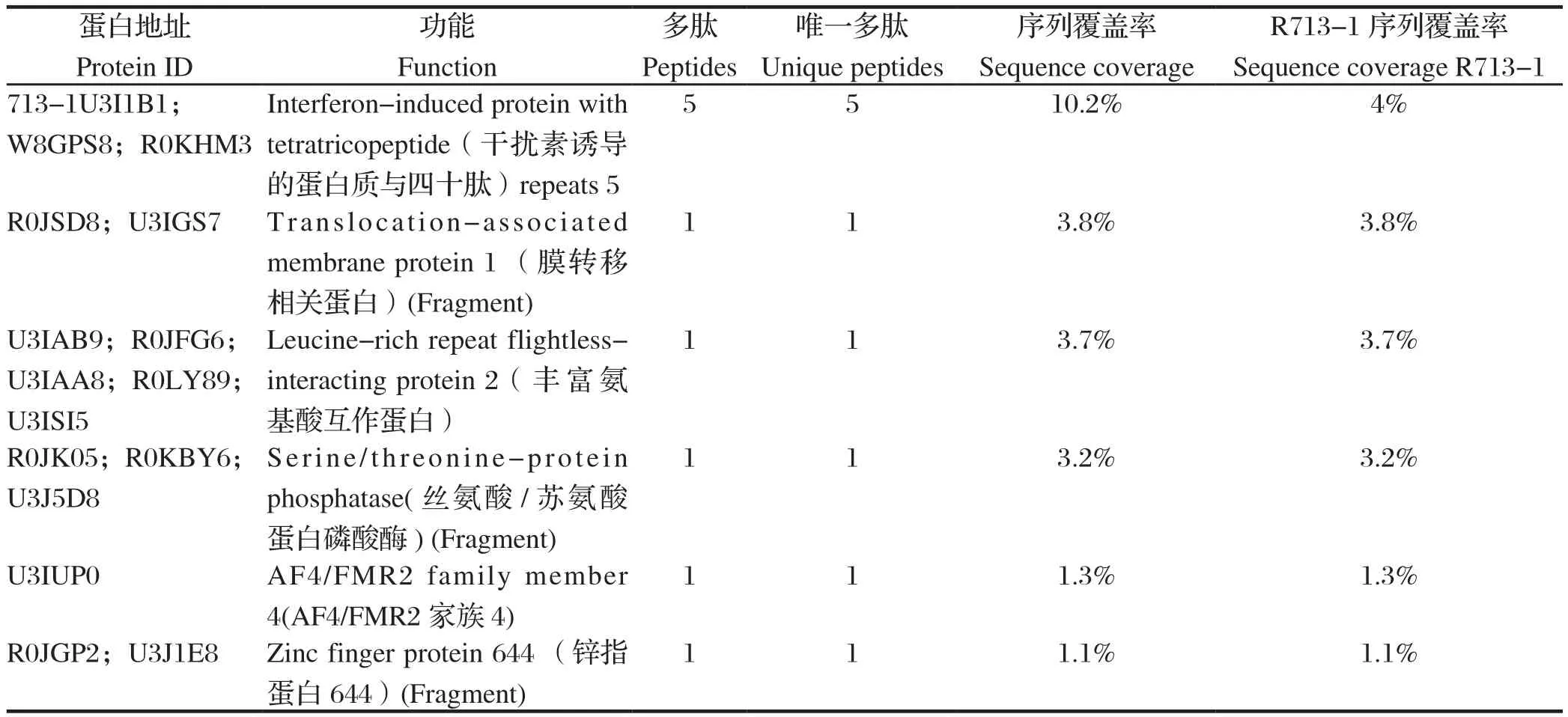
表1 σC免疫共沉淀产物经质谱鉴定获得的潜在相互作用的蛋白质Table 1 Potentially interacting proteins obtained by Co-IP

图3 与σC互作的宿主细胞蛋白的GO功能分析Fig.3 GO function analysis of the cellular proteins interacting with σC
2.5.2 KEGG(kyoto encyclopedia of genes and genomes)代谢通路注释 KEGG是主要的通路公共数据库,通过差异显著性基因来分析该蛋白主要参与的通路与代谢途径。结果显示,与σC蛋白互作的宿主细胞蛋白主要参与氨基酸的生物合成、碳代谢、新陈代谢、嘌呤代谢、转录、翻译、分子信号和互作过程等途径,见图4和表3。

表2 与σC互作的宿主细胞蛋白的GO功能分析Table 2 GO function analysis of the cellular proteins interacting with σC
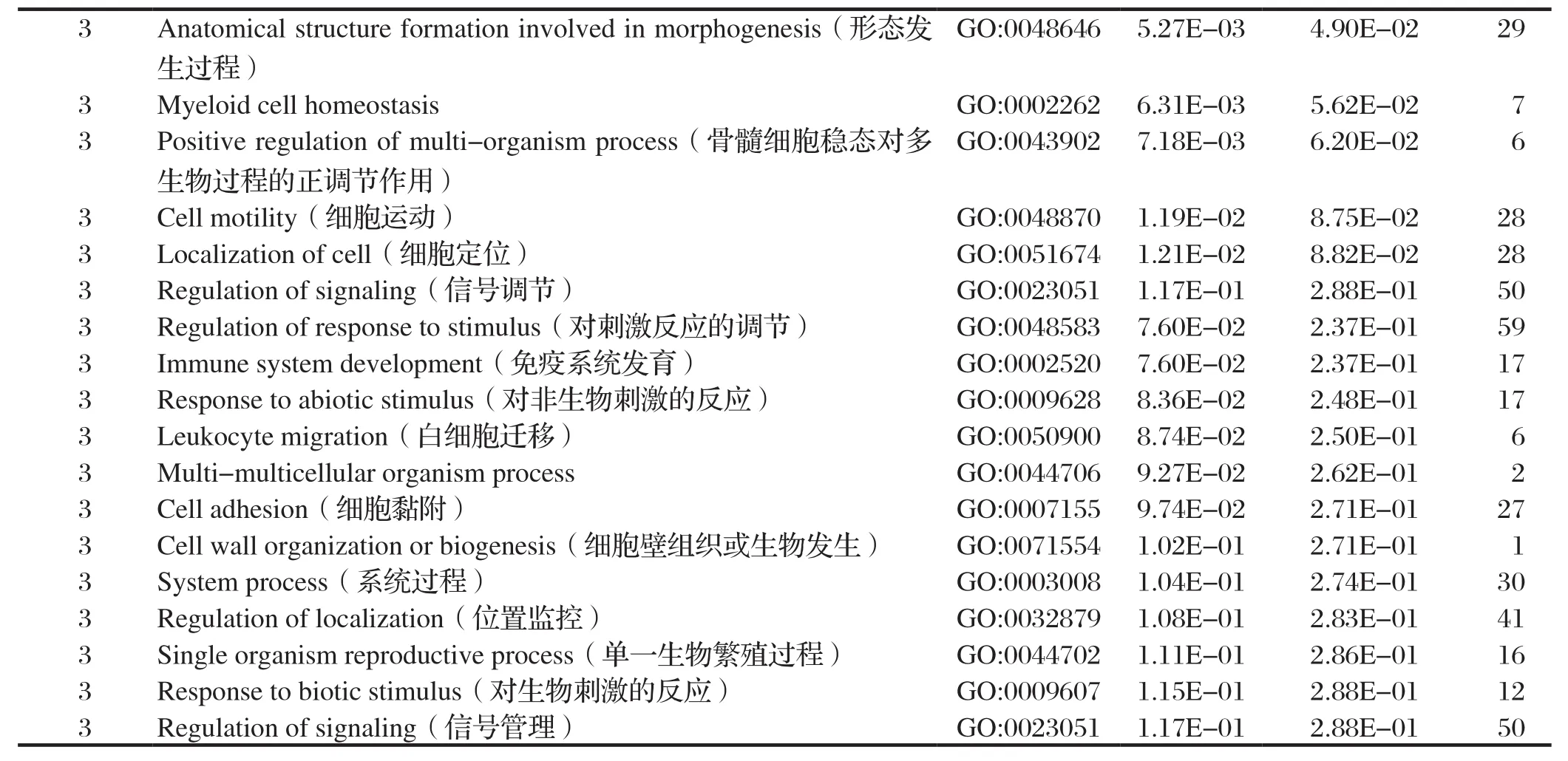
(续上表)
3 讨论
病毒的整个生命活动与宿主细胞因子密不可分,或者是直接利用宿主细胞因子进行自身生命活动;或者是调整、破坏宿主细胞因子,使宿主不能正常行使某些功能,间接为自身的生命活动提供便利。与此同时,宿主细胞也在千方百计地识别外来非细胞因子,并及时清除。病毒能否成功感染宿主细胞,形成有效复制,取决于病毒与细胞之间的作用与反作用,研究病毒的复制过程实际上就是研究病毒与宿主细胞因子相互作用的过程。因此,深入了解DRV在机体内的复制过程,研究病毒蛋白与宿主蛋白之间的相互作用机制,有助于有效控制疫病流行。
NDRV-TH11是一种新型DRV,与以往报道的DRV相比,其宿主谱更广、致病性更强[6]。病毒感染和致病过程是一个复杂的生物过程,但关于NDRV对宿主细胞的感染过程目前还不清楚。病毒无法自身完成复制,其复制必须依赖于宿主细胞系统完成,病毒进入细胞后雇佣宿主蛋白为自身生命活动所用以及宿主蛋白发挥对病毒的拮抗和防御作用都依赖于病毒蛋白和宿主蛋白的相互作用。早期的研究发现病毒外壳蛋白σC与宿主细胞膜表面受体相互作用介导了病毒对细胞的吸附作用,是病毒感染的关键因子[10,12],这提示可以从宿主细胞蛋白角度出发去研究病毒的感染过程,且研究病毒蛋白与宿主细胞蛋白之间的相互作用可以为解析病毒蛋白的功能以及病毒复制的分子机制奠定基础[11-12],所以找到与NDRV σC蛋白互作的宿主细胞蛋白对解析病毒的复制过程具有十分重要的意义。
本研究采用免疫共沉淀与质谱分析相结合的方法,以NDRVσC蛋白作为诱饵蛋白,将免疫共沉淀实验滤液进行银染实验和质谱分析,筛选出可能与病毒蛋白互作的宿主蛋白因子。对筛选的宿主蛋白进行了一系列的生物信息学分析,分析结果显示与σC蛋白互作的宿主因子与蛋白质的代谢过程密切相关,并且参与了蛋白的翻译和复制过程,由此可以推测病毒利用了宿主细胞的翻译系统来完成自身蛋白质的合成,进一步表明σC蛋白在病毒的复制过程中发挥重要作用。此外,分析显示宿主蛋白主要分布于细胞器、大分子复合体以及细胞膜等,而间接免疫荧光实验结果显示pCMV-HA-σC表达产物σC主要分布于细胞质中,可以推测σC与宿主细胞蛋白互作的位点有可能在细胞膜或细胞质中。但这些筛选出的蛋白是否与病毒σC蛋白确实具有相互作用,及其互作位点的位置还需要后续的免疫共沉淀、激光共聚焦、pull-down等实验进行验证。
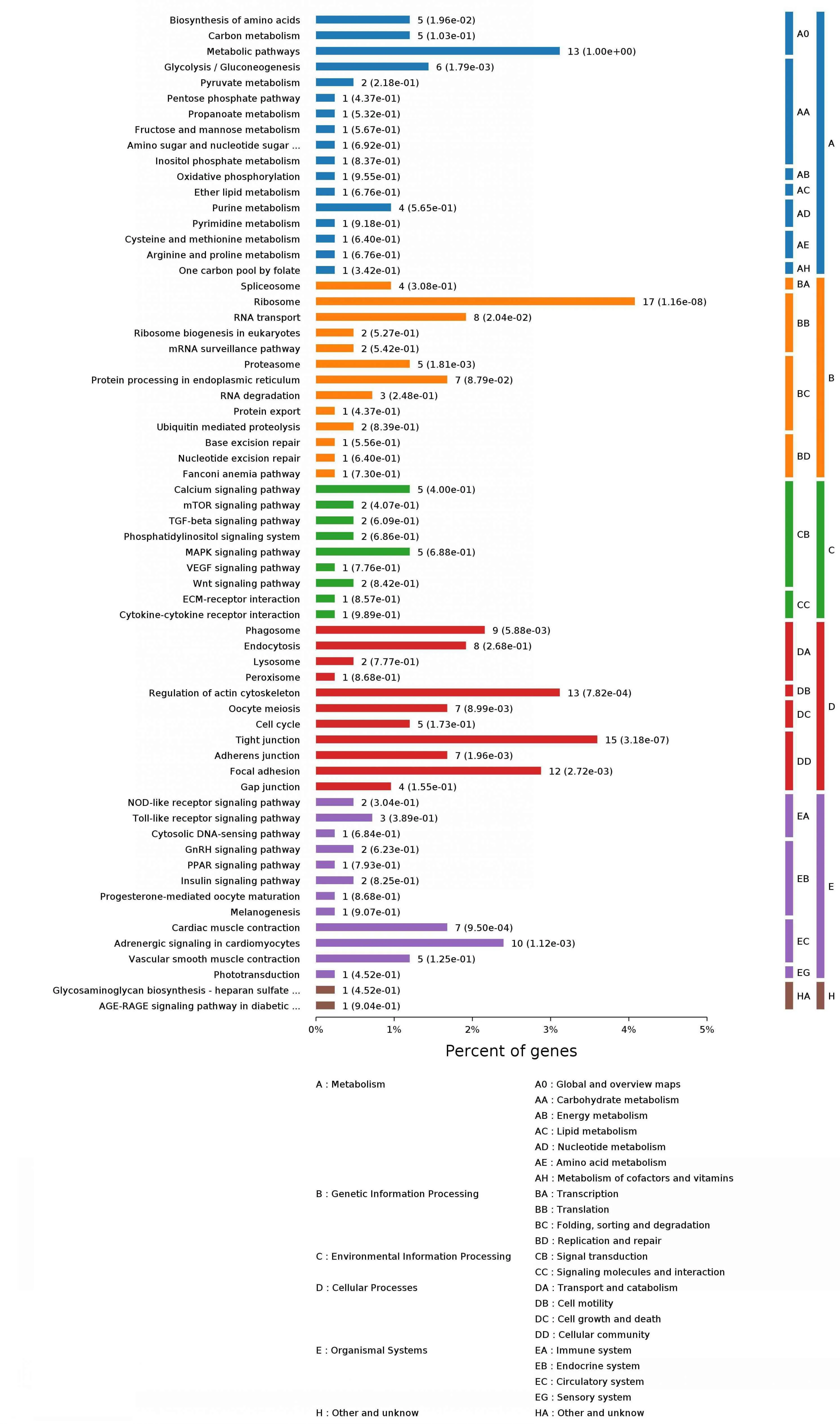
图4 与σC互作的宿主细胞蛋白的KEGG代谢通路注释Fig.4 KEGG pathway annotation of the cellular proteins interacting with σC
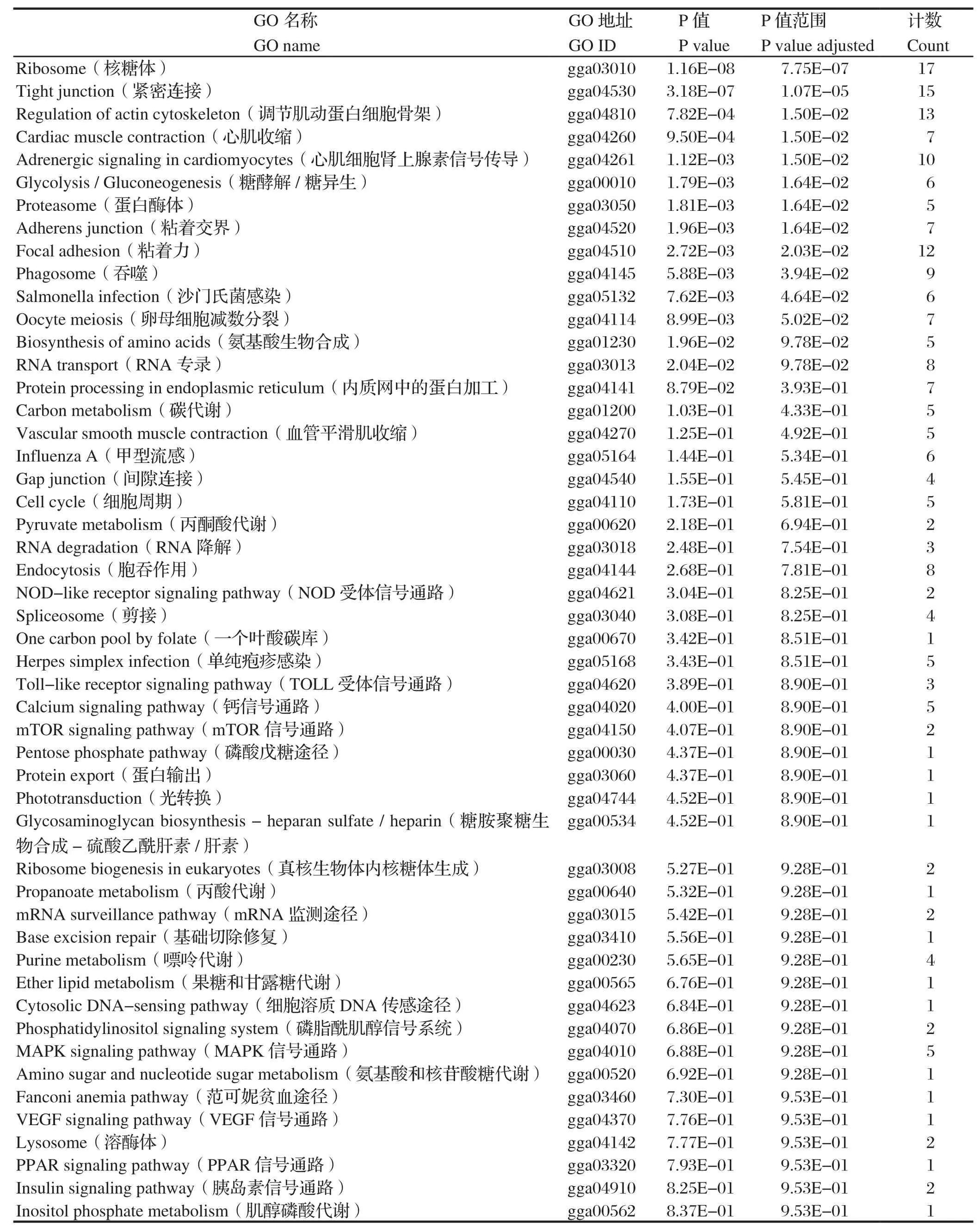
表3 与σC互作的宿主细胞蛋白的KEGG代谢通路注释信息Table 3 KEGG pathway annotation of the cellular proteins interacting with σC

(续上表)
——一道江苏高考题的奥秘解读和拓展

