从江县鲤爆发性死亡病例实验室诊断
胡安东,贺欣薇,杨 霞,张 飘,程振涛,3,姜海波,3,文明,3
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵阳 550025;3.贵州省动物生物制品工程技术研究中心,贵阳 550025)
贵州省淡水资源丰富,渔业产业结构不断优化,渔业养殖规模不断扩大。资料显示,贵州水产养殖面积从2010年2.93万公顷提高至2018年的7.48万公顷,年均增长率达18%。但随着渔业生产方式由小规模家庭经营向适度规模经营快速转变、水生动物养殖品种增加与远距离流通、出入境经营水生动物产品规模和人员数量大幅度增长等,导致目前我省鱼类养殖场疫病时有发生。
鲤鱼(cyprinus carpio)是我国重要淡水鱼类[1],含有丰富的营养物质,能提供人体必需的氨基酸、不饱和脂肪酸、矿物质、维生素A和维生素D等,深受广大消费者喜爱,是贵州省少数民族地区稻田饲养的主要经济淡水鱼种。在扩大鲤鱼养殖过程中,常出现一些细菌性疾病(如细菌性烂鳃病、竖鳞病和细菌性肠炎病等)、病毒性疾病(如鲤疱疹病毒病、鲤春病毒血症和鲤浮肿病)和寄生虫病(如车轮虫病、指环虫病和长棘吻虫病等),常造成巨大经济损失。
2018年10月,贵州省从江县某鲤养殖专业合作社饲养的幼龄鲤鱼爆发大批量发病死亡现象,病鲤主要表现为游动缓慢、饮食减退、体表出血、鳃部溃烂、急性死亡等。本实验室通过流行病学调查、解剖病变观察、寄生虫检查、细菌分离鉴定和病毒PCR检测,确诊该次鲤鱼爆发死亡病例为嗜水气单胞菌(Aeromonas hydrophila)和鲤浮肿病毒(Carp edema virus,CEV)混合感染所致,其中稻田养殖鲤鱼CEV感染为贵州省首次报道,现将本次病例验室诊断结果报道如下。
1 材料与方法
1.1 材料病鲤,为从江县某鲤养殖专业合作社送检,体长约7~13 cm,重量约6~53 g;健康鲤,购自贵阳市花溪水产品贸易市场。鲜血琼脂平板与脑心浸液液体培养基,由贵州省动物疫病与兽医公共卫生重点实验室自制;细菌生化鉴定管和细菌药敏片,购自杭州微生物试剂有限公司;HE染色试剂盒、细菌基因组提取试剂盒,购自北京索莱宝科技有限公司;DNA回收试剂盒,购自天根生化科技(北京)有限公司;病毒核酸提取试剂盒,购自TAKARA公司;其他试剂均为分析纯。
1.2 流行病学调查按照动物疫病调查方法进行该鲤爆发死亡病例的流行病学调查。
1.3 剖解病变观察取送检病鲤,剖解观察大体病变后,采集鳃、肾脏、脾脏、肝脏、肠等组织,固定,石蜡包埋,制作石蜡切片,HE染色并观察。
1.4 寄生虫检查取病鲤体表、鳃丝和其他内脏组织等进行压片,光学显微镜观察寄生虫感染情况。
1.5 细菌分离鉴定
1.5.1 细菌分离培养及形态学鉴定 无菌采集病鲤病变组织,划线接种于鲜血琼脂平板,28℃恒温培养24 h,挑取单个优势菌落纯化培养后进行革兰氏染色镜检,同时用脑心浸液液体培养基增菌培养,4℃保存备用。
1.5.2 分离菌生理生化特性鉴定 挑取分离菌纯培养物,接种微量生化鉴定管,28℃恒温培养24~48 h观察结果,参照文献[2]进行结果判定。
1.5.3 分离菌16S rRNA基因测序鉴定 提取分离菌基因组,以细菌16S rRNA基因通用引物(27F:5'-AGAGTTTGATCATGGCTCAG-3';1492R:5'-TACGGTTACCTTGTTACGACTT-3',预期扩增长度1500 bp)进行PCR扩增。反应体系为25 μL。反应程序:94℃预变性5 min;94℃变性30 s、55℃退火45 s、72℃延伸90 s,共30个循环;72℃终延伸10 min。取PCR产物进行1.5% 琼脂糖凝胶电泳,回收PCR产物,送至生工生物(上海)股份有限公司测序,通过NCBI数据库BLAST比对分析,MegAlign软件构建系统发育树。
1.5.4 分离菌药敏试验 采用纸片扩散法(K-B法),即取分离菌纯培养物100 μL菌液,均匀涂布于脑心浸液琼脂平板,粘贴药敏纸片,28℃恒温培养24 h,观察并记录抑菌圈直径,判定结果。
1.6 病毒PCR检测
1.6.1 鲤疱疹病毒(Koi herpesvirus,KHV)检测 参照文献[3],设计合成KHVSph基因特异性引物(表1)。取病鲤病变组织器官,混匀研磨,提取核酸样本为模板进行PCR检测,反应体系为25 μL。反应程序:94℃ 预变性5 min;94℃变性30 s、54℃退火45 s、72℃延伸45 s,共35个循环;72℃终延伸5 min。取PCR产物进行1.5% 琼脂糖凝胶电泳,观察结果。
1.6.2 鲤春病毒血症病毒(Spring viremia of carp virus,SVCV)检测 参照文献[4],设计合成SVCV2对特异性引物(表1)。取上述提取的核酸样本,反转录为cDNA进行PCR检测,反应体系为25 μL。反应程序:94℃预变性4 min;95℃变性45 s、55℃退火45 s、72℃延伸45 s,共30个循环;72℃终延伸10 min。取PCR产物进行1.5%琼脂糖凝胶电泳,观察结果。

表1 本研究引物序列Table 1 Primer sequences in this study
1.6.3 鲤浮肿病毒(CEV)检测 参照文献[5],设计合成CEV外膜蛋白基因特异性引物(表1)。取上述提取的核酸样本为模板进行两步PCR检测,反应体系均为25 μL。第一步PCR检测的反应程序:94℃预变性2 min,94℃变性30 s、58℃退火30 s、72℃延伸50 s,共35个循环;72℃终延伸5 min;第二步PCR检测是以第一步PCR产物为模板,反应程序:94℃预变性3 min;94℃变性20 s、58℃退火20 s、72℃延伸20 s,共35个循环;72℃终延伸5 min。取PCR产物进行1.5% 琼脂糖凝胶电泳,观察结果。
1.7 人工感染试验取病鲤组织器官,按1:5(重量体积比)加入无菌生理盐水,研磨匀浆后反复冻融3次,以7000×g离心20 min,收集含有病毒的上清,过滤除菌后备用;取分离菌纯培养物,用无菌生理盐水制成浓度为2×108CFU/mL的细菌悬液。取健康鲤,随机分为3组即病毒组、细菌组和对照组,每组10尾;病毒组每尾腹腔注射0.2 mL病毒悬液,细菌组每尾腹腔注射0.2 mL细菌悬液,对照组每尾腹腔注射0.2 mL无菌生理盐水;注射后于25℃水箱中饲养,连续观察10 d,每天观察试验鲤发病情况,统计死亡率,并及时对死亡鲤进行剖检并检测其病原体。
2 结果
2.1 流行病学调查结果贵州省从江县某鲤养殖专业合作社为充分利用稻田水土资源,以稻田养鱼为主要养殖模式,一直以来稳粮增收,成效显著。于2018年10月合作社新引进一批鲤鱼苗,按照往常的鱼苗投放流程进行投放,但投放后不久鱼苗开始出现游动缓慢、不进食、体表出血、烂鳃等临床症状,该病情在鱼苗中迅速扩散,随即在1周内鱼苗出现大批量死亡。
2.2 剖解病变观察结果对病鲤进行大体病变观察发现,病鲤主要表现为鳃丝溃烂、眼球内陷、体表出血和肛门红肿等(图1);对制作好的病鲤组织切片进行组织病理观察显示,鳃板肿胀粘连及上皮细胞脱落、肾小球出血萎缩和肾小囊空腔增大等(图2)。

图1 病鲤主要症状Fig 1 Gross lesions in diseased carp

图2 病鲤组织病理观察Fig.2 Histopathological observation of diseased carp
2.3 寄生虫检查结果在光学显微镜下观察制作好的病鲤体表、鳃丝和其他内脏组织压片均未发现任何寄生虫,故排除寄生虫感染。
2.4 细菌分离鉴定结果
2.4.1 细菌分离培养及形态学鉴定结果 将病鲤内脏组织在鲜血琼脂平板上培养,可观察到边缘光滑、中央微隆起的圆形灰白色菌落,菌落周围有β溶血环(图3);经革兰氏染色镜检可见单个或成对排列、两端钝圆的阴性短杆菌(图4)。

图3 分离菌株β溶血环Fig.3 β hemolysis of the isolated strain

图 4 分离菌菌落形态Fig.4 Mycelium morphology of the isolates
2.4.2 分离菌生理生化特性鉴定结果 挑取分离菌纯培养物,接种相应的微量生化鉴定管,28℃恒温培养24~48 h观察结果并进行判定。结果显示分离菌具有运动性,能利用葡萄糖产酸产气,分解乳糖、麦芽糖,不分解脲素、半乳糖、纤维二塘,M-R试验、V-P试验、精氨酸双水解酶和赖氨酸脱羧酶阳性,鸟氨酸脱羧酶和苯丙氨酸脱氨酶阴性(表2),符合嗜水气单胞菌生理生化特征,初步判定该分离菌为嗜水气单胞菌,并命名为G2-CJ株。
2.4.3 分离菌16S rRNA基因测序鉴定结果 通过细菌16S rRNA基因PCR扩增,将所得产物送样测序并将结果在NCBI数据库中BLAST比对,选取同源性较高菌株16S rRNA基因序列并设置外群,构建系统发育树。结果显示分离菌株GZ-CJ与嗜水气单胞菌聚为一个分支(图5)。综合分离菌株形态学特征、生理生化特性及16S rRNA基因序列系统发育树分析,判断本次分离菌为嗜水气单胞菌。
2.4.4 分离菌药敏试验结果 采用纸片扩散法对分离菌株进行药物敏感性实验。结果显示,分离菌对头孢曲松、呋喃唑酮、头孢哌酮等5种药物高度敏感,对庆大霉素、多西环素、头孢呋辛等4种药物中度敏感,对复方新诺明、磺胺异恶唑、羧苄西林等7种药物耐药(表3)。
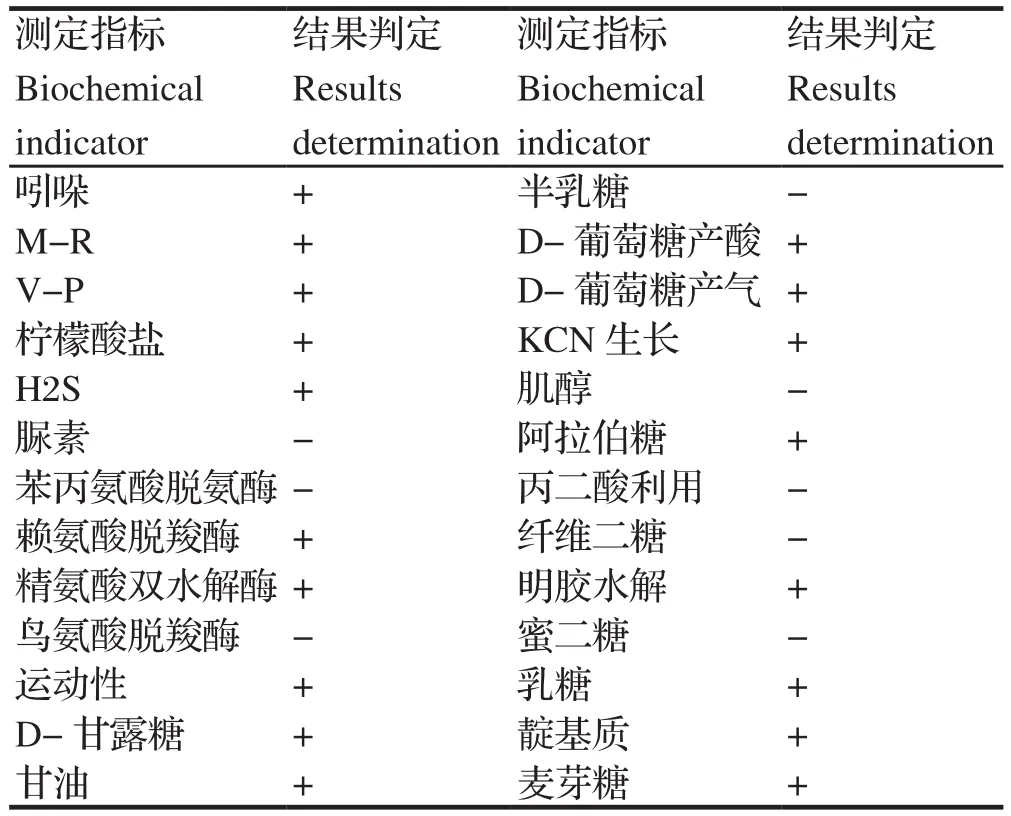
表2 分离菌生化鉴定结果Table 2 Biochemical identi fication of isolated bacteria

图5 分离菌GZ-CJ 16S rRNA 基因序列系统发育树Fig.5 Phylogenetic tree of the isolates based on 16S rRNA gene fragment

表3 分离菌药敏试验结果Table 3 Antimicrobial susceptibility tests to the bacterial isolates
2.5 病毒PCR检测结果
2.5.1 KHV与SVCV检测结果 取病鲤病变组织器官,混匀研磨,提取核酸样本为模板,用KHV与SVCV特异性引物进行PCR扩增检测,将扩增产物在 1.5%的琼脂糖凝胶中电泳并用凝胶成像系统进行观察,结果显示病鲤样本均未能扩增出KHV与SVCV特异性片段,说明病鲤未感染鲤疱疹病毒和鲤春病毒血症病毒。
2.5.2 CEV检测结果 将上述提取的病鲤核酸样本,用CEV特异性引物进行巢式PCR扩增检测,将扩增产物在1.5%的琼脂糖凝胶中电泳并用凝胶成像系统进行观察,结果显示病鲤样本仅第二次PCR反应扩增出182 bp特异性片段(图6)。取巢式PCR阳性产物进行测序分析,结果表明,病鲤样本核酸为鲤浮肿病毒核酸。与NCBI已提交的CEV MG550029株和MH250199株聚为一支(图7),亲缘关系最近。
2.6 人工感染试验结果人工感染试验发现,对照组鲤在观察期内无症状和死亡现象;病毒组于注射后第3 d,极少数鲤出现游动缓慢的症状,大部分鲤无临床症状,第5 d出现死亡,10 d内累积死亡率为20%,剖检死亡鲤,发现仅鳃部肿胀,体表轻微出血,从死亡鲤中未分离到细菌,检测CEV呈阳性;细菌组于注射后第12 h出现体表出血,肛门红肿等症状,第1 d后开始死亡,第3 d达到死亡高峰,10 d内累积死亡率为70%,剖检死亡鲤,发现鳃部溃烂,肝脏、肾脏肿大等症状,从死亡鲤中再次分离到嗜水气单胞菌,但未检测到CEV。
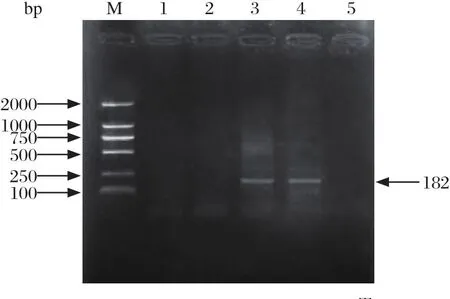
图6 病鲤CEV巢式PCR检测结果Fig.6 Result of detecting CEV from the common carp by nested-PCR
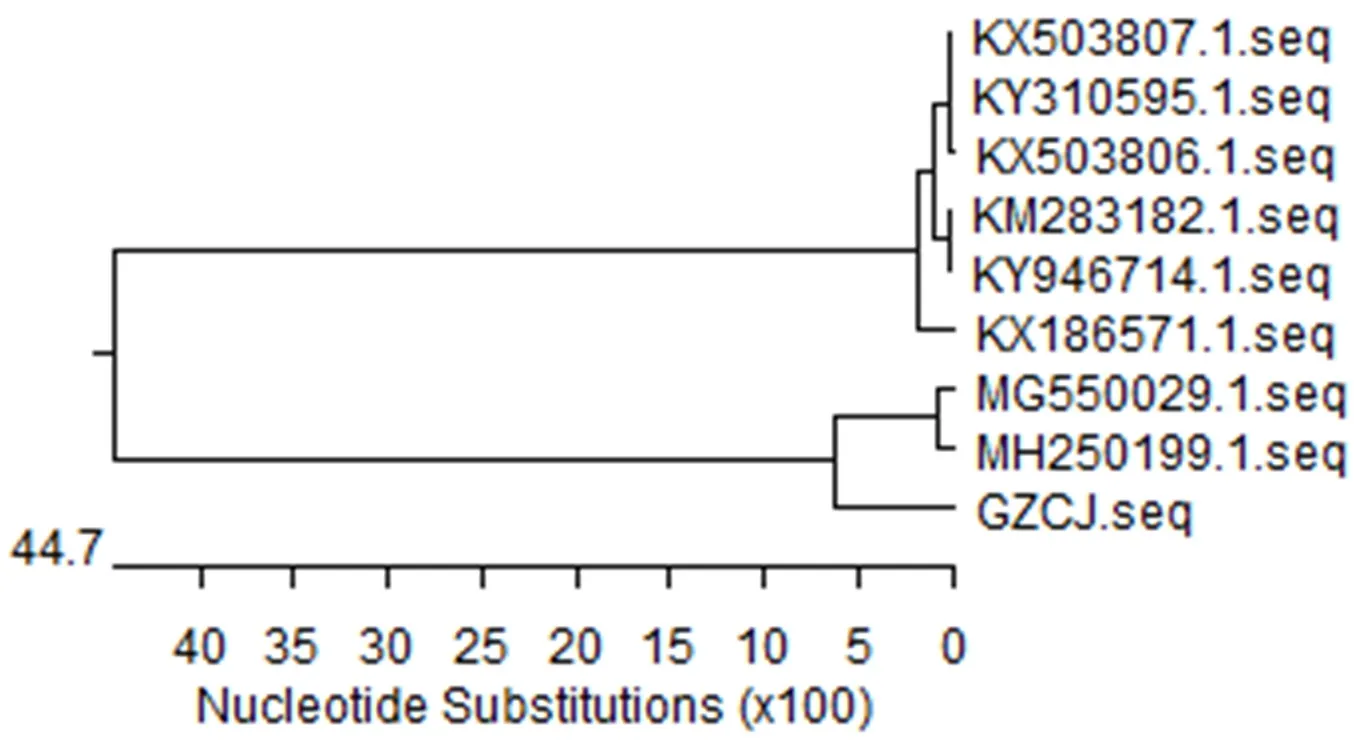
图7 基于CEV巢式PCR产物序列同源性系统进化分析结果Fig.7 Phylogenetic analysis of sequence homology of nested PCR products based on CEV
3 讨论
本研究根据该水产养殖专业合作社爆发性死亡鲤的流行病学调查,病理学观察结果,寄生虫学、细菌学及病毒学鉴定结果,诊断鲤爆发性死亡原因为致病性嗜水气单胞菌(Aeromonas hydrophila)和鲤浮肿病毒(CEV)混合感染所致。
细菌感染一般可导致多种鱼类发病并可在全年流行,温度较低时发病率下降。嗜水气单胞菌是弧菌科气单胞菌属的革兰氏阴性短杆菌,极端单鞭毛,没有芽孢和荚膜,广泛分布于自然界中,是多种动物以及人的条件致病菌[6-10]。不同鱼类感染嗜水气单胞菌所表现出的症状略有不同,但主要以组织充血、出血,烂鳃等症状为主。感染嗜水气单胞菌的西伯利亚鲟[11]主要表现为吻部充血,鳃出血,肝脏发白,肠道末端充血和出血;感染嗜水气单胞菌的大菱鲆[12]主要表现为口部和鳍基部出血,体色发黑,腹部膨胀;感染嗜水气单胞菌的美洲红点鲑[13]表现为鳃丝肿胀且末端糜烂呈灰褐色,后肠充血,肠壁黏膜呈紫红色;本研究中病鲤表现为鳃丝溃烂,体表出血,肛门红肿等症状,与其他鱼类感染嗜水气单胞菌的病症相似。
病毒感染是导致鱼类疾病发病率和死亡率高的原因。CEV是痘病毒科的线性双链DNA病毒,有桑葚似囊膜,病毒粒子直径约为250 nm。有关于鲤感染CEV出现的病症,有不同报道,多数为眼凹陷、烂鳃、体表溃烂、昏睡等症状,但也有报道称没有临床症状和死亡现象。刘群等[14]研究发现鲤感染CEV表现为体色发黑、颅骨软组织周围皱缩、眼凹陷、鳃粘脏等症状且出现大量死亡;王小亮等[15]研究发现一些鲤感染CEV,并未表现出临床症状和大量死亡现象;本研究结果表明,CEV对鲤致死率并不高,部分未死亡鲤也无临床症状,与Matras等[16]和Adamek等[17]研究结果一致。推测鲤感染CEV不一定爆发鲤浮肿病,有关于CEV诱导疾病出现的临床病症,可能是由其他因素引起,在没有外界条件刺激的情况下,鲤感染CEV不一定发病和死亡。
CEV感染鲤与KHV感染具有相似症状,因此仅靠临床症状并不能进行直接判断,还需通过实验室方法进行鉴别诊断。现阶段研究人员对CEV的了解并不是十分深入,没有发现该病毒的易感细胞系[18],不了解其基因组结构和编码蛋白功能,这对病毒的分离纯化、检测技术的优化和防治方法的建立造成了严重阻碍。张文等[19]建立了双重实时荧光定量PCR方法用于CEV检测,该方法灵敏度好、特异性高,适用于实验室常规检测;曹欢等[20]建立了LAMP方法用于CEV检测,该方法操作简单、特异性好、灵敏度高,可直观观察出反应结果,适用于在养殖现场快速检测;Soliman等[21]建立了RPA分析和量油尺方法用于CEV检测,该方法只需要50 min测试样品,除加热块以外不需要任何设备以提供恒定温度,适用于监测进口或出口鲤的贸易以控制病毒的传播。本研究采用Oyamatsu等[5]建立的nest-PCR方法从病鲤中检测出CEV,该方法在很长一段时间对CEV检测发挥了重要作用。期望未来科研工作者对CEV有更多深入研究,建立出CEV更加便捷、准确的检测方法,为CEV的防治做出贡献。
当鱼同时或继发感染2种及2种以上病原时称为混合感染,Kotob等[22]将鱼类混合感染分为同类病原混合感染和异类病原混合感染,病原之间的作用或为协同或为拮抗。鱼类在混合感染过程中对不同病原体的敏感性会发生变化,可以改变不同鱼类疾病病程和严重性,且大多起到协同致病作用,导致鱼类爆发性死亡。本研究对该养殖基地鲤爆发性死亡进行了实验室诊断,分析其发病情况以及结合本试验研究结果,推测导致该养殖基地鲤爆发性死亡的原因为致病性嗜水气单胞菌和鲤浮肿病毒混合感染,这2种病原混合感染加快了鲤发病病程及死亡速度。建议水产养殖专业合作社在引进苗种时进行隔离检疫,在饲养过程中提高养殖人员的养殖技术和管理水平,维护良好的养殖环境,以减少鱼体应激,发病后应选择敏感性药物(头孢曲松、头孢哌酮、呋喃唑酮等)进行治疗,以轮换用药方式给药以防止耐药菌株的产生,并用0.5%盐水浸泡病鱼,以缓解死亡。

