胆固醇-25-羟化酶基因抗病毒功能研究进展
吕丽霞,赵贵民,王洪梅,侯佩莉,潘 伟,何洪彬
(1.山东师范大学 反刍动物疾病研究中心,济南 250014;2.山东师范大学生命科学学院,济南 250014)
胆固醇-25-羟化酶(cholesterol-25-hydroxylase,CH25H)是一种大小为31.6 kDa的多跨膜内质网(endoplasmic reticulum,ER)相关酶,其主要功能是以O2为附加底物,NADPH为辅助因子来催化胆固醇产生25-羟基胆固醇(25-hydroxycholesterol,25HC),减少胆固醇积累[1-3]。近期研究发现,CH25H是一种保守的干扰素刺激基因(interferonstimulated genes,ISGs),I型和II型干扰素(interferons,IFNs)与其受体结合后,通过JAKSTAT信号通路招募转录因子STAT1到CH25H基因的启动子近端区域诱导CH25H基因迅速表达[4-6]。25HC也可通过调节核受体和固醇调节元件结合蛋白(sterol regulatory element-binding proteins,SREBPs)的活性抑制胆固醇的生物合成[7]。
CH25H具有广谱的抗病毒功能,主要是通过其酶活性产物25HC来发挥抗病毒作用,25HC能够以自分泌和旁分泌的方式调节细胞功能以保护细胞免受病毒感染。过表达CH25H基因或用25HC处理细胞后可通过不同的机制发挥其对囊膜病毒的抗病毒功能;25HC对一些非囊膜病毒的显著抗病毒活性也已经被报道[2-3,8-9];CH25H也可以通过不依赖其酶活性的方式抑制病毒的复制[2,7]。
1 CH25H基因的表达与结构特征
Lund等[10]首次克隆了小鼠和人的CH25H基因,该基因在正常情况下在体内多种组织中表达水平很低。有研究发现,CH25H基因经各种Toll样受体配体诱导,IFNs信号通路被激活后,其在肝脏、心脏、脑、肌肉、肾脏和肺脏等组织中会迅速表达[7]。
目前在多种哺乳类、鱼类、鸟类上已经克隆出CH25H基因。我们对哺乳类、鸟类等物种中代表动物的CH25H进行分子遗传进化树分析发现,不同哺乳动物之间具有种属差异性,哺乳类与禽类各聚为一簇,斑马鱼与吐缓鸡、绿头鸭等禽类CH25H基因的同源性高达99%,哺乳动物中人与牛、羊等反刍动物CH25H基因的同源性比小鼠的高(图1)。
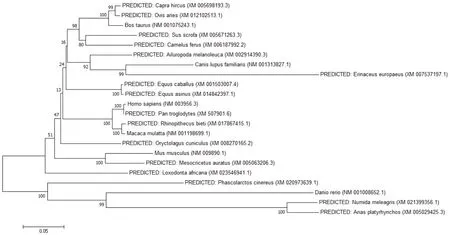
图1 不同物种CH25H基因进化树分析Fig.1 Phylogenetic tree analysis of CH25H gene of different species
大多数脊椎动物的CH25H由270~274个氨基酸残基组成,以人源CH25H基因为例,全长包括272个氨基酸残基(aa1~272),主要分为2个结构域:跨膜(transmembrane,TM)结构域(aa1~135)和FA(FAase)结构域(aa136~272),FA结构域包含3个组氨酸残基簇:(142-Trp-His-Leu/Val-Leu-Val-His-His-148)、(157-Phe/Ile-His-Lys-Val/Met/Leu-His-His-162)、(238-His-His-Asp-Leu/Met-His-His-244),而242、243位的组氨酸密码子对CH25H的酶催化活性和羟基化反应是必不可少的[7,11]。CH25H N端位于内质网外,而3个活性位点组氨酸残基簇位于内质网膜内,表明CH25H是在内质网膜内发挥其催化酶的催化作用[6]。
2 CH25H在脂肪代谢通路中的作用
在脂肪代谢通路中CH25H主要是通过其羟基化作用催化胆固醇产生胆固醇代谢的氧化中间体25HC。25HC是一种重要的胆固醇调节分子,能有效抑制胆固醇的生物合成和SREBPs的加工。SREBPs是一类调节哺乳动物细胞脂质合成的转录因子家族[12],通过调控胆固醇合成关键酶3-羟基-3-甲基戊二酸单酰辅酶A(3-hydroxy-3-methylglutarylcoenzyme A reductase,HMG-CoA)还原酶和HMGCoA合成酶的水平从而调控SREBP-1和SREBP-2两种蛋白的功能。SREBP-1负责胆固醇和脂肪酸的合成,SREBP-2介导胆固醇的合成。25HC除了抑制SREBPs来控制脂质稳态外,还可作为Nr5a1(SF-1)和肝X受体(LXR)的天然内源性配体发挥作用,通过LXR的信号传导来维持哺乳动物细胞的脂质稳态[13-14]。在巨噬细胞中,LXR激活参与胆固醇转运的相关基因如ATP-结合盒A1(ABCA1)泵、促生存基因Cd5l、Bcl-xl和Birc1a等,并将其载入载体蛋白,转运至肝脏,而ABCA1泵能去除细胞内的胆固醇,对细胞内25HC活性有重要的负反馈控制作用[15-17]。
3 CH25H在病毒感染过程中的作用
胆固醇是细胞膜上丰富的脂质,负责膜的包装和流动性。许多病毒的侵入和出芽释放均受到细胞膜中胆固醇分布的影响,因此在胆固醇生物合成受到抑制时病毒的复制被抑制。CH25H可以催化胆固醇生成25HC,调节胆固醇代谢,并发挥广谱的抗病毒作用[18-21]。已知控制细胞胆固醇水平的天然免疫反应和稳态途径是相互调节的,早期发现25HC是众所周知的固醇途径的负反馈介质,最新研究发现它可以在多个水平上介导细胞内的抗病毒功能[6]。
3.1 抗囊膜病毒25HC是一种天然存在的可以渗透膜的分泌型氧固醇[2],它可通过多种机制抑制囊膜病毒的复制,见表1。目前研究发现,25HC可在病毒侵入、基因组复制、蛋白质的合成等病毒复制周期的不同阶段影响囊膜病毒的复制。

表1 CH25H抑制囊膜病毒概述Table 1 Overview of CH25H inhibition of envelope virus
3.1.1 25HC在病毒侵入阶段发挥抗病毒作用 研究发现,25HC可以直接修饰细胞膜从而阻止人类免疫缺陷病毒(Human immunodeficiency virus,HIV)进入,但不影响HIV的转录、翻译或出芽过程[1,22]。塞卡病毒(Zika virus,ZIKV)和水疱性口炎病毒(Vesicular stomatitis virus,VSV)感染细胞后内源性CH25H基因的表达显著上调,并且CH25H的酶活性产物25HC也可以以剂量依赖性方式阻断病毒侵入细胞来抑制ZIKV和VSV的感染[1,23-24]。HCV(Hepatitis C virus,HCV)是一种正链RNA病毒,HCV能够依赖低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)和SREBP1进入细胞,25HC能够通过影响LDLR抑制HCV侵入细胞[25-26]。对于病毒感染,SREBPs与HCV致病机制也紧密相关,HCV通过刺激PI3K/AKT信号传导上调SREBP活性,25HC可以通过抑制SREBP-2活化,增强调节肝脏脂质稳态的microRNA-185的表达发挥其抗病毒作用,但其作用机制尚不清楚[5]。
3.1.2 25HC在病毒基因组复制阶段发挥抗病毒作用 对于25HC抵抗HCV感染其他作用机制的研究发现,25HC可以通过抑制双膜囊泡的形成进而抑制HCV基因组的复制[23]。疱疹病毒是一类具有囊膜包被的DNA病毒,在IFN信号通路中干扰素调节因子1(interferon regulatory factor 1,IRF-1)迅速诱导CH25H基因的表达上调,其酶活性产物25HC可通过抑制病毒复制后期DNA的合成,从而限制原代骨髓巨噬细胞中鼠γ疱疹病毒68(Maus Herpesvirus 68,MHV68)的复制[1,6,27]。
3.1.3 25HC在病毒蛋白质合成阶段发挥抗病毒作用 25HC还可通过影响病毒蛋白的翻译后修饰(posttranslational modification,PTM)发挥抗病毒作用,如25HC通过抑制拉沙热病毒(Lassa fever virus,LASV)糖蛋白GP1的糖基化发挥其抗病毒作用[28]。
3.1.4 CH25H以不依赖于其酶活性的方式发挥抗病毒作用 CH25H可以通过不依赖其酶活性的方式抑制病毒的复制,研究发现,CH25H可通过泛素蛋白酶体途径降解猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的nsp1α蛋白,从而抑制PRRSV的复制[2]。HCV的非结构蛋白NS5A的Ⅰ结构域也可以与CH25H基因的TM和FA结构域相互作用从而抑制NS5A蛋白二聚体的形成,进而抑制HCV的复制[7]。
3.2 抗非囊膜病毒25HC对脊髓灰质炎病毒(Poliovirus)、人乳头瘤病毒16型(Human papilloma virus,HPV-16)、人轮状病毒(Human rotavirus,HRoV)、人鼻病毒(Human rhinovirus,HRhV)等非囊膜病毒具有显著的抗病毒活性[2,8]。25HC能够通过靶向氧固醇结合蛋白(oxysterol binding protein,OSBP)家族I的成员,减少4-磷酸磷脂酰肌醇(phosphatidylinositol 4-phosphate,PI4P)在高尔基体上的积累,从而抑制脊髓灰质炎病毒的复制[21,29]。同样,HRhV感染细胞后会形成富含PI4P的高尔基体膜,并依赖于这种机制来促进自身RNA的复制,25HC通过与OSBP结合,将其锁定在无活性状态,导致PI4P在内质网、高尔基体和复制膜之间的穿梭受阻,从而抑制HRhV的复制[9,21]。
哺乳动物呼肠孤病毒(Reovirus)是一类具分节段的双链RNA病毒。最新研究报道,呼肠孤病毒感染细胞后,先天免疫反应诱导了CH25H基因的表达,25HC处理细胞后抑制了基因Ⅰ型和Ⅲ型呼肠孤病毒的感染。25HC并不会抑制呼肠孤病毒具有感染性的病毒样粒子ISVPs,ISVPs仍然可以直接穿透细胞膜或早期内体膜。25HC能够在病毒入侵阶段延迟呼肠孤病毒衣壳蛋白水解和脱壳,从而抑制病毒侵入细胞[3]。对25HC抗病毒作用机制的研究可以为新的抗病毒疗法提供依据。
4 在免疫中的作用
氧固醇不仅在脂代谢中发挥重要作用,而且在免疫中也发挥重要功能,许多研究已经表明它们在免疫中的重要性。B细胞表达的CH25H是免疫球蛋白A(IgA)的抑制剂,当25HC处理初始B细胞后,B细胞增殖和类别转换重组减少,从而抑制IgA的产生,可促进细胞内寄生菌的生长[15,33]。25HC的失调还与动脉粥样硬化有关,25HC可以诱导炎性细胞因子和白细胞介素-8(IL-8)的表达[34]。在胶质细胞、巨噬细胞或TR1细胞中,I型IFN和白介素-27(IL-27)诱导CH25H基因的表达,25HC触发LXR的激活,阻断Tr1细胞的分化并通过抑制炎症小体NLRP3从而抑制白介素-1β(IL-1β)和白介素-18(IL-18)的成熟[35]。
5 展望
越来越多的研究表明固醇通路中相关因子包括25HC在病毒感染过程中扮演着重要的角色。CH25H作为一种早期的天然干扰素应答的效应分子,更多研究发现了之前未被认识到的生物学作用,即能够发挥广谱的抗病毒功能。STAT1与CH25H启动子结合使得天然免疫刺激、病毒感染和巨噬细胞内胆固醇分泌25HC之间具有了联系。此外,人的CH25H基因作为一种ISGs仍存在争议,而不同病毒感染宿主细胞后CH25H的表达也存在差异,如ZIKV、HIV等病毒感染宿主细胞后CH25H的表达被显著上调,而PRRSV、HSV等病毒感染宿主细胞后CH25H的表达被显著下调,可能是不同病毒感染宿主细胞后对CH25H表达调控的机制不同,而且人CH25H在肝脏内的表达以及其对HCV感染后机体的内在调节仍然不清楚,有待进一步阐明。大量研究已经证明了25HC在天然免疫防御病毒感染中的作用,但多数研究都是在体外培养的细胞中进行的,很少使用动物模型,所以病毒感染的结果不仅取决于宿主控制病毒复制的能力,还取决于宿主对病毒的免疫反应所造成的损害程度。总之,目前仍需要大量的研究以证明25HC在体内不同病毒感染过程中所起的作用,并评估它作为抗病毒药物的临床潜力。

