NLRP3炎性小体及其上游激活蛋白GSDMD在原发性胆汁性肝硬化中的表达
向国艳,樊 佳,叶震璇,付 雪,张海燕,张 华,4△
(1.贵州医科大学临检教研室,贵州贵阳 550004;2.西南医科大学附属中医医院检验科,四川泸州 646000;3.贵州省人民医院检验科,贵州贵阳 550002;4.贵州医科大学医学检验学院,贵州贵阳 550004)
原发性胆汁性肝硬化(PBC)是自身免疫性肝病中最常见的一种类型,其以胆管上皮细胞被破坏、肝内胆汁淤积为主要特征。该病好发于中老年女性,起病隐匿且病程较长[1-2]。目前,PBC的发病机制尚不完全清楚。在其发生发展过程中,炎性细胞的浸润是胆管上皮细胞破坏、胆汁淤积的主要原因之一,该原因也成为研究PBC致病机制的关键点。
核苷酸结合寡聚化结构域样受体3(NLRP3)是参与固有免疫应答的受体之一。最新报道,gasdermin D(GSDMD)蛋白裂解后得到的N端结构域可能是激活NLRP3炎性小体的关键物质[3-4]。本课题组前期研究发现,Caspase-1和白细胞介素(IL)-18参与了PBC细胞免疫炎性反应[5-6],但是对于其上游的调控蛋白NLRP3及与NLRP3激活相关的GSDMD在PBC中的研究尚未见报道。因此,本研究拟通过检测PBC患者及体检健康者NLRP3与GSDMD的mRNA和蛋白表达水平、血浆中Caspase-1和IL-18的表达水平,探讨NLRP3炎性小体及其上游激活蛋白GSDMD与PBC免疫炎性反应的关联。
1 资料与方法
1.1一般资料 收集2016年11月至2017年9月贵州省人民医院确诊为PBC的患者(PBC组)及体检健康者(健康对照组),各30例。PBC组患者平均年龄为(58.27±13.61)岁,健康对照组平均年龄为(53.83±9.64)岁,两组男女比例一致。该研究经贵州省人民医院伦理委员会审查通过(2017109),并且所有患者知情同意。排除标准:排除系统性自身免疫病、胆管炎、其他原因引起的肝脏疾病等。诊断标准参照美国肝病学会(AASLD)于2009年推荐的诊断指南[7]。
1.2仪器与试剂 人外周血淋巴细胞分离液、DNA/RNA/蛋白共提取试剂盒、逆转录试剂盒和SYBR GreenⅡ试剂盒购自索莱宝生物股份有限公司;GodViewⅡ核酸染料、Anti-NLRP3单克隆抗体、Anti-GSDMD单克隆抗体、β-actin单克隆抗体购自Abcam生物有限公司。
1.3方法
1.3.1生化检测和自身抗体谱检测 收集受试者外周静脉血3 mL,分离的血浆和血清分别用于自身抗体谱和肝功能检测。间接免疫荧光法检测抗线粒体抗体(AMA),免疫印记法检测抗线粒体M2型抗体(AMA-M2),全自动生化分析仪检测肝功能。
1.3.2外周血单个核细胞(PBMC)的富集及RNA/蛋白的提取 收集纳入研究者外周血3 mL于乙二胺四乙酸二钾(EDTA-K2)抗凝管中,3 500 r/min离心15 min分离血浆与血细胞,血细胞用于单个核细胞提取。通过Ficoll法分离PBMC,并取5×106个细胞用于RNA的提取。按照试剂盒说明书提取RNA与蛋白,并经微量核酸定量仪检测其水平与纯度。使用凝胶成像仪检测其完整性,28S/18S约等于2∶1且无DNA条带时,说明完整性较好。将RNA逆转录为cDNA,所得cDNA与蛋白保存于-20 ℃,以备后续实验使用。采用q-PCR与Western blot分别检测两组PBMC中NLRP3与GSDMD的mRNA和蛋白的表达量。
1.3.3NLRP3及GSDMD的mRNA表达水平检测 采用Primer Premier 5.0与Oligo 6软件进行引物设计。NLRP3(155 bp)上游引物 5′-GCC ACG CTA ATG ATC GAC TT-3′,下游引物5′-ACA GTG GGA TTC GAA ACA CG-3′;GSDMD(156 bp)上游引物 F:5′-GGA CCC TAA CAC CTG GCA GAC T-3′,下游引物5′-TTG TGG GTG CGC GTG ACT T-3′。应用ABI7500 PCR 仪检测目的基因。每个样本设置3个复孔。95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环进行反应。根据2-ΔΔCt计算结果。
1.3.4NLRP3和GSDMD的蛋白表达水平检测 用BCA试剂盒测定蛋白水平后,以β-actin为内参,依次进行蛋白凝胶电泳、转膜、封闭、孵育抗体等步骤,曝光采集图片后通过Image J分析灰度值计算相对表达水平。
1.3.5Caspase-1与IL-18的表达水平检测 严格按照ELISA试剂盒说明书,通过多功能酶标仪在450 nm/620 nm波长处分别对PBC组与健康对照组外周血血浆中Caspase-1与IL-18进行吸光度(A)值检测。
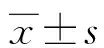
2 结 果
2.1AMA与AMA-M2检测 30例PBC患者中AMA-M2均为阳性(100.0%),其中≥“++”有29例(96.7%)。AMA滴度≥1∶320有21例(70.0%)。而30例健康对照者AMA与AMA-M2均为阴性。在鼠肾基质片中近曲小管和远曲小管可见明显颗粒状荧光。见表1、图1。
2.2肝功能相关生化指标 健康对照组的6项肝功能生化指标均在正常范围内。PBC组6项检测指标均高于健康对照组,差异有统计学意义(P<0.05)。见表2。

表1 PBC组AMA及AMA-M2的表达
2.3总RNA的纯度及完整性 根据1%的琼脂糖凝胶电泳结果显示28S/18S约为2∶1,有少量的5S RNA。微量核酸检测仪结果显示,所有的标本在A260/A280的比值在1.9~2.0,说明RNA的纯度较好,可用于后续实验。10个样本的电泳结果见图2。
2.4NLRP3和GSDMD mRNA的表达情况 PBC组PBMC中NLRP3与GSDMD mRNA的表达水平分别为健康对照组的1.977倍和3.275倍(P<0.05)。见图3。

注:A表示AMA滴度为1∶320的示意图(4×40倍);B表示免疫印迹膜条示意图
图AMA荧光模型和免疫印迹模条

表2 肝功能相关生化指标检测结果
注:与健康对照组比较,*P<0.05;AKP表示碱性磷酸酶,γ-GT表示γ-谷氨酰转肽酶,ALT表示丙氨酸氨基转移酶,AST表示天门冬氨酸氨基转移酶,TBIL表示总胆红素,DBIL表示直接胆红素

图2 琼脂糖凝胶电泳结果

注:*P<0.05;A表示NLRP3 mRNA相对表达量;B表示GSDMD mRNA相对表达量
图3 NLRP3和GSDMD mRNA的相对表达情况
2.5NLRP3和GSDMD蛋白的表达水平 PBC组与健康对照组的NLRP3蛋白相对表达水平分别为1.973 2±0.040 7与1.746 0±0.060 6,差异有统计学意义(P<0.05);PBC组与健康对照组的GSDMD蛋白相对表达水平分别为2.885 3±0.059 6与2.206 0±0.081 5,差异有统计学意义(P<0.05)。见图4。
2.6Caspase-1和IL-18的表达水平 使用Caspase-1及IL-18 的标准品建立标准曲线,计算得到R2值分别为0.998 9和0.999 7。PBC组与健康对照组血浆中Caspase-1的水平分别为(118.504±64.472)pg/mL与(63.935±27.284)pg/mL,差异有统计学意义(P<0.01);PBC组与健康对照组血浆中IL-18的水平分别为(439.326±180.101) pg/mL与(229.310±109.559)pg/mL,差异有统计学意义(P<0.01)。见图5。

注:*P<0.05;A表示NLRP3相对表达水平;B表示GSDMD相对表达水平;C表示Western blot图
图4 NLRP3和GSDMD蛋白的相对表达情况

注:**P<0.01;A表示Caspase-1;B表示IL-18
图5血浆中Caspase-1和IL-18的表达情况
3 讨 论
PBC是一种免疫介导的肝内小胆管渐进性破坏、慢性胆汁淤积性肝脏疾病[1]。目前,PBC的发病机制仍不明确,可能是免疫、环境及遗传等因素的相互作用[8],发生针对自身抗原的免疫反应,引起肝内小胆管损伤和胆汁淤积而诱发PBC。对于PBC的诊断主要依据生化指标如碱性磷酸酶(AKP)升高、血清AMA或AMA-M2阳性、肝脏穿刺出现非化脓性破坏性胆管炎及小叶间胆管破坏的组织学证据[7],符合以上3点中的2点即可确诊。其中,血清中AMA-M2阳性对该病的诊断有很高的特异度和灵敏度。然而对于AMA-M2阴性的患者,则需要进行肝穿刺。鉴于肝穿刺可能会导致一些并发证,患者一般难以接受,因此,目前临床上多以生化指标AKP升高、血清AMA或AMA-M2阳性来诊断PBC。AMA-M2检测采用的是免疫印记法,该方法包被的抗原为高纯化抗原,在方法学上有灵敏度和特异度的优势。因此,AMA-M2的检出率一般都高于AMA,故间接免疫荧光法和免疫印记法联用,可避免漏诊和误诊。本研究中,30例PBC患者组AMA-M2阳性有30例(100.0%),而AMA滴度≥1∶320只有21例(70.0%),该结果也符合AMA-M2检出率更高的特点。
NLRP3炎性小体由NOD样受体蛋白3、接头分子凋亡相关蛋白(ASC)和效应分子前体半胱氨酸酶1(Pro-Caspase-1)组成。在某些因素的诱导下,NLRP3炎性小体可通过ASC招募Pro-Caspase-1,使其形成Caspase-1 p10/p20四聚体的活性形式,Caspase-1进一步将IL-1β和IL-18前体裂解为有活性的IL-1β和IL-18,从而参与炎性反应并调节免疫应答[9-10]。本课题组前期研究发现,Caspase-1、ASC和IL-18参与了PBC细胞免疫炎性反应并发挥重要的作用[5-6]。因此,猜想其上游的NLRP3也可能参与了PBC的发生。本研究检测了NLRP3、Caspase-1和IL-18的表达,结果表明NLRP3、Caspase-1和IL-18在PBC组中水平显著增高,说明在PBC患者体内NLRP3基因转录增多,使蛋白表达增加。鉴于NLRP3炎性小体激活后,可活化其下游的Caspase-1和IL-18的成熟和释放。推测在PBC患者体内,NLRP3大量表达后促使下游炎性因子IL-18的释放,IL-18可通过核因子κB通路刺激CD4+T细胞增殖分化为Th1 细胞,Th1细胞分泌γ-干扰素(IFN-γ),而IFN-γ又可促进IL-18的生成,如此恶性循环致使肝脏胆管炎症发生。
目前,NLRP3的具体调控机制尚不完全清楚。以往认为,NLRP3炎性小体主要通过细胞内钾离子外流途径、溶酶体途径和活性氧生成途径等被激活[11]。最新研究发现,GSDMD的N端结构域可能参与NLRP3炎性小体的激活。通常情况下,GSDMD的N端和C端结构域相互抑制,使得GSDMD处于无活性的自抑制状态[12]。炎性小体激活后可促使Caspase-1的成熟和分泌,成熟的Caspase-1通过水解GSDMD使其形成并释放具有活性的N端结构域[13]。本研究采用q-PCR和Western blot法检测GSDMD mRNA和蛋白表达水平,结果显示GSDMD水平在PBC患者PBMC中显著升高,推测在PBC患者体内,可能由于NLRP3基因转录增加活化了Caspase-1,从而促使大量GSDMD蛋白N端结构域的形成和释放。而N端结构域又可以促使NLRP3进一步活化,最终形成恶性循环的炎性反应。大量炎症因子攻击胆管上皮细胞使其受损从而导致胆汁淤积,进而促使肝纤维化甚至肝硬化[14]。
针对NLRP3炎性小体的调控可以不同程度缓解疾病进程[15],这预示着NLRP3炎性小体可能成为多种疾病治疗的靶点。若能调控NLRP3炎性小体的活化,减少促炎性细胞因子的释放,阻止疾病早期的炎性反应,或许能对疾病起到一定的预防和缓解的作用。因此,对GSDMD与NLRP3在PBC发病中的作用进行研究是十分必要的。
4 结 论
本研究证实,PBC患者NLRP3、GSDMD、Caspase-1和IL-18的表达均明显高于健康对照者,在PBC患者体内GSDMD的高表达激活NLRP3,间接促进Caspase-1与IL-18的成熟和释放导致炎性反应发生。NLRP3、GSDMD可能参与了PBC的免疫炎性反应。

