电针“委中”对多裂肌损伤模型大鼠钙调蛋白 信号通路的影响
白玉琢 徐菁 陈洁 张佳怡 许玥 鲁曼 李欣怡 霍泽军 张莉
〔摘要〕 目的 探討多裂肌损伤后,电针“委中”干预对多裂肌损伤过程中钙调蛋白信号通路的影响。方法 SD大鼠随机分为空白组、模型1 d组、模型3 d组、电针1 d组、电针3 d组,每组8只。电针组双侧“委中”电针,于治疗的第1、3天各组同步取材,采用酶联免疫吸附法检测多裂肌、脊髓、海马组织中CaM、CaMKⅡ、iNOS的含量。结果 模型1 d和3 d组,多裂肌、脊髓、海马CaM、CaMKⅡ含量显著高于空白组(P<0.01);多裂肌、脊髓、海马iNOS含量高于空白组(P<0.05或P<0.01)。电针1 d后,多裂肌、脊髓、海马CaM、CaMKⅡ、iNOS含量显著低于模型1 d组(P<0.05或P<0.01)。电针3 d后,多裂肌、脊髓、海马CaM、CaMKⅡ、iNOS含量低于模型3 d组(P<0.05或P<0.01)。电针3 d后,脊髓、海马CaM、CaMKⅡ及多裂肌CaMKⅡ含量显著低于电针1 d组(P<0.01),多裂肌CaM、iNOS和脊髓、海马iNOS含量与电针1 d组比较差异无统计学意义(P>0.05)。结论 多裂肌损伤早期,电针“委中”干预可通过抑制CaM、CaMKⅡ的过度激活,减少组织中iNOS的过多产生,减轻组织炎症损伤。
〔关键词〕 多裂肌;脊髓;电针;委中;海马;钙调蛋白
〔中图分类号〕R245 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.04.014
Effects of Electroacupuncture Weizhong (BL40) on Calmodulin Signaling Pathway in Rat
Model of Multifidus Injury
BAI Yuzhuo1, XU Jing1, CHEN Jie1, ZHANG Jiayi1, XU Yue1, LU Man1, LI Xinyi1, HUO Zejun2*, ZHANG Li1*
(1. School of Acupuncture, Moxibustion and Tuina, Beijing University of Chinese Medicine, Beijing 100029, China;
2. Department of Traditional Chinese Medicine, Peking University Third Hospital, Beijing 100191, China)
〔Abstract〕 Objective To investigate the effects of electroacupuncture (EA) Weizhong (BL40) intervention on calmodulin signaling pathway in the process of multifidus muscle injury. Methods SD rats were randomly divided into the blank group, model 1d group, model 3d group, EA 1d group and EA 3d group, with 8 rats in each group. For the EA group, EA was performed at bilateral Weizhong (BL40). Materials were collected on the first and third day of treatment among each group. The contents of CaM, CaMKII and iNOS in multifidus muscles, spinal cord and hippocampus were detected by ELISA. Results The contents of CaM and CaMK II in the hippocampus, spinal cord, hippocampus and multifidus muscles in the model 1d and 3d group were significantly higher than those in the blank group (P<0.01), while the iNOS contents in the multifidus muscles, spinal cord and hippocampus were significantly higher than those in the blank group (P<0.05 or P<0.01). After 1 day of EA, the contents of CaM, CaMKII and iNOS in the multifidus muscles, spinal cord and hippocampus were significantly lower than those in the model 1d group (P<0.05 or P<0.01). After 3 days of EA, the contents of CaM, CaMKII and iNOS in the multifidus muscles, spinal cord and hippocampus were significantly lower than those in the model 3d group (P<0.05 or P<0.01). After 3 days of EA, the contents of CaM, CaMKII in the spinal cord and hippocampus and the CaMKII in the multifidus muscles were significantly lower than those in the EA 1d group (P<0.01). The contents of CaM and iNOS in multifidus muscles, and iNOS in the spinal cord and hippocampus were not significantly different when compared with EA 1d group (P>0.05). Conclusion In the early stage of multifidus muscles injury, EA Weizhong (BL40) intervention can reduce the excessive activation of CaM and CaMK II, reduce the excessive production of iNOS in tissues, and alleviate tissue inflammation injury.
〔Keywords〕 multifidus muscle; spinal cord; electroacupuncture; Weizhong (BL40); hippocampus; almodulin
钙调蛋白(calmodulin,CaM)是广泛存在于真核生物细胞内的一种钙离子特异性蛋白,与细胞内的钙离子相结合后形成Ca2+-CaM复合物,激活下游的钙调蛋白激酶CaMKⅡ,对细胞和机体的多种功能活动产生调节作用[1]。既往研究证实Ca2+-CaM-CaMKⅡ信号通路在机体创伤中发挥重要作用,机体损伤后,往往伴有CaM、CaMKⅡ活性的降低和细胞炎症的发生[2-5]。本研究选取局部注射布比卡因法制备大鼠多裂肌损伤模型,拟研究CaM-CaMKⅡ信号通路在多裂肌损伤中的作用,并阐释电针“委中”干预对多裂肌损伤模型大鼠CaM-CaMKⅡ信号通路的影响。
1 材料与方法
1.1 实验动物
本研究选取清洁级SD雄性大鼠40只,体质量为(280±20) g,购于北京维通利华实验动物技术有限公司[许可证:SCXK(京)2016-0006]。动物饲养于北京中医药大学针灸机理实验室,以普通大鼠饲料喂养,饲养室温度20 ℃,湿度50%。大鼠适应性饲养1周后,随机抽取8只作为空白组,剩余全部参与造模。本实验动物的使用符合科技部颁发的《关于善待实验动物的指导性意见》的相关规定。
1.2 造模方法
本实验采用布比卡因盐酸盐(Sigma公司)多裂肌注射法制备腰多裂肌损伤大鼠模型,团队前期通过多裂肌形态和超微结构的病理改变观察证实了模型的稳定性和可重复性[6]。剩余大鼠称取体质量后按10%的水合氯醛(350 mg/kg)麻醉,操作过程保持无菌。确定大鼠L4、L5棘突后使用4号一次性注射器抽取0.5%布比卡因溶液在L4-L5棘突水平的双侧的多裂肌处注射100 ?滋L。进针过程中保持针头紧贴棘突骨面进入多裂肌,当枕头接触到关节突和乳突所在骨面回抽无血则表明针头已到达腰多裂肌注射点,注射时间应大于等于3 s,以利于藥物的吸收。完成整个造模过程共注射4个点(L4、L5棘突水平左右各一点),每点注射100 ?滋L。
1.3 分组及干预方式
空白组:8只,不做任何处理,只做观察,与其它组大鼠同步取材。
模型组:造模后随机抽取模型1 d组8只和模型3 d组8只,观察完成后同步取材。
电针组:随机抽取电针1 d组8只和电针3 d组8只。将大鼠俯卧固定后暴露后肢,选取双侧“委中穴”[7](膝关节背面正中)针刺,接韩式电针仪 (HANS200A,北京思盛达医疗器械公司),2/100 Hz的疏密波,电流强度1~2 mA,持续20 min,1次/d。
每组分别在治疗的第1、3天的时间点同步取材各8只。
1.4 动物取材
各组大鼠称取体质量后以10%水合氯醛(350 mg/kg)行腹腔注射麻醉后取材。剔除大鼠背部皮毛、浅筋膜,充分暴露腰部肌肉,剥离竖脊肌和髂肋肌,锐性切除L4和L5节段多裂肌组织,取多裂肌置于4%多聚甲醛溶液中固定氮保存。冰盘上分离取出腰椎脊髓,液氮中保存,待测。断头取脑,冰盘上迅速分离取出海马,液氮中保存,待测。
1.5 指标检测
将备好的多裂肌组织、脊髓组织、海马组织高速离心后的组织上清液按照1∶30倍的洗涤液用去离子水稀释后搅拌均匀低温保存。采用酶联免疫吸附法检测多裂肌、脊髓、海马组织中的CaM、CaMKⅡ、iNOS的含量。
从试剂盒中取出标准品,按照6 000~10 000 r/min高速离心30 s。取5个1.5 mL离心管(S5-S1)依次排列,各加入150 ?滋L样本稀释液,吸取150 ?滋L标准品到第1个离心管中(S5),轻轻混匀,从S5中吸取150 ?滋L到第2个离心管(S4),轻轻混匀,依次对标准品稀释。将各种试剂移至室温(18~25 ℃)下平衡静置30 min后按前述方法配制试剂,备用。分别设空白孔(空白孔不加样品及酶标试剂,其余步骤相同)、标准品孔、待测样本孔。每孔分别加标准品或待测样品50 ?滋L,轻轻晃动混匀,覆上板贴,37 ℃温育30 min后弃去液体,甩干,洗板3次。每次浸泡2 min,250 ?滋L/孔,甩干。每孔加酶标试剂50 ?滋L,覆上新的板贴,37 ℃温育30 min后弃去孔内液体,甩干,洗板5次。每次浸泡2 min,200 ?滋L/孔,甩干。每孔依序加入底物溶液A 50 ?滋L、底物溶液B 50 ?滋L,37 ℃避光显色10 min。依序在每孔中加入终止液50 ?滋L,终止反应。在反应终止后5 min内用酶标仪在450 nm波长依序测量各孔的光密度(OD值)。
1.6 统计学分析
采用SPSS 22.0软件对数据分析,计量资料进行正态性检验后,不同组间比较采用单因素方差分析(One-Way ANOVA),方差齐性检验用LSD-t检验,方差不齐时用Welch检验,对于不符合正态性分布的数据采用非参数检验。每组样本数据用“x±s”表示,以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
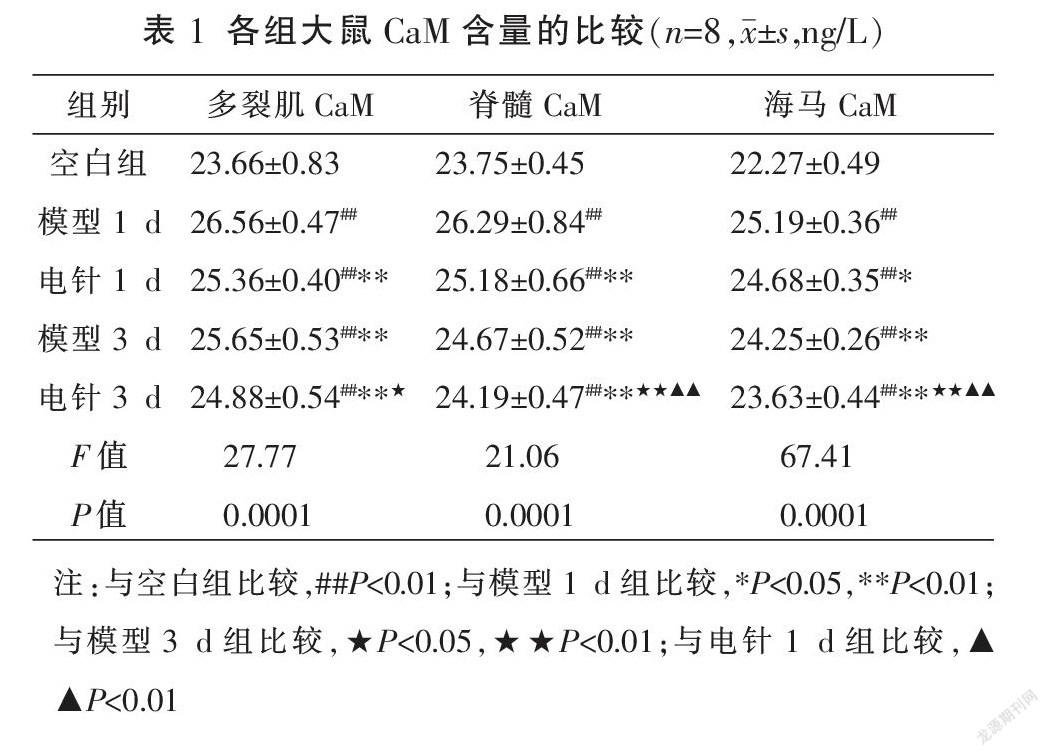
2.1 各组大鼠不同部位组织中CaM含量的比较
与空白组比较,其余4组多裂肌脊髓海马中CaM的含量较之显著升高(P<0.01);与模型1 d组比较,电针1 d组、模型3 d组和电针3 d组多裂肌、脊髓、海马中CaM的含量降低(P<0.05或P<0.01);与模型3 d组比较,电针3 d组多裂肌、脊髓、海马中CaM的含量降低(P<0.05或P<0.01);与电针1 d组比较,电针3 d组多裂肌中CaM的含量差异无统计学意义(P>0.05),脊髓和海马中CaM的含量显著降低(P<0.01)。见表1。
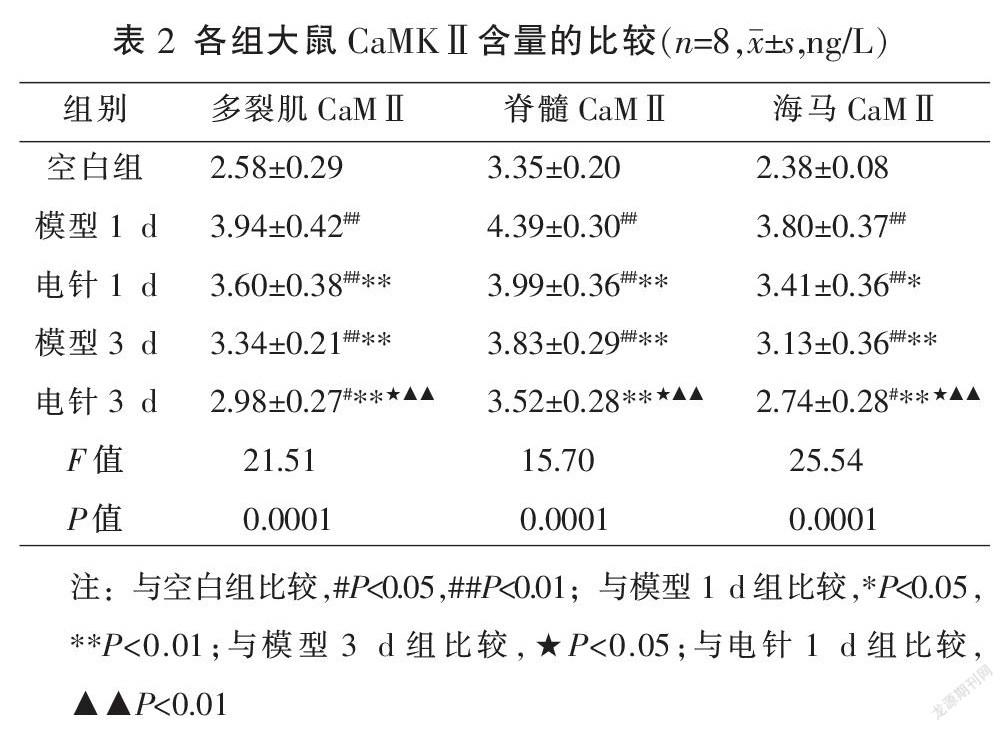
2.2 各组大鼠不同部位组织中CaMKⅡ含量的比较
与空白组比较,模型1 d组、电针1 d组、模型3 d组多裂肌、脊髓、海马中CaMKII的含量显著升高(P<0.01),电针3 d组多裂肌、海马中的CaMKII的含量升高(P<0.05),电针3 d组脊髓中CaMKII的含量较之升高但差异无统计学意义(P>0.05);与模型1 d组比较,电针1 d组、模型3 d组和电针3 d组多裂肌、脊髓、海马中CaMKII的含量降低(P<0.05或P<0.01);与模型3 d组比较,电针3 d组多裂肌、脊髓、海马中CaMKII的含量降低(P<0.05);与电针1 d组比较,电针3 d组多裂肌、脊髓、海马中CaMKII的含量显著降低(P<0.01)。见表2。
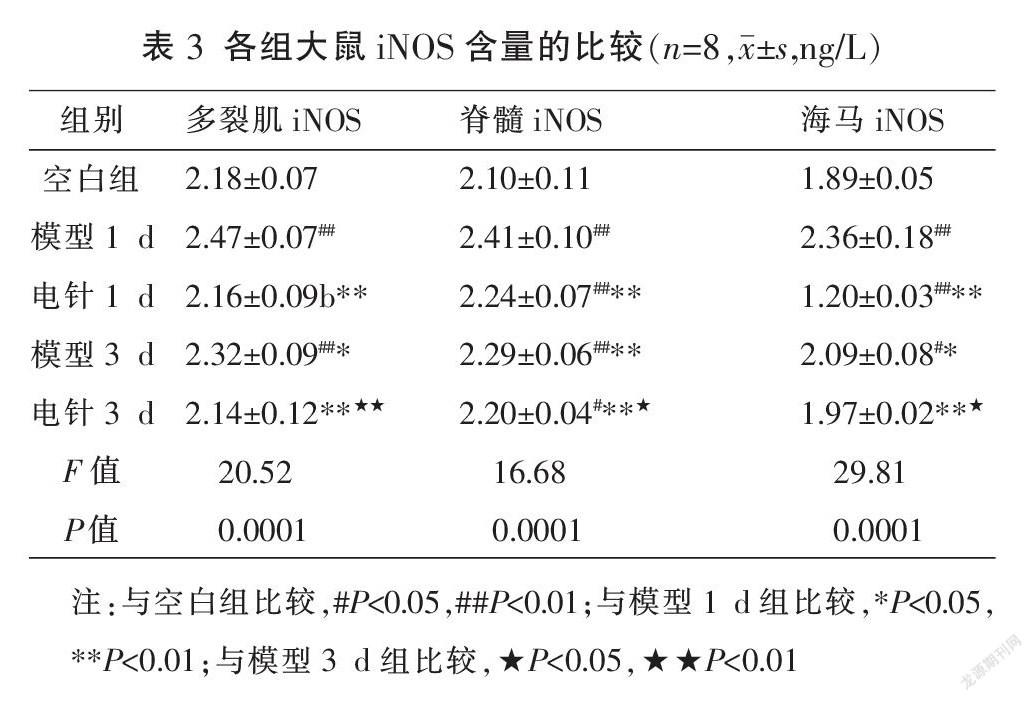
2.3 各组大鼠不同部位组织中iNOS含量的比较
与空白组比较,模型1 d组和模型3 d组多裂肌、脊髓、海马中iNOS的含量升高(P<0.05或P<0.01),电针1 d组和电针3 d组多裂肌中iNOS的含量差异无统计学意义(P>0.05),电针1 d组脊髓、海马中iNOS的含量显著升高(P<0.01),电针3 d组脊髓中iNOS的含量升高(P<0.05),电针3 d组海马中iNOS的含量升高但差异无统计学意义(P>0.05);与模型1 d组比较,电针1 d组、模型3 d组和电针3 d组多裂肌、脊髓、海马中iNOS的含量降低(P<0.05或P<0.01);与模型3 d组比较,电针3 d组多裂肌、脊髓、海马中iNOS的含量降低(P<0.05或P<0.01);与电针1 d组比较,电针3 d组多裂肌、脊髓、海马中的iNOS的含量降低但差异无统计学意义(P>0.05)。见表3。
3 讨论
Ca2+是生物体内的经典信使,与特定蛋白结合后参与细胞内的诸多生化反应[8]。CaM是细胞内的与Ca2+结合的靶蛋白,与钙离子结合形成Ca2+-CaM复合物通过激活靶向酶CaMKⅡ而发挥生物活性作用[9]。既往研究[10-12]表明,Ca2+-CaM-CaMKⅡ通路也参与诸多疾病的发生发展过程。CaMKⅡ活性异常可破坏骨骼肌细胞内的钙离子平衡,导致骨骼肌细胞凋亡,最终引起骨骼肌损伤及功能异常。史丹丹等[13]使用大鼠胫骨前肌损伤模型验证钙调蛋白信号通路在骨骼肌炎症中的作用,结果发现,在胫骨前肌损伤急性期CaM呈现高水平表达,而在修复期CaM表达水平降低。曾林等[14]研究发现,在大鼠咬肌疲劳模型中,骨骼肌细胞中的CaMKⅡ呈现高表达,且CaMKⅡ活性和细胞内的钙离子浓度呈现正相关。刘佳琦、马婧等[15-16]研究发现,颅脑损伤后钙离子大量聚集于神经元细胞内与钙调蛋白结合形成Ca2+-CaM复合物,异常激活的CaMKⅡ通过启动细胞内凋亡程序以及氧化应激反应引起神经元的损伤。NO是常见的炎症细胞因子[17],组织损伤过程中由iNOS诱导而大量产生,引起细胞的凋亡加重损伤[18]。
委中穴为足太阳膀胱经的下合穴,是足太阳膀胱经经脉从腰背部循行至下肢后会合的部位,历代医家把委中穴作为针灸治疗腰痛的特效穴[19]。根据2015年度发布的《腰痛针灸临床实践指南》,委中穴是临床中针灸治疗腰痛的首选穴位[20]。团队前期研究[21-23]已经证实,电针“委中”可通过调节生长因子IGF-1R、IGFBP3,促进骨骼肌细胞自噬,抑制骨骼肌炎症因子IL-17等的过表达,对损伤的多裂肌修复缓解腰痛症状。
本研究采用局部注射布比卡因法制备了多裂肌损伤大鼠模型,从不同时间点观察大鼠多裂肌、脊髓、海马3个层次的的CaM、CaMKⅡ、iNOS活性的变化。结果发现,在造模1 d和3 d后,多裂肌、脊髓、海马CaM、CaMKⅡ、iNOS含量显著高于空白组(P<0.01),表明在骨骼肌急性损伤期,无论在损伤局部组织还是中枢脊髓、海马等部位,均伴有CaM、CaMKⅡ、iNOS含量的升高。造模3 d后,由于机体开始启动内源性修复[24],可见多裂肌、脊髓、海马CaM、CaMKⅡ、iNOS含量较造模1 d后显著降低(P<0.01)。电针“委中”干预1 d后,多裂肌、脊髓、海马CaM、CaMKⅡ、iNOS含量较造模1 d后显著降低(P<0.05或P<0.01)。電针“委中”干预3 d后,多裂肌、脊髓、海马CaM、CaMKⅡ、iNOS含量较造模3 d后显著降低(P<0.05或P<0.01)。电针“委中”干预3 d后,脊髓、海马CaM、CaMKⅡ含量和多裂肌CaMKⅡ显著低于电针干预1 d后(P<0.01);而多裂肌、脊髓、海马iNOS含量,电针干预3 d与电针干预1 d未见差异(P>0.05)。
本研究初步发现,在布比卡因引起的大鼠多裂肌损伤模型中,CaM-CaMKⅡ通路不仅参与多裂肌局部损伤,同时参与脊髓和海马等中枢神经系统的损伤,且在急性损伤期(造模后1 d)比较典型。在损伤早期,使用电针“委中”干预可通过抑制CaM、CaMKⅡ的过度激活,可减少组织中iNOS的过多产生,减轻组织炎症损伤,而关于钙调蛋白信号通路介导的多裂肌损伤后脊髓、海马等中枢部位的病理过程及电针委中的干预机制则需要今后的深入研究做出解释。
参考文献
[1] 刘善慧,刘炳学,房泽岱.英汉药理学辞典[M].北京:中国医药科技出版社,1993:86-87.
[2] ANNA K, WOOKWANG J, JUNGJUN L, et al. Up-regulation of heme oxygenase-1 expression through CaMKII-ERK1/2-Nrf2 signaling mediates the anti-inflammatory effect of bisdemethoxycurcumin in LPS-stimulated macrophages[J]. Free Radical Biology and Medicine, 2010,49(3):323-331.
[3] WU H, KANATOUS S B, THURMOND F A, et al. Regulation of mitochondrial biogenesis in skeletal muscle by CaMK.[J]. Science, 2002,296(5566): 349-352.
[4] FL?譈CK M, WAXHAM M N, HAMILTON M T, et al. Skeletal muscle Ca2+-independent kinase activity increases during either hypertrophy or running[J]. Journal of Applied Physiology, 2000,88(1):352.
[5] CHIN, EVA R. The role of calcium and calcium/calmodulin-dependent kinases in skeletal muscle plasticity and mitochondrial biogenesis[J]. Proceedings of the Nutrition Society, 2004,63(2):279-286.
[6] 陳玉佩,刘 通,邹德辉,等.局部注射布比卡因建立大鼠骨骼肌损伤模型的组织形态学评价[J].中国组织工程研究,2016,20(18):2615-2621.
[7] 王春兰,陈泽林,李桂兰.常用实验动物穴位的标准化定位方法研究[J].天津中医药,2016,33(2):100-103.
[8] 宁 鑫, 张 艳.益气活血复方对慢性心衰大鼠Na+-K+-ATP酶、Ca2+-ATP酶及线粒体蛋白的影响[J].湖南中医药大学学报,2018,
38(9):37-40.
[9] PUROHIT A, ROKITA A G, GUAN X, et al. Oxidized Ca2+/calmodulin-dependent protein kinase II triggers atrial fibrillation.[J]. Circulation, 2013,128(16):1748-1757.
[10] CHEN W, KOOP A, LIU Y, et al. Reduced Threshold for Store-Overload-Induced-Ca2+-Release is a Common Defect of RyR1 Mutations Associated with Malignant Hyperthermia and Central Core Disease[J]. Biochemical Journal, 2017, 474(16):2749-2751.
[11] ZHAO X, YAMAZAKI D, PARK K H, et al. Ca2+ Overload and Sarcoplasmic Reticulum Instability in tric-a Null Skeletal Muscle[J]. Journal of Biological Chemistry, 2010, 285(48):37370-37376.
[12] EILERS W, JASPERS R T, HAAN A D, et al. CaMKII content affects contractile, but not mitochondrial, characteristics in regenerating skeletal muscle[J]. BMC Physiology, 2014(14):7-15.
[13] 史丹丹,曹永英,曹 标,等.钙调蛋白对骨骼肌炎症的干扰效应[J].免疫学杂志,2016,32(9):756-761.
[14] 曾 林,刘 静.咬合干扰大鼠咬肌线粒体钙超载的离子变化特征及其钙调蛋白激酶Ⅱ的调节机制[J].南方医科大学学报,2018,
38(6):755-760.
[15] 刘佳琦,李建民.颅脑损伤后钙调节蛋白激酶活性的研究进展[J].华北理工大学学报(医学版),2015,17(4):73-75.
[16] 马 婧,刘晓莉,乔德才.钙/钙调蛋白依赖性蛋白激酶Ⅱ在突触可塑性和神经精神疾病中的作用[J].中国药理学通报,2018,34(11):10-13.
[17] 叶意红,刘秋佳,康乐蔷薇,等.电针少阳经特定穴对偏头痛大鼠血清中NO、ET-1含量及50%PWT的影响[J].湖南中医药大学学报,2018,38(12):1453-1457.
[18] WANG K, BREMS J J, GAMELLI R L, et al. iNOS/NO signaling regulates apoptosis induced by glycochenodeoxycholate in hepatocytes[J]. Cellular Signalling, 2011, 23(10):1677-1685.
[19] 封迎帅,刘百祥,张 亮,等.电针环跳、委中穴对兔腰椎间盘突出症的影响[J].湖南中医药大学学报,2014,34(11):53-56.
[20] 赵 宏,刘志顺,谢利民,等.《腰痛针灸临床实践指南》解读[J].中国针灸,2015,35(10):1065-1068.
[21] 卢宗孝,晏 珺,于 雪,等.多时间点观察电针“委中”对大鼠腰多裂肌损伤后IGF1R和IGFBP3的表达[J].世界中医药,2018,13(4):954-958.
[22] 晏 珺,卢宗孝,于 雪,等.电针“委中”在大鼠腰多裂肌损伤修复过程中对自噬相关蛋白Beclin1、p62的影响[J].环球中医药,2018,
11(2):161-166.
[23] 邹德辉,陈玉佩,刘 通,等.电针“委中”对布比卡因致大鼠腰多裂肌损伤后形态学及CK、IL-17表达的影响[J].中国针灸,2017,37(9):971-976.
[24] 彭园园,刘 通,陈玉佩,等.电针“委中”对布比卡因致大鼠腰多裂肌损伤后再生及组织形态的影响[J].中国针灸,2016,36(3):287-294.

