不同海洋生物源肝素的理化性质及抗凝血活性
杜振兴,周斯仪,钟赛意,4,*,陈观兰,陈建平,谌素华,洪鹏志,4
(1.广东海洋大学深圳研究院,广东 深圳 518108;2.广东海洋大学食品科技学院,广东 湛江 524088;3.广东省水产品加工与安全重点实验室,广东 湛江 524088;4.广东省海洋生物制品工程实验室,广东 湛江 524088)
肝素因在肝脏中发现而得名,是由糖醛酸(L-艾杜糖醛酸和D-葡萄糖醛酸)和氨基己糖(α-D-葡糖胺)及其衍生物(乙酰化、硫酸化)所组成的一种糖胺聚糖,其中硫酸基和羧基含量很高,是已知负电荷密度最高的生物大分子[1]。因其强大的抗凝血作用,半个多世纪以来,在临床上一直被当作抗凝剂来使用,除此之外,这种天然化合物还具有抗肿瘤、抗血管生成、抗血栓等生物活性。肝素的商业化制备主要以猪和牛的小肠黏膜和肺组织为原料,由于牛海绵状脑病的出现,限制了牛肝素的使用。此外,牛肝素和猪肝素不容易被区分,因此很难保证肝素的物种来源。而受到全世界猪出栏数量和宗教信仰的影响,猪肝素的使用也受到限制。非动物来源的肝素,如化学合成、酶合成和重组肝素,目前还不可用于制药用途,这些因素促使人们寻找新的非哺乳动物来源的肝素[2]。
海洋面积占地球表面积70%以上,庞大的生物库及其独特的环境造就了其丰富的生物资源。近年来,对海洋生物源肝素的研究逐渐增多,已有报道从多种海藻和海洋细菌、红树林蟹、金枪鱼、贻贝和文蛤等多种海洋生物中提取出肝素,并对其结构和活性进行了相关研究[3-6]。本实验选取9 种海洋生物为原料提取肝素粗品,对其进行理化性质分析、结构初步表征及抗凝血活性的研究,为进一步开发海洋生物源肝素产品提供理论依据。
1 材料与方法
1.1 材料与试剂
菲律宾蛤蜊(Ruditapes philippinarum)、海蚌(Mactra antiquata)、海湾扇贝(Argopecten irradias)、象拔蚌(Panopea abrupta)、凡纳滨对虾(Penaeus vannaei)虾头(以下简称虾头)、泥蚶(Tegillarca granosa)、文蛤(Meretrix meretrixL.)、蛏子(Sinonovacula constricta)和钝缀锦蛤(Tapes dorsatus)均购自广东省湛江市水产批发市场,于-20 ℃冷冻保藏。
肝素标准品(191 IU/mg) 中国食品药品检定研究所;肝素钠(150 IU/mg) 北京鼎国昌盛生物技术有限责任公司;胰蛋白酶、木瓜蛋白酶、羊血浆、D-甘露糖(D-mannose,Man)、D-葡萄糖醛酸(D-glucuronic acid,GlcA)、D-半乳糖醛酸(D-galacturonic acid,GalA)、D-无水葡萄糖(D-glucose,Glc)、D-艾杜糖醛酸(D-iduronic acid,IdoA)、D-半乳糖(D-galactose,Gal)、D-木糖(D-xylose,Xyl)、D-阿拉伯糖(D-arabinose,Ara)、D-岩藻糖(D-fucose,Fuc)、N-乙酰-D-半乳糖胺(N-acetyl-D-galactosamine,GalNAc)、N-乙酰-D-葡萄糖胺(N-acetyl-D-glucosamine,GlcNAc)、硫酸氨基葡萄糖(D-glucosamine sulfate,GlcN) 上海源叶生物科技有限公司。乙腈为色谱纯,其他所用试剂均为分析纯。
1.2 仪器与设备
1200高效液相色谱(high performance liquid chromatography, HPLC)仪 美国Agilent公司;UV-2550紫外-可见分光光度计、AUW120型电子分析天平 日本岛津株式会社;Bruker Tensor-27傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪德国B r u k e r公司;旋转蒸发仪 日本E Y E L A公司;FD8508真空冷冻干燥机 韩国ilShin公司;5810R高速台式冷冻离心机 德国Eppendorf公司;HL-6数显恒温水浴锅 常州奥华仪器有限公司。
1.3 方法
1.3.1 海洋生物源肝素的提取
将各种原料清洗、去壳后,加入蒸馏水(料液比为1∶3)置于高速组织捣碎机中匀浆。匀浆液在恒温水浴锅中55 ℃自溶5 h,先后加入质量分数为0.5%的胰蛋白酶(pH 8、37 ℃、6 h)和木瓜蛋白酶(pH 7、65 ℃、6 h)进行酶解[7]。酶解液经灭酶冷却后离心(8 000 r/min、20 min),取上清液加入0.4 倍体积的乙醇,醇沉24 h[1],用蒸馏水对沉淀进行复溶,离心除去不溶物。取上清液加入Sevag试剂(V(氯仿)∶V(正丁醇)=4∶1)脱蛋白,离心(8 000 r/min、20 min),取上清液透析48 h。样液浓缩后进行冷冻干燥处理,最终得到9 种不同海洋生物源的肝素粗品。
1.3.2 海洋生物源肝素的理化性质分析
糖胺聚糖含量测定采用阿利新蓝法[8];蛋白质含量测定采用Folin-Ciocalteu法[9];肝素含量测定采用亚甲基蓝法[10];葡萄糖醛酸含量测定采用硫酸咔唑法[11];氨基葡萄糖含量测定采用Elson-Morgan法[12];硫酸基含量测定采用氯化钡-明胶比浊法[13];硫酸基/羧酸基的测定采用十六烷基氯化吡啶滴定法[14]。
1.3.3 海洋生物源肝素的结构分析
1.3.3.1 紫外光谱分析
将9 种海洋生物源肝素粗品和肝素标准品配成1 mg/L的溶液,在190~400 nm范围内进行紫外光谱(ultraviolet spectroscopy,UV)扫描。
1.3.3.2 FTIR分析
将9 种海洋生物源肝素粗品和肝素标准品与溴化钾以质量比1∶100混合研细后,以溴化钾为空白,在4 000~400 cm-1范围内进行FTIR扫描。
1.3.3.3 单糖组成分析
参考文献[8]和[15],采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)-柱前衍生化HPLC法对9 种肝素粗品进行单糖组成分析。色谱条件:色谱柱为ZORBAX Eclipse XDB-C18分离柱(250 mm×4.6 mm ,5 µm);流动相:磷酸盐缓冲液(0.05 mol/L、pH 6.74)/乙腈(体积比83∶17);流速:1 mL/min;柱温:30 ℃;检测波长:245 nm,紫外检测器;进样体积:10 µL。
1.3.4 海洋生物源肝素的抗凝血活性分析
1.3.4.1 不同海洋生物源肝素效价测定
采用天青A比色法[16]测定肝素效价,分别吸取0.2、0.4、0.6、0.8、1.0 mL肝素钠标准溶液(2 U/mL)于试管中,加蒸馏水至2.0 mL。再加入2.0 mL巴比妥钠缓冲液(pH 8.6)和0.5 mL天青A染色液,混匀,静置5 min,以蒸馏水为空白组,于505 nm波长处测定紫外吸光度。以肝素效价为横坐标,吸光度为纵坐标作标准曲线,建立回归方程。采用同样的方法测定样品肝素吸光度,根据回归方程计算样品肝素效价。
1.3.4.2 不同海洋生物源肝素抗凝血时间比较
配制1 mg/mL样品溶液,以生理盐水为阴性对照,肝素钠标准溶液为阳性对照,在2 mL离心管中分别加入100 µL羊血浆、20 µL样品溶液和100 µL 0.025 mol/L氯化钙溶液,以相同的方式倒转3 次,置于37 ℃水浴锅中,计算血浆凝固时间,阴性对照组和阳性对照组重复上述方法,每组实验重复3 次[17]。
1.3.4.3 不同海洋生物源肝素抗凝血活性测定
用生理盐水溶解9 种肝素粗品和肝素钠标准品,配制成0.5 mg/mL,以生理盐水为阴性对照,肝素钠标准溶液为阳性对照,根据试剂盒测定凝血3 项指标:活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)和凝血酶时间(thrombin time,TT)[18]。
1.4 数据处理与分析
结果以 ±s形式表示,使用JMP 10、Origin 8软件进行数据处理,采用方差分析显著性差异(P<0.05),评价不同平均值之间的差异性。
2 结果与分析
2.1 不同海洋生物源肝素的理化性质分析结果
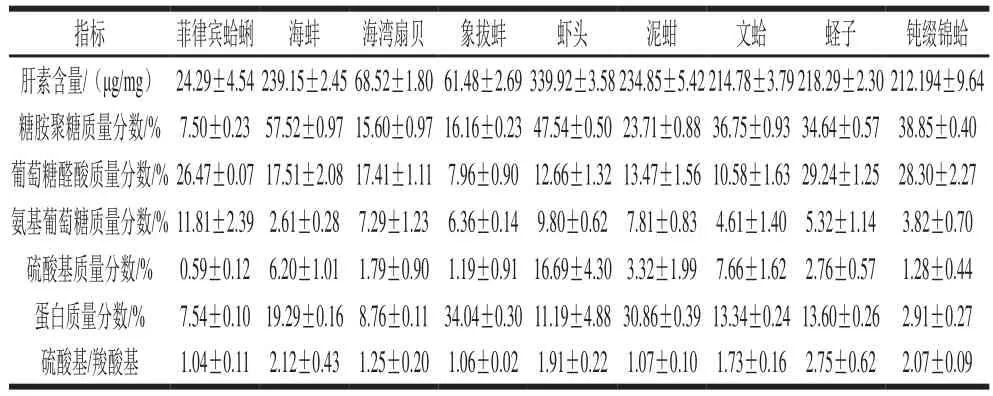
表1 9 种海洋生物源肝素粗品的理化性质比较Table 1 Comparison of physicochemical properties of 9 crude heparin products
如表1所示,不同海洋生物源粗肝素的理化性质具有较大的差异。其中虾头和海蚌粗肝素的肝素含量与糖胺聚糖质量分数较大,其次是泥蚶、文蛤、蛏子与钝缀锦蛤粗肝素,而海湾扇贝、象拔蚌和菲律宾蛤蜊粗肝素的肝素含量与糖胺聚糖质量分数较少。菲律宾蛤蜊、蛏子和钝缀锦蛤粗肝素具有较高的葡萄糖醛酸质量分数,分别为(26.47±0.07)%、(29.24±1.25)%和(28.30±2.27)%。虾头与菲律宾蛤蜊粗肝素的氨基葡萄糖质量分数较高,分别为(9.80±0.62)%和(11.81±2.39)%。海蚌、虾头与文蛤粗肝素具有相对较高的硫酸基质量分数,分别为(6.20±1.01)%、(16.69±4.30)%、(7.66±1.62)%,而菲律宾蛤蜊粗肝素硫酸基质量分数最少,为(0.59±0.12)%。象拔蚌粗肝素的蛋白质量分数最高,为(34.04±0.30)%。菲律宾蛤蜊、海湾扇贝、象拔蚌和泥蚶粗肝素的硫酸基/羧酸基的比值略大于1,说明其结构可能以单硫酸化二糖为主,含有少量过硫酸化二糖单位。虾头和文蛤粗肝素的硫酸基与羧酸基比值分别为1.91±0.22和1.73±0.16,其结构可能以过硫酸化二糖为主,含有少量的单硫酸化二糖单位。海蚌、蛏子与钝缀锦蛤粗肝素的硫酸基与羧酸基比值均大于2,说明其结构含有较多的过硫酸化二糖[19]。
2.2 不同海洋生物源肝素的结构分析结果
2.2.1 紫外光谱分析结果

图1 9 种海洋生物源肝素粗品(A、B)的紫外光谱Fig. 1 UV spectra of 9 crude (A, B) heparin samples
肝素的紫外光谱特征吸收峰在185~220 nm波长之间[1],由图1可知,肝素标准品在198 nm波长处具有特征吸收峰,菲律宾蛤蜊粗肝素的吸收峰在194 nm波长处,海蚌、海湾扇贝、象拔蚌、泥蚶和钝缀锦蛤粗肝素的吸收峰在198 nm波长处,虾头、文蛤和蛏子粗肝素在194、198 nm波长处具有吸收峰,均符合肝素的紫外特征吸收。钝缀锦蛤粗肝素在260 nm波长处具有较大的吸收峰,说明其核酸含量可能较高。
2.2.2 FTIR分析结果

图2 9 种海洋生物源肝素粗品的FTIR图谱Fig. 2 FTIR spectra of 9 crude heparin samples
对各提取物在400~4 000 cm-1波数范围内进行FTIR扫描,结构分析结果如图2,振动方式和官能团分析见表2。9 种海洋生物源肝素提取物与肝素钠的FTIR图谱基本一致,在1 240 cm-1处呈现O—S键伸缩振动的强吸收峰,在890、940 cm-1处表现出肝素的特征吸收,在800~850 cm-1处表现出氨基己糖上硫酸基团的C—O—S系统伸缩振动吸收谱带[1,20-21]。由官能团分析可知,肝素钠和象拔蚌肝素提取物含有羟基、氨基、酰胺基、羧基和硫酸基,单糖构型为β-吡喃糖;菲律宾蛤蜊、海湾扇贝、蛏子和钝缀锦蛤的提取物均含有羟基、氨基、酰胺基、羧基和硫酸基,单糖构型为α-吡喃糖;海蚌和泥蚶提取物均含有羟基、氨基、酰胺基、羧基和硫酸基,单糖构型为吡喃糖单体;虾头提取物含有羟基、氨基、羧基和硫酸基,单糖构型为α-吡喃糖;文蛤提取物含有羟基、氨基、羧基和硫酸基,属于吡喃糖[14,22-26]。

表2 9 种海洋生物源肝素粗品FTIR谱图分析Table 2 FTIR spectral analysis of 9 crude heparin products
2.2.3 单糖组成分析结果

图3 单糖标准品PMP-衍生物HPLC图Fig. 3 HPLC chromatograms of PMP derivatives of monosaccharides
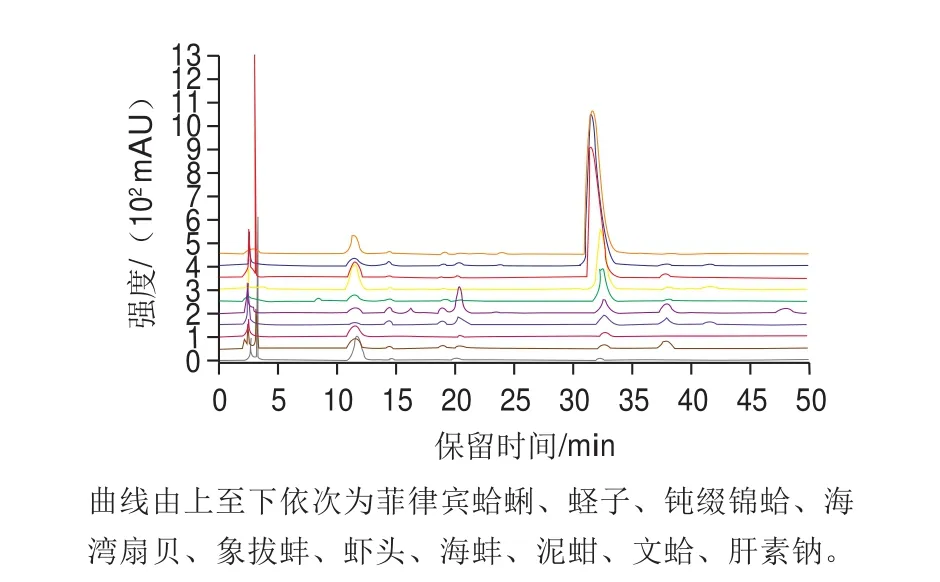
图4 9 种海洋生物源肝素粗品水解后的PMP-衍生物HPLC图Fig. 4 HPLC chromatograms of PMP-derivatized acid hydrolysates of 9 crude heparin samples

表3 9 种海洋生物源肝素粗品单糖组成Table 3 Monosaccharide composition of 9 crude heparin products%
由图4和表3可知,9 种海洋生物源粗肝素水解后单糖组成略微存在差异,其中海蚌、海湾扇贝、虾头、泥蚶、文蛤、蛏子的肝素粗品均由Man、GlcN、GlcA、GalA、Glc、Gal、Xyl、Ara和Fuc 9 种单糖组成,菲律宾蛤蜊、象拔蚌和钝缀锦蛤粗肝素则主要由Man、GlcN、GlcA、Glc、Gal和Ara 6 种单糖组成。由表3可知,除了文蛤粗肝素外,其他粗肝素均为Glc相对含量最高,而文蛤粗肝素的Gal相对含量最高。由图4可知,在18.976 min处出现未知峰,后通过与IdoA标准品出峰时间(18.740 min)比对,可判断该峰为艾杜糖醛酸。所以9 种肝素粗品均具有IdoA、GlcA和GlcN,与肝素钠标准品的单糖组成基本一致,符合肝素的主要单糖组成[1]。
2.3 不同海洋生物源肝素抗凝血活性分析结果
2.3.1 肝素效价比较

图5 9 种海洋生物源肝素粗品效价比较Fig. 5 Comparison of titers of crude heparin samples from 9 species of marine organisms
采用天青A比色法测定9 种海洋生物源肝素粗品的效价,由图5可知,不同种类的粗肝素效价大小依次为海蚌>虾头>文蛤>钝缀锦蛤>蛏子>泥蚶>象拔蚌>海湾扇贝>菲律宾蛤蜊。其中菲律宾蛤蜊、海湾扇贝、象拔蚌和泥蚶的粗肝素效价较低,在24.1~29.6 U/mg之间,海蚌和虾头的粗肝素效价较高,分别为69.1 U/mg和59.3 U/mg。国外有学者提取的虾头肝素纯品效价为95.0 U/mg,蟹肝素效价为52.0 U/mg,意大利蛤蜊效价为52.0 U/mg,而传统猪牛羊肝素效价在139.0~171.0 U/mg之间[27-30],可见海洋生物源肝素的效价普遍低于猪牛羊肝素,可为开发具有温和抗凝血效应的肝素提供新原料。
2.3.2 不同海洋生物源肝素抗凝血时间比较

表4 9 种海洋生物源肝素粗品抗凝血时间比较Table 4 Comparison of anticoagulant time of 9 crude heparin products

图6 9 种海洋生物源肝素粗品在10 min时的凝血状态比较Fig. 6 Comparison of anticoagulation activity of 9 crude heparin products at 10 min
由表4可知,肝素钠标准品抗凝血时间为(4 170±33)s,9 种海洋生物源肝素粗品抗凝血时间在73~2 916 s之间,其中海蚌、文蛤和虾头的抗凝血时间分别为(2 916±49)、(2 194±46)、(2 613±18)s,相当于肝素钠抗凝血时间的0.5~0.7 倍。由图6可见,10 min时,生理盐水、菲律宾蛤蜊、海湾扇贝、象拔蚌和泥蚶所对应离心管中的血浆已完全凝固,钝缀锦蛤蜊管和蛏子管中的血浆呈半凝固状态,虾头、文蛤、海蚌和肝素钠管中的血浆呈流动状态。综上可知,9 种肝素粗品具有不同强度的抗凝血作用,其中最强的海蚌肝素粗品相当于0.72 倍肝素钠作用,最弱的菲律宾蛤蜊肝素粗品相当于0.02 倍肝素钠的作用。
2.3.3 不同海洋生物源肝素体外抗凝血活性比较

图7 9 种海洋生物源肝素粗品抗凝血活性比较Fig. 7 Comparison of anticoagulant activity of 9 crude heparin products
APTT、PT、TT在医学上常被用来表征试样的抗凝血活性,3 个指标分别反映内源凝血系统、外源凝血系统和血浆纤维蛋白原转化为纤维蛋白的凝血情况[31]。根据图7可知,不同海洋生物源的肝素粗品对凝血3 项指标的影响存在差异。与生理盐水组比,除了菲律宾蛤蜊外的其他8 种粗肝素均对血浆APTT的影响存在显著差异,其抑制强度依次为:海蚌>文蛤>虾头>蛏子>钝缀锦蛤>象拔蚌>泥蚶>海湾扇贝,其中海蚌和文蛤对血浆APTT的抑制强度较强,但仅约为肝素钠对血浆APTT抑制强度的一半。9 种肝素粗品对血浆PT的抑制强度依次为:海蚌>文蛤>虾头>钝缀锦蛤>蛏子>泥蚶>海湾扇贝>象拔蚌>菲律宾蛤蜊,与生理盐水组比,海蚌、文蛤、虾头、钝缀锦蛤、蛏子和泥蚶的肝素粗品对血浆PT的抑制作用存在显著性差异,而菲律宾蛤蜊、海湾扇贝和象拔蚌的肝素粗品无显著性差异。与生理盐水组相比,仅有海蚌、虾头和文蛤的肝素粗品对血浆TT的影响存在显著差异,其中海蚌和虾头的肝素粗品对血浆TT的抑制作用接近肝素钠对血浆TT的抑制作用。
结合3 项指标可得,海蚌、虾头和文蛤的肝素粗品通过抑制血浆内源凝血系统和外源凝血系统,同时抑制血浆纤维蛋白原转化为纤维蛋白而发挥抗凝血作用,其中虾头和文蛤肝素粗品的抗凝血活性更多地表现在对血浆内源凝血系统和纤维蛋白原转化为纤维蛋白的抑制作用上,而海蚌粗肝素的抗凝活性最佳,且与阳性对照肝素钠相比,其抗凝血作用更为温和。泥蚶、蛏子和钝缀锦蛤的肝素粗品通过抑制血浆内源凝血系统和外源凝血系统而发挥抗凝血作用,象拔蚌和海湾扇贝肝素粗品通过抑制血浆内源凝血系统而发挥抗凝血作用,而菲律宾蛤蜊肝素粗品通过抑制血浆纤维蛋白原转化为纤维蛋白而起到微弱的抗凝血作用[32]。导致菲律宾蛤蜊、象拔蚌和海湾扇贝的肝素粗品抗凝血活性较低的原因可能是其硫酸基含量和肝素含量偏低,而海蚌、虾头和文蛤的肝素粗品抗凝血活性相对较高,可能与它们较高的硫酸基含量和肝素含量有关[33]。
3 结 论
本实验通过双酶酶解法从9 种海洋生物中提取出了肝素粗品,并对其理化性质、结构特性及抗凝血活性进行了研究。理化性质分析结果表明,不同海洋生物源粗肝素的理化性质存在差异,可见无论是海洋生物源肝素还是陆地哺乳动物源肝素,理化性质都随着来源的不同而存在差异。海蚌、虾头、泥蚶、文蛤、蛏子和钝缀锦蛤的肝素粗品肝素含量较高,约在21%~34%之间;虾头、海蚌和文蛤的肝素粗品硫酸基质量分数较高,分别为(16.69±4.30)%、(6.20±1.01)%和(7.66±1.62)%,同时它们抗凝血活性也较高,说明硫酸基含量是影响抗凝血活性的因素之一。
结构分析结果表明,9 种海洋生物源肝素粗品在185~220 nm波长之间具有紫外吸收峰,符合肝素的紫外吸收特征;FTIR分析可知,9 种肝素粗品均是吡喃糖,在1 240 cm-1处呈现O—S键伸缩振动的强吸收峰,在890、940 cm-1处表现出肝素的特征吸收,在800~850 cm-1处表现出氨基己糖上硫酸基团的C—O—S伸缩振动吸收谱带,符合肝素的红外吸收特征;单糖组成分析可知,海蚌、海湾扇贝、虾头、泥蚶、文蛤、蛏子的肝素粗品均由Man、GlcN、GlcA、IdoA、GalA、Glc、Gal、Xyl、Ara和Fuc 10 种单糖组成,菲律宾蛤蜊、象拔蚌和钝缀锦蛤粗肝素则主要由Man、GlcN、IdoA、GlcA、Glc、Gal和Ara 7 种单糖组成,9 种肝素粗品均具有IdoA、GlcA和GlcN,符合肝素的主要单糖组成。
肝素具有多样的生物活性,包括抗血栓、抑制补体活化、抗炎、抗病毒和抑制血管生成等,其中抗凝血活性作用最显著。由于很强的抗凝血活性容易导致出血效应,所以从根本上限制了肝素的其他活性在临床上的运用。肝素的活性中,并不是所有活性都与抗凝血活性存在相关性,如抑制平滑肌细胞生长、抗炎作用则不依赖于抗凝血活性,开发这类活性的肝素产品则需要抗凝活性低的肝素,而抗凝血活性相对温和的肝素则更利于开发出具有抗血栓功能和低副作用的肝素产品。本实验中,9 种海洋生物源粗肝素表现出了不同程度的抗凝血活性,这对开发不同活性的肝素产品具有参考意义。

