外泌体在糖尿病发生发展过程中的作用研究进展
卞欢,王颖,徐寒梅
(江苏省合成多肽药物发现与评价工程研究中心,江苏 南京 211198)
外泌体(exosomes)是一种直径30 ~ 100 nm的囊泡样小体,由细胞多囊泡体与细胞膜融合时释放,广泛存在于细胞内和血浆、唾液、尿液、脑脊液、羊水和母乳等体液中[1-2]。外泌体具有脂质双分子层结构,携带多种特异性和非特异性蛋白质、磷脂酸等,以及mRNA、miRNA、lncRNA、siRNA、mtDNA等不同核酸成分,使这些在细胞外液中易失活或降解的组分在体内循环,安全转移至邻近和远端的靶细胞[3]。研究表明:外泌体可以介导细胞间信息交流,这种交流主要通过直接作用于表面信号分子、膜融合后RNAs的胞内调节以及生物活性成分的胞外释放,具有调控细胞凋亡、产生细胞因子以及调节免疫等诸多功能[1]。目前已发现外泌体在癌症[4]、感染[5]、妊娠并发症[6]、自身免疫性疾病和代谢性疾病[6]等多种人类疾病中均发挥重要作用。
糖尿病是一种以高血糖为特征的代谢性疾病,包括1型糖尿病(T1DM)、2型糖尿病(T2DM)、妊娠期糖尿病,以及内分泌疾病和病毒感染等引起的其他特殊类型糖尿病。随着人口老龄化和生活方式的改变,我国糖尿病患病率从1980年的0.67%飙升至2013年的10.4%,截至2017年,我国糖尿病患者数量已达到1.144亿,人数居全球首位[7]。研究发现,产生胰岛素的胰岛β细胞与胰岛素敏感组织如大脑、肝脏、脂肪和肌肉等分泌的外泌体能够转移至其他代谢器官、免疫细胞以及内皮细胞中,可维持葡萄糖稳态或加重胰岛素抵抗(见图1)[8-9]。本文就胰岛β细胞、脂肪组织、肌肉组织、干细胞和血液等来源外泌体对糖尿病发病机制、诊断和治疗等方面的影响作一综述。

图 1 糖尿病发生发展过程中外泌体参与细胞组织间通讯的示意图Figure 1 Schematic diagram of exosomes participating in intercellular communication in the pathogenesis and progression of diabetes mellitus
1 胰岛β细胞来源外泌体
胰腺β细胞来源外泌体中富含大量miRNA,可以广泛调节胰腺β细胞稳态关键基因,是调节细胞间通信和血糖水平的新介质[10]。Zhang等[11]研究发现,原代小鼠胰岛细胞和胰岛细胞系MIN6在高葡萄糖、高KCl、高精氨酸和高游离脂肪酸等不同的胰岛素分泌刺激条件下,会产生携带不同miRNA的外泌体。生理状态下,高水平的血糖会刺激胰岛分泌特异性miRNA,如miR-375和miR-223。miR-375在胰腺中特异性表达,可调节参与激素分泌的基因表达以及响应胰岛素抵抗的β细胞群增殖[12-13],并可通过外泌体转运至其他组织或器官中;miR-223可以促进骨骼肌和肝组织中的葡萄糖转运体 4(GLUT4)表达,改善葡萄糖摄取。Guay等[14]研究显示,胰岛β细胞在加入干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)等促炎细胞因子培养之后,产生的外泌体miRNA水平转移至邻近β细胞,诱导了细胞凋亡,最终导致T1DM的进展。除了调节对β细胞应激的生理和病理反应,β细胞来源外泌体还能与免疫细胞相互作用,在糖尿病发展期间激活或增加β细胞炎症和破坏自身免疫过程。T1DM往往伴随着内质网(ER)应激现象,细胞因子诱导的ER应激可促进胰腺β细胞外泌体的分泌,外泌体中携带谷氨酸脱羧酶65(GAD65)、蛋白酪氨酸磷酸酶2(IA-2)和胰岛素原(proinsulin)等自身抗原,同时可诱导免疫刺激伴侣蛋白钙网蛋白、Gp96和ORP150的释放,这种携带自身抗原和促炎信号组合的胰岛β细胞来源外泌体被树突状细胞(DC)吞噬后,会激活抗原呈递功能并活化T细胞,从而启动T1DM自身免疫反应[15-16]。人类胰岛β细胞来源外泌体还能够将血管内皮生长因子(VEGF)A和内皮型一氧化氮合酶(eNOS)等的mRNA运送到胰岛内皮细胞中以传递信号,从而促进内皮细胞活化和血管生成,同时还有一类被称为“angiomiRs”的miRNA,包括miR-27b、miR-126、miR-130和 miR-296,它们同样能够在内皮细胞中通过激活VEGF等生长因子的信号转导,从而在新血管生成过程中发挥作用[17]。
2 脂肪组织来源外泌体
肥胖与T2DM有着密切关系,肥胖会导致体内产生炎性环境,诱发胰岛素抵抗[18],脂肪组织是肥胖状态下循环miRNA的主要来源[19-20],这些循环miRNA由外泌体转运并作用于全身,因此脂肪组织来源的外泌体可以作为近端和远端组织中新陈代谢的调节剂,提供了细胞间通信的新机制。研究发现,肥胖个体脂肪组织中的外泌体可以通过Toll样受体4(TLR4)依赖性方式诱导巨噬细胞活化,促进炎症因子IL-6和TNF-α的分泌,增强巨噬细胞向脂肪组织和肝脏的迁移,并促进胰岛素抵抗的发展[21-22]。同时脂肪组织也能分泌脂肪组织巨噬细胞来源外泌体(ATM-Exos),肥胖小鼠ATM-Exos作用于正常小鼠时会引起葡萄糖不耐受和胰岛素抵抗,相反从正常小鼠获得的ATM-Exos作用于肥胖小鼠时能改善葡萄糖耐量和胰岛素敏感性[23]。Yu等[24]发现,脂肪细胞外泌体可通过miR-27a介导抑制过氧化物酶体增殖剂激活受体γ(PPARγ)及其下游基因Glut4和胰岛素受体底物(Irs-1),在骨骼肌细胞中积累并破坏胰岛素依赖性葡萄糖摄取,从而诱导骨骼肌胰岛素抵抗。脂肪干细胞是一种脂肪组织源性间充质干细胞,其外泌体可以上调炎症脂肪细胞的瘦素表达[25],同时将携带的活性信号转导子与转录活化子3(STAT3)转移到巨噬细胞中,从而激活精氨酸酶1(Arg-1),驱使M2巨噬细胞极化,诱导的M2巨噬细胞不仅高表达酪氨酸羟化酶和IL-10,而且还可促进脂肪干细胞增殖和乳酸产生,从而响应高脂肪激发的白色脂肪棕色化,促进白色脂肪中的免疫和代谢稳态,为肥胖和糖尿病提供潜在的治疗手段[26]。心血管疾病是T2DM常见且致命的并发症,患者动脉粥样硬化引起的心肌梗死、卒中、心源性猝死等是主要的死亡原因。Wang等[27]对其发病机制进行研究发现,胰岛素抵抗脂肪细胞外泌体可通过Shh信号通路诱导滋养血管增生,增加斑块负荷,促进斑块易感性,最终导致动脉粥样硬化斑块破裂。对肥胖与非肥胖个体内脏脂肪外泌体进行检测发现,内脏脂肪外泌体中的miRNA作用于转化生长因子β(TGF-β)和Wnt/β-catenin信号通路,而这2种信号通路对纤维化疾病的发生、发展具有重要影响,包括肺纤维化、肝纤维化、肾纤维化、心肌纤维化、视网膜纤维增生等[28]。
3 肌肉组织来源外泌体
流行病学研究显示,耐力运动可以诱导骨骼肌释放富含多肽和核酸的外泌体进入循环系统并作用于全身,缓解包括T2DM在内多种代谢性疾病的影响,并且外泌体含量会随着耐力运动强度的上升而增加[6]。研究发现,在肌肉生成过程中,C2C12成肌细胞外泌体miRNA参与肌细胞分化的重要信号传导途径(如Wnt等);而肌管外泌体可将miRNA和siRNA转移到成肌细胞中,沉默成肌细胞去乙酰化酶1(Sirt1)基因并促进其分化,成肌细胞和肌管外泌体相互作用,从而调节骨骼肌代谢动态平衡[29]。脂质组学分析显示,经棕榈酸酯处理的C2C12细胞能够产生富含棕榈酸酯的外泌体,该外泌体通过向其他正常肌细胞转移这种有害的脂质成分,诱导成肌细胞增殖并参与细胞周期调节和肌肉分化基因的表达,通过“旁分泌样”信号改变肌肉动态平衡,并通过骨骼肌外泌体将特定信号转移至关键代谢组织[30]。除了骨骼肌,心肌组织也在糖尿病中起着重要作用,糖尿病患者往往会出现心脏血管生成不足、功能损伤的现象,Wang等[31]发现,2型糖尿病Goto-Kakizaki(GK)大鼠心肌细胞外泌体miR-320过表达,该外泌体转移至心脏内皮细胞后,miR-320功能性下调其靶基因胰岛素样生长因子1(Igf-1)、热休克蛋白20(Hsp20)和人红血细胞增多症病毒致癌基因同源体2(Ets2),抑制心脏内皮细胞增殖、迁移和管腔样结构形成,从而抗血管生成。另外,该团队还发现了心肌细胞外泌体含有低水平的HSP20,可导致小鼠心脏功能障碍、心脏肥大、心肌细胞凋亡和纤维化,引发心脏不良重构[32]。因此,心肌细胞miR-320和HSP20改造外泌体有望成为潜在的新型糖尿病心肌病治疗剂。
4 干细胞来源外泌体
干细胞是一类具有自我更新和分化潜能的细胞,目前Ⅰ/Ⅱ期临床试验中已有通过移植人胚胎干细胞来源的胰腺内胚层细胞治疗T1DM,成功定向分化并产生了功能性胰岛样结构,随后进一步成熟生长为能够响应葡萄糖和胰岛素变化的β细胞;临床上还采用脐带间充质干细胞(MSC)用于T2DM治疗,其能够显著降低血糖和糖化血红蛋白水平,减少全身炎症和T淋巴细胞数[33]。但干细胞疗法存在一些挑战,如供体匹配情况、低产量和血栓形成等不良作用,所以干细胞来源外泌体治疗仅是可能的发展方向[34]。目前已发现干细胞来源外泌体可用于修复或预防糖尿病并发症造成的损伤,其免疫调节和修复特性可以保护甚至恢复早期T1DM患者的原始胰岛免受自身免疫破坏,并且可能抑制胰岛移植的排斥反应[35]。MSC是干细胞家族的重要成员,在体外或体内适当诱导条件下,可分化为骨、软骨、脂肪、肌肉、内皮、神经、肝、心肌等多种组织细胞,是目前临床上使用最多的干细胞,人MSC分泌的外泌体可以通过多种渠道在T2DM中发挥作用(见图 2)[36]。
因在体内毒性较低且稳定性较好,具有组织特异性归巢能力,干细胞来源外泌体逐渐被视为可替代脂质体的新型药物递送载体,可以被用于治疗剂的体内和体外包载,且干细胞的永生化不会影响外泌体产生的数量或质量,从而能够实现稳定的外泌体工程生产[37]。
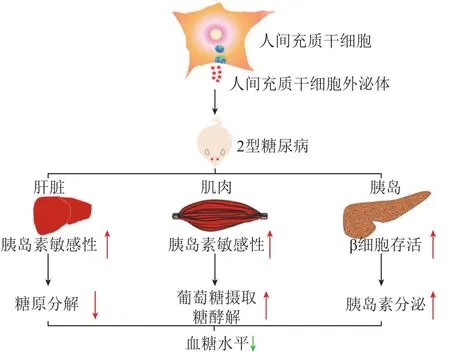
图 2 人间充质干细胞来源外泌体对2型糖尿病的作用示意图Figure 2 Schematic diagram of effects of human mesenchymal stem cell exosomes on type 2 diabetes mellitus
4.1 骨髓间充质干细胞来源外泌体
骨髓间充质干细胞(BMSC)是目前干细胞治疗的首选,被广泛用于神经和组织修复等多种疾病适应证。临床上已经证实,BMSC可以促进内源性中枢神经系统修复[34]。Cui等[38]进一步研究了BMSC来源外泌体的神经修复效果,结果发现,其通过miR-145/三磷酸腺苷结合盒转运体A1(ABCA1)/人胰岛素样生长因子1受体(IGFR1)通路增加血管和神经白质重塑,对T1DM卒中大鼠的神经损伤有很好的修复作用。Nakano等[39]发现,BMSC来源外泌体还可以通过修复海马CA1区域中损伤的神经元和星形胶质细胞来改善链脲佐菌素(STZ)糖尿病小鼠的认知障碍和细胞超微结构异常,是治疗糖尿病患者痴呆的潜在方法。另外,BMSC来源外泌体还有助于改善糖尿病肾病,通过调节细胞间黏附分子1(ICAM-1)、TGF-β1和紧密连接蛋白1(ZO-1)的表达,抑制骨髓来源DC过度渗入肾脏,抑制肾小管间质中的纤维化,并在肾小管上皮细胞中发挥抗凋亡作用[40]。此外,BMSC外泌体在与外周血单个核细胞(PBMC)共培养时,可以通过抑制PBMC增殖以及增强Treg细胞功能来抑制免疫反应,注射这种外泌体能够促进胰岛功能和抑制免疫排斥,显著改善胰岛移植情况[41]。
4.2 胰岛间充质干细胞来源外泌体
已有报道表明:胰岛素瘤细胞来源外泌体能够刺激T1DM模型非肥胖糖尿病(NOD)小鼠的自身免疫应答[42]。Rahman等[43]基于这一现象进一步研究了初级胰岛细胞是否可以产生外泌体,通过分离NOD小鼠胰岛进行体外培养发现,培养的胰岛能够产生一种快速复制、具有成纤维细胞样的胰岛间充质干细胞(iMSC),这些iMSC释放具有高度免疫刺激性的外泌体,可激活小鼠内源性自身反应性B细胞和T细胞,促进T细胞的扩增转移并加速效应T细胞介导的胰岛破坏。另有研究发现,iMSC位于前驱糖尿病正常胰岛的周边,但当淋巴细胞发生浸润时就会逐渐渗透到β细胞区域,释放携带自身抗原的外泌体,从而诱发自身免疫,作用于DC和B细胞,激活T细胞和巨噬细胞,进而引发β细胞损伤[44]。iMSC来源外泌体中含有内源性逆转录病毒(ERV)、囊膜糖蛋白(Env)和核衣壳蛋白(Gag)抗原,异常或过量释放会诱导自体反应性T细胞产生IFN-γ,激活先天性和适应性免疫,触发组织特异性炎症和自身免疫应答,加速效应T细胞介导的胰岛破坏[45]。
4.3 脐带间充质干细胞来源外泌体
临床上移植人脐带间充质干细胞(hucMSC)的T2DM患者显示出相对稳定的血糖水平,一些患者在治疗25 ~ 43个月后不再依赖于胰岛素。Sun等[36]研究发现,hucMSC来源外泌体可以通过促进肌肉中GLUT4的表达和膜转运以及依赖于胰岛素的肝糖原储存来恢复T2DM患者的葡萄糖稳态,抑制STZ诱导的β细胞凋亡,缓解T2DM患者的胰岛素分泌功能障碍。糖尿病心肌病是糖尿病患者死亡的重要原因之一,研究显示hucMSC来源外泌体具有降低糖尿病小鼠血糖和血脂以及改善心脏功能的作用;外泌体中富含miR-22和miR-24,在心肌缺氧复氧的条件下能够减少心肌细胞凋亡,miR-22通过下调窖蛋白3(Cav-3)表达,进而恢复eNOS活性和NO产生,对缺血再灌注损伤心肌发挥保护作用,miR-24则可以调节糖尿病心肌纤维化[46-47]。
4.4 内皮祖细胞来源外泌体
糖尿病状态下内皮祖细胞(EPC)会在1周内迅速从凋亡转变为坏死状态,迁移能力明显受损,可塑性降低并伴随趋化因子2(CXCL2)引起的细胞骨架紊乱,四次跨膜超家族膜蛋白63(CD63)、ALG-2相互作用蛋白X(Alix)和Ras相关蛋白(Rab27a)基因下调,从而导致外泌体分泌数量大幅减少[48]。研究发现,EPC来源外泌体激活ERK1/2信号通路,可以通过旁分泌刺激血管生成相关分子VEGFA和eNOS等的表达,增强血管内皮细胞的增殖、迁移和血管形成,加速皮肤伤口愈合[49-50]。此外,EPC来源外泌体还可以减少C反应蛋白(CRP)和IL-8的表达,抑制T2DM动脉粥样硬化小鼠血管内皮细胞的炎症反应,同时减少活性氧簇(ROS),降低丙二醛(MDA)的表达,抑制血管内皮细胞的氧化应激,对T2DM动脉粥样硬化有一定的治疗效果[51]。
4.5 其他干细胞来源外泌体
除了上述常见的干细胞,研究人员还发现一些特殊的干细胞同样在糖尿病中发挥作用。人循环纤维细胞是一类MSC,其外泌体富含HSP90α和STAT3,能够活化真皮成纤维细胞,诱导角质形成细胞的迁移和增殖,加速糖尿病小鼠体内的伤口闭合,可以被用于治疗糖尿病溃疡[52]。尿源性干细胞(USC)来源外泌体高表达恶性脑肿瘤缺失蛋白1(DMBT1),这种蛋白能够介导内皮细胞血管生成,同样能够加速糖尿病小鼠创面愈合和皮肤再生[53]。
5 血液来源外泌体
生物标志物对预测和诊断复杂多因素代谢性疾病如糖尿病具有极其重要的意义,传统生物标志物如血浆代谢物和细胞因子等已不能可靠地监测疾病各个阶段,外泌体在机体应激致病环境下可从多种组织和细胞分泌释放到血液循环中,可反映代谢性疾病进程中体内功能失调状态[54]。血清和血浆外泌体含有大量稳定的miRNA,可以作为诊断糖尿病的潜在生物标志物[55]。前驱糖尿病早期阶段,血清外泌体水平和外泌体诱导的IFN-γ产生与疾病进展呈正相关,可以用于预测糖尿病的进展情况[43]。在炎症因子作用下,新发T1DM患儿的血清外泌体中miR-21-5p水平急剧上升,从而加速β细胞凋亡,这一现象出现在T1DM患者β细胞功能严重丧失之前,所以血清外泌体miR-21-5p可能是潜在的T1DM检测标志物[56]。胰腺移植对传统治疗无效的T1DM患者来说是最佳治疗方法,但也存在较高的排异反应风险,所以监测免疫排斥非常重要。Vallabhajosyula等[57]在对胰腺移植患者长达5年的随访期内发现,受体血浆能够准确表征供体胰岛β细胞特异性外泌体含量及其miRNA与蛋白质组学的变化,这为移植胰腺提供了非侵入性生物标志物。
除了作为生物标志物,血液来源外泌体还与糖尿病的发病过程有一定的联系。脂联素能够调节糖脂平衡,与T2DM关系密切,Santovito等[58]通过对糖尿病患者和健康人循环外泌体miRNA表达谱分析发现,脂联素家族miRNA let-7a和let-7f表达显著下调,而接受降糖治疗后血糖显著改善的患者会出现循环let-7a和let-7f水平大幅增加的现象。PPARγ是一种调节代谢相关基因转录的核受体,同样在糖尿病信号通路中起着重要作用。Looze等[59]发现,PPARγ存在于血浆来源外泌体中,这为核受体的旁分泌转移提供了一种潜在的新途径。另有研究发现,健康人外周血单核细胞中CD34+细胞亚群会分泌含有angiomiR-126的外泌体,并作用于内皮细胞,从而促进血管生成,而这一过程在糖尿病患者体内被减弱,这也是糖尿病患者心血管修复功能受损的原因之一[60]。
6 结语
综上所述,越来越多的证据表明:外泌体通过将不同分子递送至邻近和偏远组织,在组织特异性和全身代谢的调节中发挥重要作用[61]。虽然人们对外泌体与多种疾病的关系已经进行了充分研究,但人们对外泌体与糖尿病的关系仍然了解甚少。目前的研究多认为,胰岛β细胞和BMSC、iMSC、hucMSC、EPC等多种干细胞来源的外泌体可以调节β细胞信号传导,而脂肪组织、肌肉组织等产生的外泌体可以转移特定的蛋白和核酸到多种胰岛素敏感外周组织,从而调节全身糖脂平衡和炎症环境,在糖尿病发病过程中起着重要作用。另一方面,血液中的循环外泌体可以作为一种无创液体活检生物标志物,用于更加高效精确的早期糖尿病诊断以及预后评估指标。
外泌体相较于细胞体积小,更不容易被机体摄取清除,可以携带其来源细胞的相关成分,安全地到达靶点发挥作用,作为细胞治疗的延伸,在糖尿病治疗中发挥作用[62]。与此同时,外泌体临床应用也和细胞治疗一样要经历长期安全性的考验。外泌体内容物不是固定的,与细胞来源、状态活力和培养环境直接相关,所以还需要对稳定规模化外泌体生产进行深入研究。尽管现在外泌体在糖尿病中的研究还处于起步阶段,但随着理论和技术不断成熟,外泌体必将在糖尿病领域展现出巨大潜力。
——外泌体与老年慢性疾病相关性的研究进展

