抗肿瘤药物心脏安全性评价的药动学-药效学模型
袁漪,何华,柳晓泉
(中国药科大学药物代谢动力学研究中心,江苏 南京 210009)
随着抗肿瘤药物的快速发展,肿瘤患者的存活率显著提高,存活期显著延长。然而,抗肿瘤药物导致的心血管并发症却逐渐成为肿瘤患者致死的主要原因之一[1-2]。虽然药物在临床前研发阶段就经历了严格的心脏毒性筛选,但是临床试验发现,抗肿瘤药物的联合应用会增加患者心血管风险,并且自身患有心血管疾病或者具有潜在的心血管疾病风险患者对抗肿瘤药物的心血管毒性更为敏感[3-4]。针对此问题,近年来兴起的“肿瘤心脏病学”致力于寻求肿瘤治疗与心血管毒性间的平衡,研究如何制定合理的用药方案达到高效低毒的目的,降低肿瘤患者的心血管毒性发生率[5-6]。
药动学-药效学(PK-PD)模型通过仿真模拟可以对给药策略进行优化,从而达到高效低毒的目的[7]。近年来,随着对抗肿瘤药物心血管毒性机制的认识的加深,定量预测心血管毒性的PK-PD模型被广泛用于研究药物的心血管毒性[8-9]。PK-PD模型利用体内外实验数据建立描述药物暴露与其效应的数学模型,研究药物与机体间的相互作用,预测和外推不同剂量的药物对机体的影响。将其应用于抗肿瘤药物的心血管毒性评估可以更好地了解药物的毒性作用机制和量效关系,从而优化患者用药方案,达到高效低毒的目的。目前,PK-PD模型可分为3类,本文就此作一综述。
1 基于经验的心血管毒性PK-PD模型
基于经验的PK-PD模型能够定量阐明血药浓度-时间-毒性效应之间的动态变化规律,广泛应用于药物效应的评价与临床给药方案的优化。
1.1 药物浓度-QT间期量效模型
抗肿瘤药物如蒽环类和酪氨酸激酶抑制剂可延长QT间期(通常采用心率校正后的QT期间,即QTc间期,简称QTc),导致严重心律失常[10-11],关于药物浓度(C)-QTc的量效模型已被大量报道[12-13]。近期发表的一项研究通过建立PK-PD模型描述莫西沙星的药物暴露与QT的关系,模型的主体结构QT间隔时长方程由个体心率校正、昼夜节律和药物效应3个部分组成[14]:
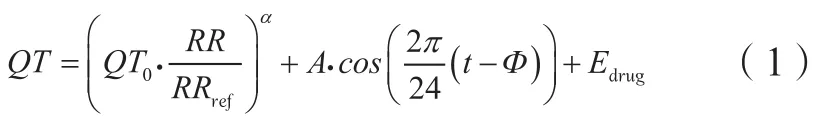
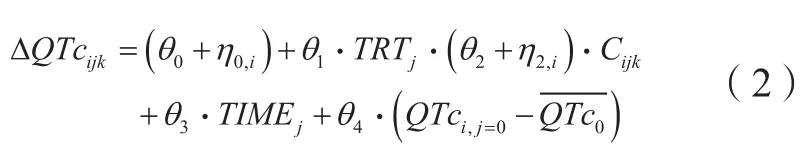
基于Ⅰ期临床试验中的单剂量递增和多剂量递增试验,建立药物浓度与心率校正后的QTc时长变化之间的关系模型,可以作为部分药物进行全面QT研究的替代方法,可靠地排除临床相关的QTc效应[16-17]。自ICH的《非抗心律失常药物致QT/QTc延长及潜在致心律失常作用的临床评价》问答文件[15]发布以来,2种化合物(lemborexant和selonsertib)已经利用这类C-QTc模型从美国、英国和日本的监管机构获得了全面QT研究豁免权[18-19]。然而,利用C-QTc模型评估心脏毒性抗肿瘤药物对QTc的影响仍有许多挑战[20-21]:1)患者除了使用针对性治疗的药物外,还可能使用多种辅助药物,而且不可能测定每种药物的血药浓度;2)与健康志愿者研究相比,肿瘤患者之间的差异更大;3)安慰剂组和阳性对照组样本选择可能不符合伦理规范;4)高剂量组的研究在临床难以进行。
1.2 基于经验的群体PK-PD模型
Liang等[22]建立的乳腺癌患者的群体PK-PD模型描述了多柔比星暴露与48 h内血浆中氨基末端前脑钠肽(NT-proBNP)水平变化间的关系。脑钠肽(BNP)是目前较为公认的心血管毒性生物标志物,BNP水平升高通常反映左心室收缩功能障碍[23]。模型采用三房室及一个代谢室的结构建立多柔比星及其代谢物多柔比星醇的药动学模型,包含5个转导室的间接效应模型连接药物的PK与PD(见图1)。经斯皮尔曼相关性系数评估与NONMAM软件的逐步协变量模型(SCM)筛选,加入群体模型中的协变量为年龄、身高、体表面积、总胆红素和肌酐清除率。该模型不仅能够预测不同剂量多柔比星对心血管毒性标志物BNP水平的影响,还可测试患者特异性特征对PD参数和对心脏毒性的影响,为确定与多柔比星急性毒性反应相关的临床因素的研究提供依据。
另一项关于曲妥单抗的研究建立了群体PK-PD模型描述曲妥单抗的暴露剂量与患者左心室射血分数(LVEF)下降之间的量效关系[24]。模型中的效应室采用Emax模型描述效应室药物浓度与LVEF下超过临界阈值(> 10或> 20 ms)的概率,相似的模型同样可以用于预测抗肿瘤药物对于QT的作用。
C-QTc模型作为评估新药QT延长风险的主要分析方法已被美国FDA和人用药品注册技术要求国际协调会议(ICH)所推荐和认可。ICH的指导文件中建议使用预先指定的线性混合效应模型作为初步分析,以排除10 ms的QT延长效应[15]。
研究认为,对于预先指定的模型,模型中的首选因变量是基线调整和Fridericia心率校正后的QT区间(ΔQTcF),固定效应参数为:截距、斜率、基线对截距的影响、治疗效应和首次给药后的时间[15]。该研究推荐模型公式如下:降之间的变化规律;个体间变异参数包括LVEF基线值、半数效应浓度(EC50)与恢复半衰期;EC50依据不同患者对药物心血管毒性的敏感性高低而定;该研究在模型能够个体化模拟不同生理病理状况患者接受曲妥珠单抗辅助治疗诱导的LVEF下降的基础上,后续加入了执行监控模型,模型定义AUC<45(当LVEF小于45%时的LVEF-时间曲线下面积)评估药物心血管毒性,从LVEF的下降程度和下降持续时长2个维度评价和优化心脏监测方案。这种加入了患者生理参数作为协变量的模型评估方法能够个体化地评估和优化曲妥珠单抗在不同临床环境中的心脏毒性监测方案,模型经后续优化后也可应用于使用LVEF进行心脏毒性安全的抗肿瘤药物。
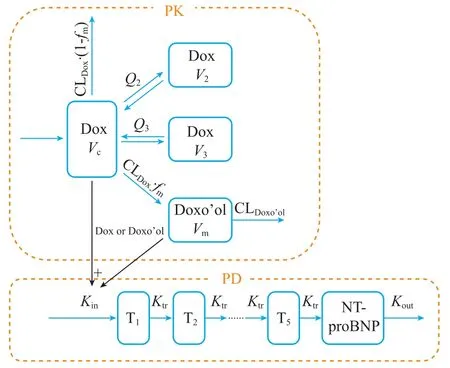
图1 多柔比星诱导NT-proBNP水平升高PK-PD模型结构示意图Figure 1 Schematic diagram of PK-PD model of increased NT-proBNP level induced by doxorubicin
由于肿瘤患者之间的个体差异较健康人群更大,可以利用群体模型弥补经验模型中难以预测的个体变异的不足。多柔比星[25-26]、舒尼替尼[27]等部分抗肿瘤药物的群体PK模型研究已被广泛探讨,在此基础之上,加入药物的PD模型与患者特异性特征作为协变量建立完整的PK-PD群体模型,可适用于不同生理、病理基础的患者,避免了传统PK-PD模型缺乏外推性的缺点。目前,这类模型建立主要依据乳腺癌患者的临床数据,缺乏其他类型的癌症患者的临床数据对模型进行优化,这使模型的应用具有一定局限性。
综上所述,基于经验的PK-PD模型通过描述药物浓度与心血管毒性相关指标之间的量效关系预测药物心血管毒性,其优势在于模型结构简单,所需的数据信息少。然而,该类模型建立仅依据统计学回归方法对实验所得数据进行拟合,缺乏对药物作用机制和生理系统的理解,面对抗肿瘤药物多样的心脏毒性机制和复杂的心血管系统,基于机制或者基于定量系统药理学(QSP)的PK-PD模型能够更好地描述药物的毒性机制及其与心血管系统间的相互作用。
2 基于机制的心血管毒性PK-PD模型
基于机制的PK-PD模型是一类从药物作用机制出发探讨药物效应的建模方法,模型内包含了描述药物暴露和药物反应之间因果过程的具体表达式,如药物靶向分布、药物靶向结合和激活受体、信号分子间的反馈调节,增加了模型的外推性和预测准确性。
抗肿瘤药物造成心血管功能障碍的发生具有多方面的原因,由于不同类型的抗肿瘤药物毒性机制不同,其所诱发的心血管风险因子也不同,主要从以下几个方面诱发心血管风险[28-29]:1)通过调节兴奋-收缩偶联,钙离子平衡或者线粒体功能等造成心肌细胞功能的直接损伤,从而导致心肌收缩能力减弱,造成心脏功能障碍;2)损伤血管,改变血液动力学,影响心脏负荷或造成心肌缺血;3)引起心律失常。
心电图(ECG)中的电生理参数QT、QRS波群(以下简称QRS)和PR间期(以下简称PR)可作为生物标志物来预测药物对心律失常的贡献。Bergenholm等[30]通过基于机制的外推转化模型定量研究抗心律失常药物AZD1305引起QRS和PR延长的体外细胞研究与临床研究间的转化;模型结合体外和临床的AZD1305数据,利用如下模型[见公式(3)]估算从离子通道水平的信号到临床QRS或PR延长之间的转化。
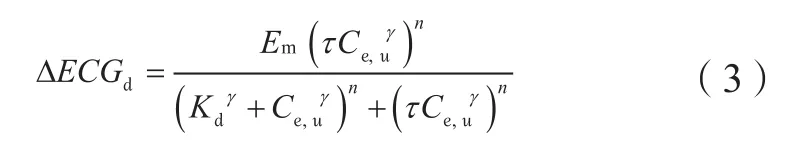
氧化还原[31-32]、线粒体DNA损伤[33]和电子传递链抑制[34]被认为是多柔比星心肌细胞毒性的潜在毒性机制。De Oliveira等[35]将三者与线粒体功能障碍相联系,建立了基于机制的多柔比星心肌细胞线粒体功能损伤的PK-PD模型,模型中包括线粒体DNA(mtDNA)、电子传递链(ETC)和活性氧(ROS)生成和清除系统并且描述了三者间的恶性循环(见图2):1)ROS水平的增加使ETC复合物失去活性并导致进一步的ROS生成增加;2)ROS水平升高导致mtDNA损伤,mtDNA编码的ETC蛋白下调,加重线粒体功能障碍和ROS的产生。模型中,Hill系数用于构造剂量依赖函数衡量每个ETC复合物的活性。mtDNA的损伤由细胞内mtDNA含量来衡量,模型假设在mtDNA损伤和修复处于平衡状态时,mtDNA的相对含量(与核基因对照品的比值)为0.75,计算其含量的微分方程如方程(4)所示。
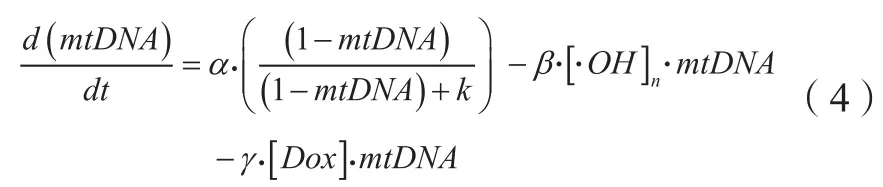
式中α是mtDNA修复的最大速率;κ为mtDNA修复半饱和系数;β和γ分别为ROS和多柔比星对mtDNA的损伤系数,为归一化后的羟基自由基浓度;为多柔比星浓度。
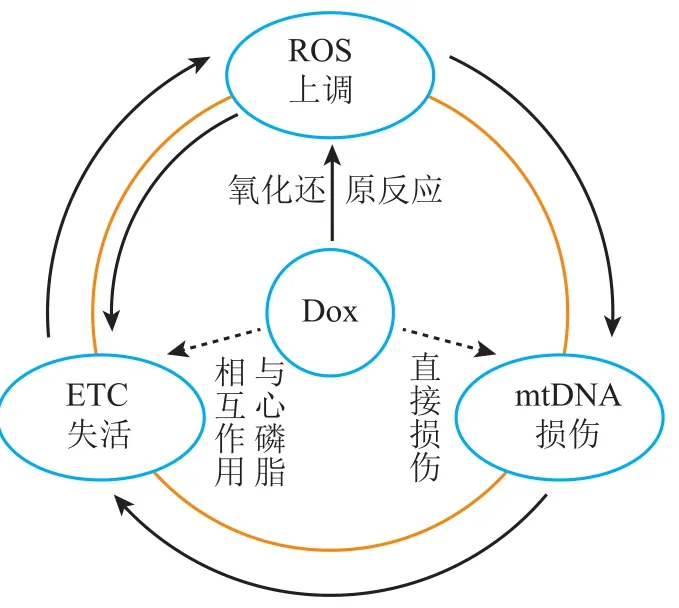
图 2 多柔比星导致心肌细胞线粒体功能障碍机制Figure 2 Mechanism of myocardial mitochondrial dysfunction induced by doxorubicin
该研究首次将这种模型用于药物心脏毒性的研究,量化了每种毒性机制在急性和慢性毒性阶段对线粒体功能障碍的影响,通过模拟可以确定这些机制单独或联合作用导致多柔比星心血管毒性的大小,为药物毒性机制和心脏保护替代方案提供了新的见解;另外,模型中对于心肌细胞线粒体DNA的损伤和修复的预测可以进一步应用于对心衰、心肌缺血等疾病发展的预测,为药物的毒性机制和心脏保护替代方案提供了新的见解[35]。目前,基于分子机制的模型已经被成功用于研究线粒体功能障碍[36]、ROS生成[37-38]和ROS清除[39-40]。
综上所述,由于抗肿瘤药物与复杂的心血管系统间的相互作用,肿瘤合并心血管疾病患者对于抗肿瘤药物的心血管毒性更为敏感,药物对其心血管系统的毒性作用有别于普通人群,因此抗肿瘤药物的心血管毒性需要给予更为精准的个体化预测。基于机制的PK-PD模型虽然充分描述了抗肿瘤药物的心血管毒性机制,但是这类模型将药物效应与生理作用混合在一起,缺乏毒性机制与机体整体调控网络或整个生理系统间相互作用的理解,仍然无法准确描述药物对自身心血管系统已经失衡的患者的影响。
3 基于定量系统药理学的心血管毒性PK-PD模型
虽然药物在临床前研发阶段就经历了严格的心脏毒性筛选,但在临床应用中仍存在意想不到的心脏不良反应。一种解释是,药物的心脏毒性可能在健康的心脏中“隐藏”,但在缺血再灌注损伤和存在心血管并发症的心脏中会显现出来,即潜在的心脏毒性[41]。潜在的心脏毒性作用可能是由于药物诱导的有害信号增强、心血管风险因素的存在以及心脏保护信号通路的抑制等造成,这些因素均可能导致缺血相关细胞死亡或心律失常等效应。QSP的提出为心血管毒性的个体化预测提供了一种新的思路和方法。QSP基于信号分子通路、调控网络、细胞、组织、器官及整个生理系统水平的变化,充分考虑疾病相关生理病理通路之间的相互作用,定量描述药物与通路间的相互作用(见图3)。利用QSP模型描述药物与机体的相互作用机制和预测药物代谢动力学和药效动力学的方法已被证明对理解和预测药物效应非常有价值[42-43]。
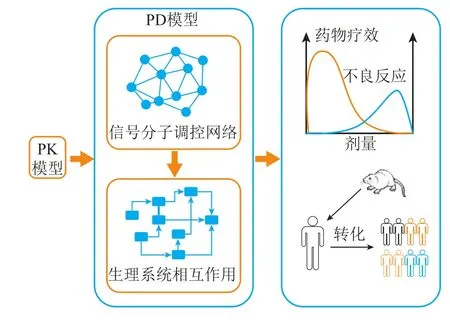
图 3 基于定量系统药理学的PK-PD模型结构示意图Figure 3 Schematic diagram of PK-PD model based on quantitative systems pharmacology
由于酪氨酸激酶信号的复杂性和酪氨酸激酶抑制剂(TKI)药物靶点范围的广泛性,TKI诱导的心血管毒性是一个非常适合应用QSP方法进行研究的问题。酪氨酸激酶信号通路是一个包含有大量反馈反应的大型网络并且药物改变酪氨酸激酶级联反应的过程极其复杂。Vaidya等[44]利用达沙替尼和索拉非尼引起人源心肌细胞AC16内凋亡与自噬相关信号蛋白水平改变的动力学数据建立了QSP模型,描述TKI药物的心肌细胞毒性反应,QSP模型中涉及的蛋白信号包括:磷酸化蛋白激酶B (pAkt)、磷酸化BAD蛋白(pBAD)、磷酸化Bcl-2(pBcl-2)、活化Caspase-9 和Caspase-3以及自噬途径中LC3II/LC3I的比例。达沙替尼可抑制Akt的激活,进而激活下游促凋亡Bcl-2家族的BAD蛋白,导致一系列促凋亡事件,包括抗凋亡蛋白Bcl-2的下调与Caspase-9和Caspase-3的活化;另一方面,细胞内诱导的应激可通过Akt/mTOR通路导致自噬上调,抑制细胞凋亡。模型中促死亡的凋亡途径与促生存的自噬途径的相互作用通过三房室转导模型转化为抑制细胞增殖的结果,并作为模型输出。索拉非尼的QSP模型在原有的信号网络中加入索拉非尼对磷酸化c-Jun氨基末端激酶(c-JNK)水平的调节,这可导致pBAD上调。研究中使用QSP建模方法从分子生物学水平上解释了TKI药物的毒性机制,定量分析凋亡和自噬通路的相互作用对心肌细胞毒性的贡献,可据此针对抗肿瘤药物心血管毒性的特定蛋白通路制定治疗策略。
Ryall等[45]依据心肌细胞生长所依赖的密集信号通路建立了更为复杂的心肌细胞肥大信号网络的QSP模型,由106个描述网络内相关的细胞信号动力学激活和失活的常微分方程组成,以确定其组成和网络拓扑结构如何调控转录因子、基因表达所导致的心肌细胞大小的差异。通过敏感性分析确定了心肌肥厚信号网络中最具影响力的因素,并展示了不同水平的信号通路网络如何影响心肌细胞的大小、转录因子和基因表达。基于上述研究,Shim等[46]将经TKI药物处理后的细胞内mRNA水平变化转化为QSP模型中相关信号参数的变化,从而模拟药物诱导的基因表达变化对基础信号活动和细胞反应的影响;此外,该模型可以改变其他信号活动的基础值,模拟在各种生理或药理刺激的条件下,TKI药物诱导的信号通路的改变如何影响7个心肌肥大生物标志物,即模型“输出”,汇总统计7个模型输出的变化,生成一个称之为“心肌肥大指数”的参数,以评估药物心脏毒性。
综上所述,QSP模型在阐明和预测其他药物毒性方面已取得了许多成果[47]。在药物临床前研究阶段,QSP模型已成功应用于药物性肝损伤[48-49]和药物性心律失常[50-51]等不良反应事件的研究。最近,美国FDA在临床药理评估中使用QSP模型来评估一种新的生物制剂的拟议剂量方案的适宜性,进一步增加了该模型的可信性与适用范围[52]。目前,抗肿瘤药物心血管毒性的QSP模型仍处于临床前研究阶段,但其在预测抗肿瘤药物心血管毒性方面有着巨大潜力。建立QSP模型的前提是掌握药物在心血管疾病发展过程所产生的一系列影响,包括药物在体内的吸收、分布、代谢、消除过程,与其毒性相关的分子反应机制,对体内心血管相关信号通路的影响以及心血管疾病自身疾病发展机制等[53]。在此基础上建立的QSP模型才能够清晰地描述药物与机体间的相互作用,模拟不同给药策略和不同治疗药物以及干预时间所引起的心血管毒性大小,从而指导临床合理用药。
4 结语
综上所述,基于经验的PK-PD模型能快速建立抗肿瘤药物心血管毒性的量效关系模型,通过加入临床相关变异因子作为协变量可扩大模型适用范围,能够解决较为简单的毒性评估问题,但缺乏对药物与机体相互作用的理解。基于机制的PK-PD模型与基于QSP的PK-PD模型能够依据药物作用机制和不同患者的生理病理情况,描述抗肿瘤药物与机体的相互作用,进行个体化的心血管毒性预测。当有关生物系统(即转运体、药物受体、稳态反馈机制、疾病进程)与药物作用机制的信息更为详细时,模型预测的准确性将进一步提高。通过PK-PD建模仿真的方法可以依据不同患者的基础生理病理水平、药物治疗史及遗传基因等方面对其心血管风险进行评级,结合抗肿瘤药物的毒性评估,筛选出更为合理、高效、低毒的抗肿瘤药物给药方案或相应的联合治疗方案,为降低肿瘤治疗过程中心血管并发症的发病率提供参考依据。

