响应面法优化日本黄姑鱼鱼肉免疫活性肽的提取工艺
胡旭阳,李 维,孔祥东,韩行标,唐云平,余方苗,杨最素,丁国芳
(浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江舟山 316022)
海洋活性肽因具有免疫调节、舒张血管、抗肿瘤、抗疲劳、抗氧化、抗炎及抗真菌等生理活性,成为目前海洋性功能成分的研究重点之一[1]。酶解法是提取制备海洋活性肽的一种常用方法,利用酶解法提取制备海洋活性肽已成为近年来的研究热点[2]。Tang等[3]用酶解法提取了日本黄姑鱼皮胶原蛋白,发现其有保湿活性,可用于化妆品行业。叶盛旺等[4]通过胃蛋白酶从青蛤中制备多肽,验证其在体外的免疫调节作用。Vo等[5]从螺旋藻中用酶解法提取并纯化了抗炎多肽。Wang等[6]从牡蛎中提取寡肽,作用于小鼠,发现有显著的免疫作用。Ahn等[7]以鲑鱼胸鳍副产物为原料,用胃蛋白酶酶解制备了抗炎多肽。Hou等[8]从鳕鱼骨架中用胰蛋白酶提取了具有免疫活性的多肽。
日本黄姑鱼(Nibeajaponica),俗称黑毛鲿,隶属鲈形目、石首鱼科、黄姑鱼属,主要分布于中国东海及日本南部海[9]。日本黄姑鱼味道鲜美,营养丰富,其鳔是名贵的中药补品[10-11],鱼皮中含有较高的胶原蛋白[12]。其鱼肉蛋白质含量较高,易被人体消化吸收,但作为蛋白来源用于提取制备免疫活性肽的研究鲜为报道。
本论文利用5种商业化蛋白酶对日本黄姑鱼肉进行酶解,以日本黄姑鱼肉多肽对小鼠巨噬细胞RAW 264.7的相对增殖率为指标,筛选出最佳酶种,再经单因素实验和响应面试验确定该酶的最佳酶解条件,以期为日本黄姑鱼肉免疫活性肽的制备及进一步研究其免疫调节作用提供依据。
1 材料与方法
1.1 材料与仪器
日本黄姑鱼 浙江省海洋水产研究所提供;小鼠单核巨噬细胞RAW 264.7 中科院上海细胞所,由本实验室传代培养;胰蛋白酶、碱性蛋白酶、胃蛋白酶、木瓜蛋白酶和中性蛋白酶 北京亚太恒信生物科技有限公司;DMEM培养基 Gibco公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲亚砜(DMSO) Sigma公司;其余试剂 均为国产分析纯。
JJ-2组织搅碎机 上海比朗仪器有限公司;DK-S24水浴锅 上海森信实验仪器有限公司;CKX41倒置显微镜 日本OLYMPUS公司;CF16RXⅡ型高速低温离心机 日本日立公司;ZHJH-C1209C型超净工作台 上海智诚分析仪器制造公司;Forma3111 CO2培养箱 美国Thermo公司;WRO-70型超纯水仪 美国Millipore公司;酶标仪 美国Bio-Rad公司;BSA124S型电子天平 德国SatoriusAG公司;ALPHA 1-4/LDplus型冷冻干燥机 德国CHRIST公司。
1.2 实验方法
1.2.1 日本黄姑鱼肉多肽工艺 日本黄姑鱼肉经过预处理后,按一定的料液比加入纯水,调节pH和酶解温度,加入一定量的蛋白酶进行酶解。酶解完成后,灭酶活,待酶解液冷却至室温,调节酶解液的pH至中性。将酶解液离心取上清,冷冻干燥,冻干粉末即为日本黄姑鱼肉多肽。
1.2.2 日本黄姑鱼肉预处理 参考丁浩宸等[13]脱脂方法,取一定量的日本黄姑鱼,去除鱼皮、鱼鳍和内脏等器官,清洗干净。用绞碎机绞碎。绞碎的日本黄姑鱼肉用95%乙醇,在料液比为1∶6 (m/v)、脱脂温度为50 ℃的条件下,脱脂2次,每次1 h。将脱脂后的日本黄姑鱼肉在4 ℃、12000 r/min预冷的离心机离心15 min,收集沉淀。用纯水将沉淀洗至无乙醇味,冻干后放入-20 ℃冷冻备用。
1.2.3 最佳酶种的筛选 称量5份10.0 g预处理过的日本黄姑鱼肉,酶解方法参考文献[14-16]进行实验,以料液比1∶10 (g/mL)加入纯水,每种蛋白酶的酶添加量为1500 U/g,混匀后分别在每种蛋白酶推荐的最适宜温度和pH条件下(木瓜蛋白酶酶解条件为60 ℃、pH6.0;胰蛋白酶酶解条件为37 ℃、pH8.0;中性蛋白酶酶解条件为45 ℃、pH7.0;碱性蛋白酶酶解条件为45 ℃、pH10.0;胃蛋白酶酶解条件为37 ℃、pH2.0),酶解6 h,酶解完成后在沸水中灭酶活10 min,冷却至室温12000 r/min离心15 min,取上清液冷冻干燥。将冻干的酶解产物配成浓度为100 μg/mL溶液,采用MTT法检测5组酶解产物对RAW 264.7细胞增殖的影响,并计算相对增殖率,筛选出最佳酶解的蛋白酶。
1.2.4 单因素实验 在1.2.3筛选出最适蛋白酶的情况下,研究影响酶添加量、料液比、酶解温度、pH和酶解时间对日本黄姑鱼肉酶解的影响。酶解的基本条件为加酶量1500 U/g、料液比1∶10 (g/mL)、温度60 ℃、pH6.0、时间6 h。改变其中的1个条件,分别考察蛋白酶的添加量(500、1000、1500、2000、2500 U/g),料液比(1∶6、1∶8、1∶10、1∶12、1∶14 g/mL),酶解温度(50、55、60、65、70 ℃),pH(4.0、5.0、6.0、7.0、8.0)和酶解时间(2、4、6、8、10 h)对酶解效果的影响,MTT法检测相对增殖率。
1.2.5 响应面试验设计 在单因素实验结果的基础下,以酶解温度、酶解时间、料液比和pH为工艺参数,设计四因素三水平Box-Behnken响应面试验,以日本黄姑鱼肉多肽对RAW 264.7细胞的相对增殖率为指标,设计5个中心点和29个不同组合的试验,试验因素水平如表1所示。
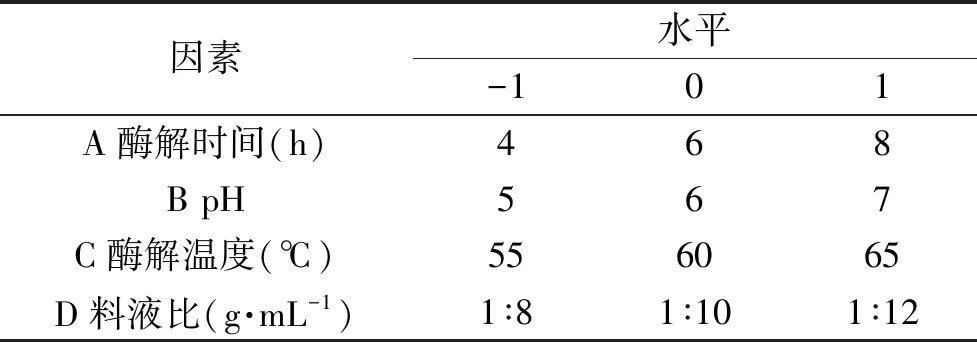
表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiment
1.2.6 日本黄姑鱼肉多肽对RAW 264.7细胞的相对增殖率的测定 参考叶盛旺等[4]方法,称取一定量的日本黄姑鱼肉多肽,用细胞培养液配成100 μg/mL的浓度。采用MTT法检测其对RAW264.7细胞增殖的影响。按式(1)计算相对增殖率。
相对增殖率(%)=(实验组OD值-空白对照组OD值)/空白对照组OD值×100
式(1)
1.3 数据分析
采用Design Expert 8.05b对响应面试验结果进行分析。
2 结果与分析
2.1 蛋白酶的筛选
5种蛋白酶酶解产物对RAW 264.7细胞的相对增殖率情况如图1所示。由图1可知,木瓜蛋白酶酶解产物对RAW 264.7细胞的相对增殖率最高为53.60%,其后依次为中性蛋白酶、碱性蛋白酶和胃蛋白酶,胰蛋白酶酶解产物对RAW 264.7细胞的相对增殖率最低。故选择木瓜蛋白酶为本实验最优提取酶。
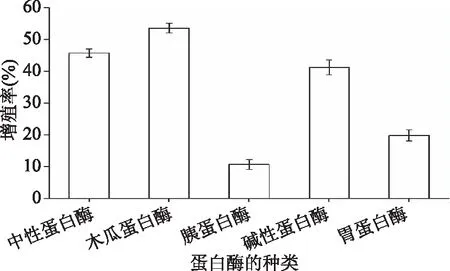
图1 不同蛋白酶对RAW 264.7细胞相对增殖率的影响Fig.1 Effect of different proteases on relative proliferation rate of macrophage RAW 264.7
2.2 单因素实验
2.2.1 加酶量对RAW 264.7细胞相对增殖率的影响 图2所示为加酶量对RAW 264.7细胞相对增殖率的影响。酶添加量由500 U/g增加到2000 U/g时,日本黄姑鱼肉多肽对RAW 264.7细胞的相对增殖率持续升高,这是因为酶添加量增加,底物反应越彻底,在酶添加量达到2000 U/g时,对RAW 264.7细胞相对增殖率最高。当酶添加量继续增加时,底物已经充分酶解,日本黄姑鱼肉多肽对RAW 264.7细胞相对增殖率不再随着酶添加量的增多而升高,反而有略微下降的趋势,这可能是生成的多肽被再次酶解导致的。因而最适酶添加量为2000 U/g。
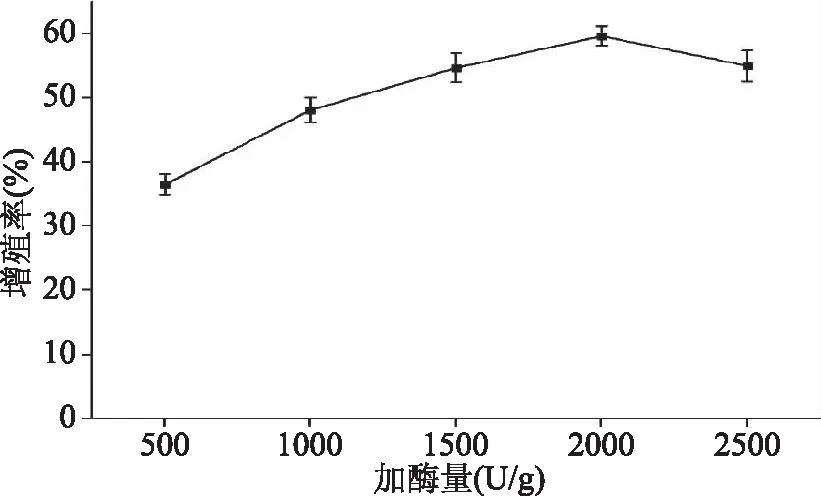
图2 酶添加量对RAW 264.7细胞相对增殖率的影响Fig.2 Effect of enzyme dosage on relative proliferation rate of macrophage RAW 264.7
2.2.2 料液比对RAW 264.7细胞相对增殖率的影响 图3所示为料液比对RAW 264.7细胞相对增殖率的影响。当料液比为1∶10 (g/mL)时,日本黄姑鱼肉多肽对RAW 264.7细胞相对增殖率达到最大。料液比在1∶6~1∶14范围内时,随着料液比的增加,日本黄姑鱼肉多肽对RAW 264.7细胞相对增殖率先升高后降低。这是由于在一定的范围内,增加酶解体系中的料液比,酶与底物接触逐渐充分,酶解程度不断增大。但是随着料液比越来越大,底物被过多稀释,这反而增大了酶与底物的接触难度,导致体系酶解不完全,蛋白质难以被分解成具有免疫活性的肽[17]。因此,最佳料液比为1∶10 (g/mL)。
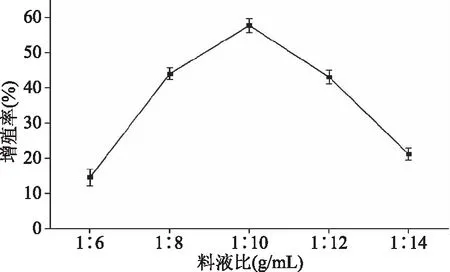
图3 料液比对RAW 264.7细胞相对增殖率的影响Fig.3 Effect of ratios of water to material on relative proliferation rate of macrophage RAW 264.7
2.2.3 酶解温度对RAW 264.7细胞相对增殖率的影响 图4所示为酶解温度对RAW 264.7细胞相对增殖率的影响。温度由50 ℃升高至60 ℃时,酶解效果越来越好,日本黄姑鱼肉酶解多肽对RAW 264.7细胞相对增殖率越来越高。当酶解温度在60~70 ℃时,相对增殖率开始下降。这是因为在一定的温度范围内,随着温度的升高,酶活力开始增大,酶与底物结合程度开始提高,有利于提取免疫活性肽;但温度过高会导致蛋白质变性,不仅降低了酶活力,而且会引起蛋白质的聚集和沉淀作用,使其溶解度下降,不利于提取免疫活性肽[18]。因此,最佳酶解温度为60 ℃。
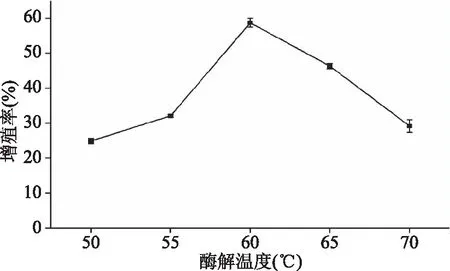
图4 酶解温度对RAW 264.7细胞相对增殖率的影响Fig.4 Effect of enzymatic temperature on relative proliferation rate of macrophage RAW 264.7
2.2.4 pH对RAW 264.7细胞相对增殖率的影响 图5所示为pH对RAW 264.7细胞相对增殖率的影响。当pH为6.0时,日本黄姑鱼肉多肽对RAW 264.7细胞相对增殖率最高,达到58.44%。在pH4.0~8.0的范围内,随着pH的升高,日本黄姑鱼肉多肽对RAW 264.7细胞相对增殖率先逐渐升高后逐渐降低。pH能影响酶活性部位的解离和底物蛋白的解离,从而直接影响了酶与底物蛋白的结合与催化,每个催化反应都有一个最适的pH[19]。因此,最佳pH为6.0。在细胞培养过程中,培养液的pH对细胞活力有一定的影响[14],因此,为考虑酶解液中pH对细胞活力产生的影响,将灭酶活后的酶解液调至中性再进行后期实验,以防pH对细胞的活力有影响,进而影响各酶解条件的筛选。
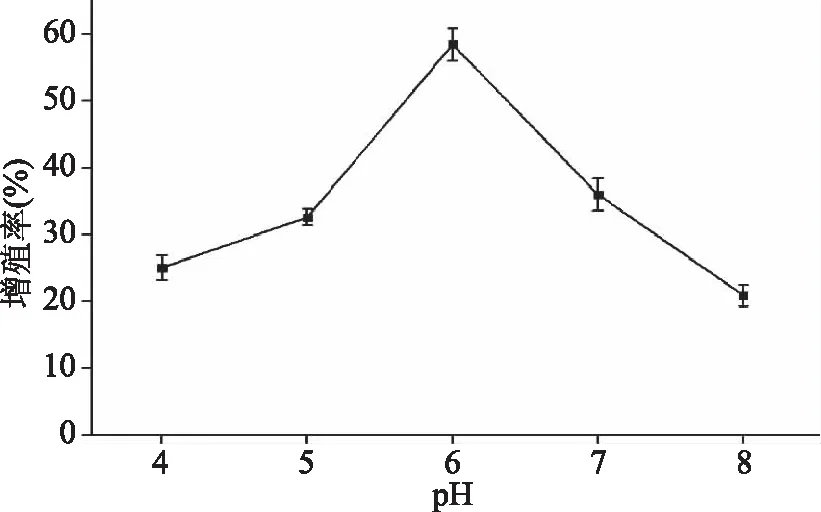
图5 pH对RAW 264.7细胞相对增殖率的影响Fig.5 Effect of pH on relative proliferation rate of macrophage RAW 264.7
2.2.5 酶解时间对RAW 264.7细胞相对增殖率的影响 图6所示为酶解时间对RAW 264.7细胞相对增殖率的影响。当时间在2~6 h时,酶解产物对RAW 264.7细胞相对增殖率越来越高,当酶解时间达到6 h时,相对增殖率达到最高。当时间在6~10 h时,酶解产物对RAW 264.7细胞相对增殖率开始降低。这可能是因为酶解时间延长,酶解反应中一些具有高免疫活性的肽链被再次酶解,导致相对增殖率降低[20]。故选择酶解时间为6 h左右。
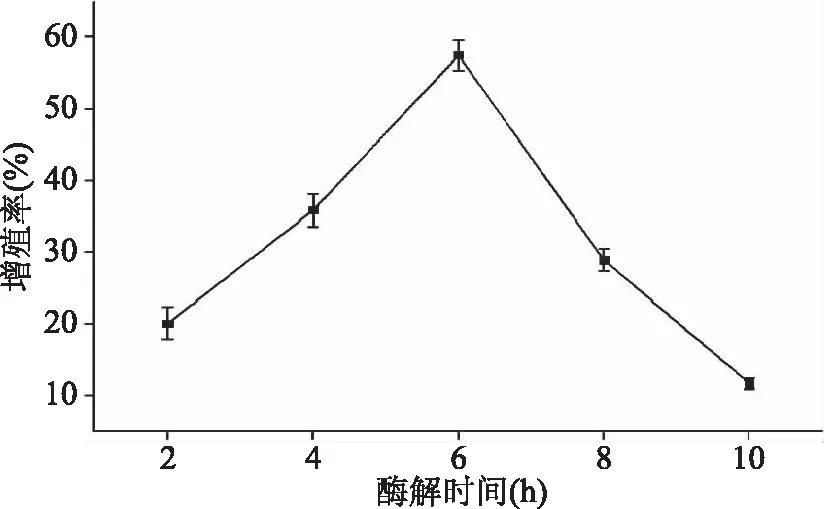
图6 酶解时间对RAW 264.7细胞相对增殖率的影响Fig.6 Effect of enzymatic time on relative proliferation rate of macrophage RAW 264.7
2.3 响应面试验
2.3.1 模型建立与显著性检验 在单因素实验结果的基础上,选取料液比、pH、酶解温度、酶解时间进行4因素3水平的响应面优化试验,以日本黄姑鱼肉多肽对小鼠巨噬细胞RAW 264.7的相对增殖率为响应值,分析日本黄姑鱼肉酶解的最优工艺指标。响应面试验的设计与结果见表2。
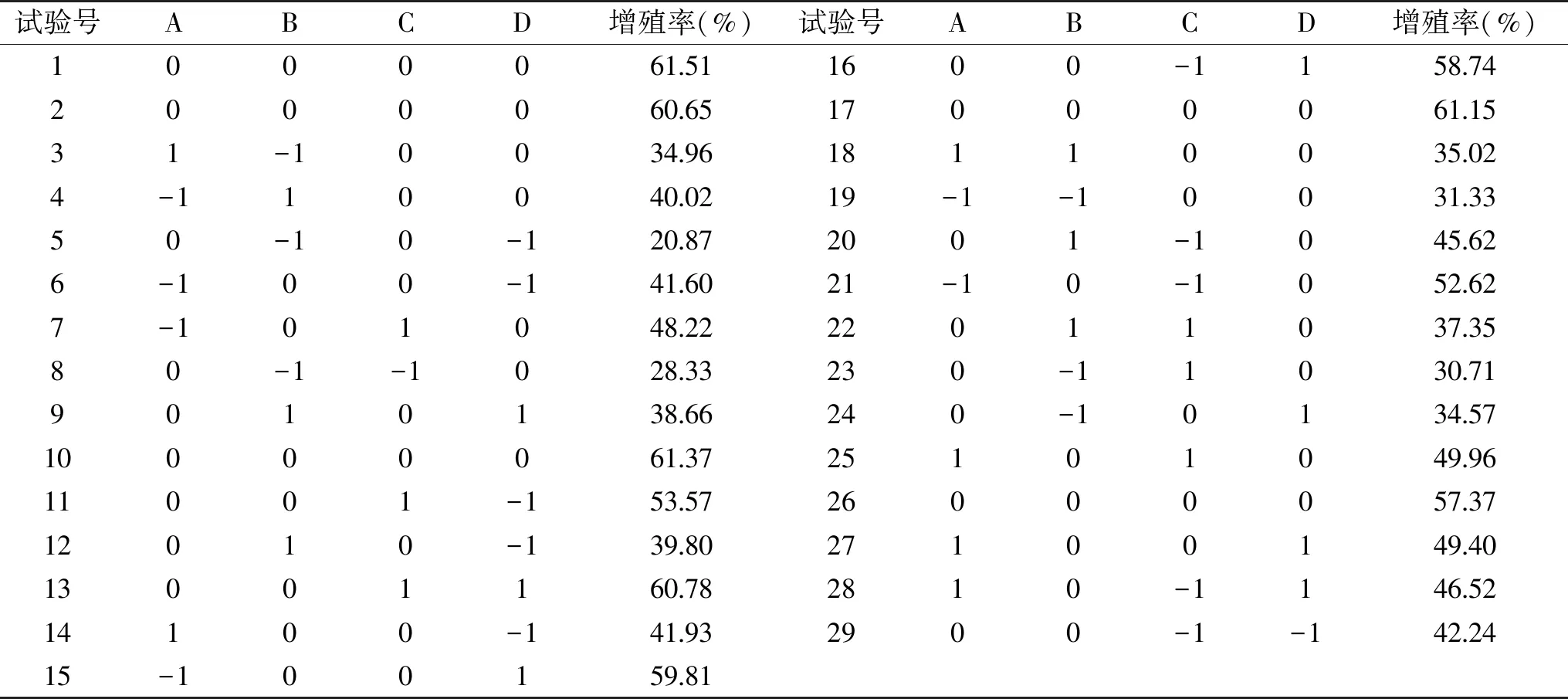
表2 Box-Behnken试验设计与结果Table 2 Design and results for the Box-Behnken experiment
各因素经过回归拟合后,得到料液比、pH、酶解温度、酶解时间的二次多项回归方程为:
相对增殖率=60.42-1.29A+4.64B+0.52C+5.16D-2.16AB+1.88AC-2.70AD-2.66BC-3.71BD-2.31CD-6.37A2-20.68B2-3.46C2-5.09D2。
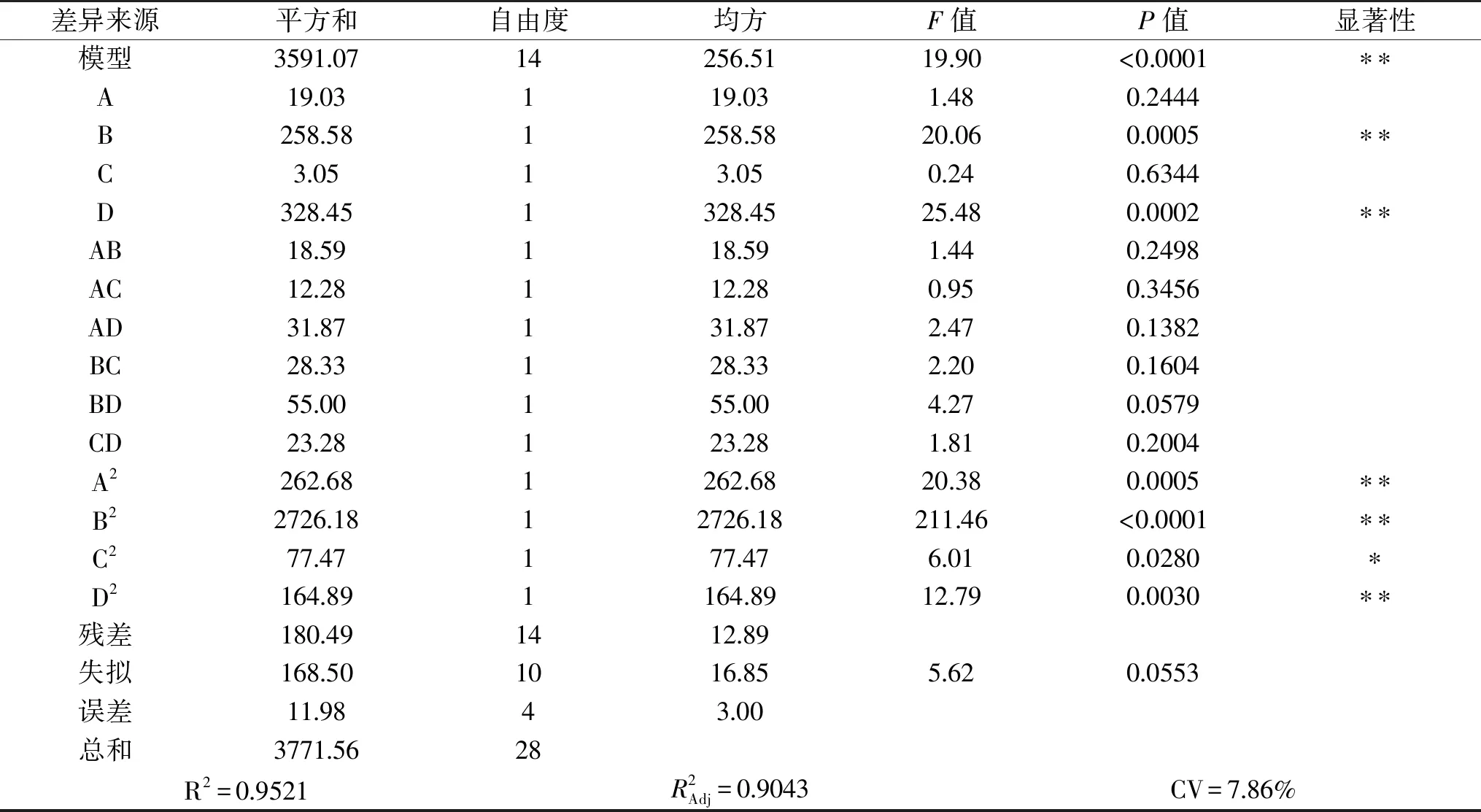
表3 回归模型及方差分析Table 3 Variance analysis for regression equation
2.3.2 响应面交互作用分析 响应面图是回归方程的形象描述,响应面曲面可较直观地反映各因素及两两因素的交互作用对响应值的影响[21-23]。响应面图曲面坡度陡峭、等高线密集成椭圆形表明两因素交互影响大,而坡度平缓、等高线呈圆形则表明两因素之间交互影响小[24-25]。各因素交互作用对小鼠巨噬细胞RAW 264.7相对增殖率的影响如图7所示。由图7可以直观地看出,各试验因素的交互作用不显著,与方差分析结果一致。
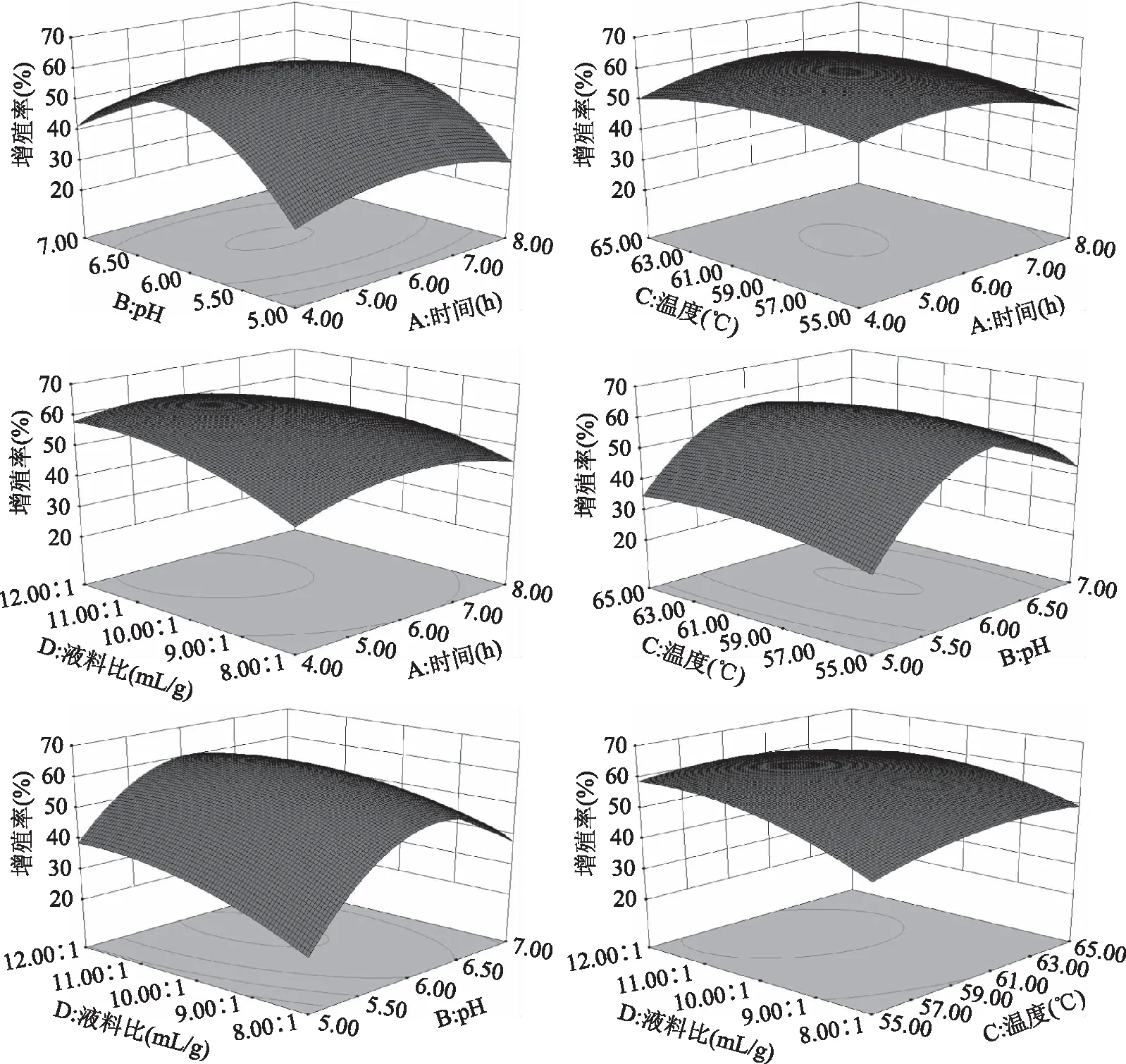
图7 各因素之间交互作用的响应曲面图Fig.7 Response surface diagrams for interaction of various factors
2.4 验证实验
经Design Expert 8.05b软件分析得到的最佳酶解条件为料液比1∶11.2 (g/mL)、pH6.1、酶解时间5.4 h、酶解温度58.8 ℃。在此条件下,日本黄姑鱼肉多肽对小鼠巨噬RAW 264.7细胞增殖率的预测值为62.3%。为了验证响应面法的可行性,采用得到的最佳提取条件进行日本黄姑鱼肉多肽对小鼠巨噬细胞RAW 264.7的增殖率的验证实验,同时考虑到实际操作等因素,修正工艺参数为:酶解时间5.4 h、料液比1∶11 g/mL、酶解温度59 ℃、pH为6,进行3次平行实验得到的增殖率为61.8%±0.5%,与预测值62.3%无显著性差异。因此,通过响应面法优化提取日本黄姑鱼肉多肽的酶解条件是可行的,得到的日本黄姑鱼肉多肽提取条件的回归模型较可靠。
3 结论与讨论
根据实验分析,确定提取日本黄姑鱼肉多肽所用的蛋白酶为木瓜蛋白酶。通过Box-Behnken响应面试验设计得到了日本黄姑鱼肉多肽提取的最优工艺参数为料液比1∶11 (g/mL)、pH为6、酶解时间5.4 h、酶解温度59 ℃。通过验证实验所得得到的增殖率为61.8%±0.5%,与模型预测值接近,证明应用响应面法优化提取日本黄姑鱼肉多肽是准确可行的,为日本黄姑鱼鱼肉提取免疫活性肽奠定基础,为进一步研究其免疫调节作用机制提供参考。
本研究探讨了日本黄姑鱼肉免疫多肽的制备工艺,其实质就是酶反应条件对产物活性成分的影响。只有调节合适的pH、酶解温度和酶解时间,用适当的蛋白酶进行酶解,才可以产生有生理活性的免疫活性肽[26]。经大量免疫活性肽研究中发现免疫活性肽通常具有疏水性氨基酸,其活性与母体蛋白的氨基酸组成、亚基序列、空间结构有关[27]。因此,调节酶反应条件达到最佳的酶解效果,提取的日本黄姑鱼肉多肽才能具有最强的免疫活性。

