鲜天麻采后生理品质变化规律及病原菌鉴定的研究
曹 森,雷霁卿,吉 宁,潘 成,马 超,李 莹,赵 宇,王 瑞 *
(1.贵阳学院食品与制药工程学院,贵州贵阳 550005; 2.贵州省果品加工工程技术研究中心,贵州贵阳 550005; 3.贵州乌蒙腾菌业有限公司,贵州毕节 551600)
天麻(GastrodiaelataBl.)又称赤箭、定风草、独播芝等,为兰科多年生异养寄生植物,属于我国名贵中药材,具有镇静、镇痛、安眠、降血压、增智等功效[1-3]。天麻的化学成分主要有多糖、酚类及其苷类等,其中酚类及其苷类是天麻的主要活性成分,如天麻素和对羟基苯甲醇等[4]。20世纪70年代天麻由野生变仿野生栽培后,栽培天麻成为主要商品来源,其种植主产地主要分布在云南、四川、贵州、湖北等地。另外,根据天麻茎杆颜色又可分为红天麻、乌天麻和乌红天麻等不同变型[5],其中乌天麻由于折干率高、商品性状好、品质优良等特点被誉为国产天麻中的“极品”[6]。贵州是中国天麻的三大产区之一。其中毕节市是贵州天麻的主产区,种植面积达到4万多亩,大方则是毕节地区天麻主要产地,种植面积达到2万余亩,年产量200多万公斤。大方天麻以天麻素和天麻多糖的含量高、微量元素丰富而受消费者的欢迎,其中天麻素含量是药典标准的2~9.5倍。目前,天麻主要作为药材使用,以炮制销售为主[7-8]。
2018年1月11日,国家卫计委发布了《国家卫生计生委食品司关于就党参等9种物质作为按照传统既是食品又是中药材物质开展试生产征求意见的函》,同意将天麻列入食药物质目录,随着天麻列入食药物质目录,天麻作为食品的销售和食用方式将越来越多,由于鲜天麻具有口感好、营养成分高、多种保健功能等优点,鲜食天麻也将越来越受欢迎。天麻也逐渐从传统的单一炮制方式销售模式,转变为炮制品与生鲜天麻模式共同销售。但鲜品销售存在系列问题:天麻采收期集中且短,采收期当地天气又是多雨季节,鲜天麻易腐烂,不耐贮藏,并且由于当地消费量有限,不能长时间贮藏;外销又没有好的贮运保鲜技术,在长途运输中容易腐烂、发霉变质。目前,关于鲜天麻采挖后的报道较少,黄万兵等[9]研究了鲜天麻保存中相关生理特性的研究,仅从天麻的生理和酶活性方面报道了相关变化。因此,系统地研究鲜天麻采后生理品质变化规律及病原菌鉴定,是天麻采后产业健康可持续发展面临的重要问题。
本研究通过测定天麻在休眠期采收后,离开蜜环菌在贮藏期(25±0.5) ℃和(1±0.5) ℃的各种生理品质的变化规律,并探索贮藏期间引起天麻腐烂的主要致病菌,旨在为鲜天麻的留种保存及采后保鲜方法提供理论基础。
1 材料和方法
1.1 材料与仪器
乌天麻 采自贵州乌蒙腾菌业有限公司基地;Ezup柱式真菌基因组DNA 抽提试剂盒SK8259-50 次、DNA Marker DL2000和引物ITS1/ITS4 均购于生工生物工程(上海)股份有限公司;腺苷对照品(批号20160523)、天麻素对照品(批号20161217)、对羟基苯甲醇对照品(批号20160317)和对羟基苯甲醛对照品(批号20160415) 均购于上海金穗生物科技有限公司,纯度均>98.0%;乙腈和甲醇为色谱纯 美国Tedia公司;PE20(20 μm)保鲜膜和精准控温保鲜库(±0.5 ℃) 均来自于国家农产品保鲜工程技术研究中心(天津)。
TA.XT.Plus质构仪 英国SMS公司;UV-2550型紫外分光光度计 日本Shimazhu公司;pHS-25型数显酸度计 上海虹益仪器仪表有限公司;PAL-1型迷你数显折射计 日本ATAGO;Check PiontⅡ便携式残氧仪 丹麦Dansensor公司;CR400-色差仪 日本柯尼卡美能达;DH5000BII电热恒温培养箱 天津市泰斯特仪器有限公司;Microfug®20R centrifuge高速冷冻离心机 美国贝克曼库尔特有限公司;T100TMThermal Cycler PCR仪 美国伯乐有限公司;LC-15C型高效液相色谱仪和AUW120D型电子分析天平 均来自于日本岛津公司;ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm)色谱柱 安捷伦科技(中国)有限公司;KQ-5200DB型超声波清洗器 昆山市超声仪器有限公司;RC-4型精创温度记录仪 江苏省精创电气股份有限公司。
1.2 实验方法
1.2.1 处理方法 2017年12月25日在贵州省毕节市大方县乌蒙腾菌业有限公司基地对乌天麻进行采挖,将采挖好的乌天麻立即运回贵州省果品加工工程技术研究中心果蔬贮藏与保鲜研究室。选择大小基本一致、无病虫害、无机械损伤的天麻,将选好的天麻经20 μm的PE保鲜膜分装(2.5 kg/袋),每组设3个重复,其中10组摆放于保鲜库内(1±0.5) ℃、另外10组摆放于实验室恒温培养箱内(25±0.5) ℃,每3 d分别对天麻的生理品质及酶活性进行测定,测定周期为30 d,并在贮藏30 d时对腐烂天麻进行病原菌的分离纯化与鉴定。
1.2.2 采后指标测定方法
1.2.2.1 冰点 随机挑选刚挖的天麻,取不同大小、无机械损伤的10个天麻,称取单果质量后,将精创温度记录仪探头从横径最大处插到天麻中央,之后将连有温度探头的天麻置于低温冰箱(-18 ℃)冻结,果心温度每1 min自动记录1次。待温度恒定,将数据传入计算机,制作冻结曲线,确定天麻的冰点。
1.2.2.2 腐烂率 以表面变黑或长霉记作腐烂天麻,采用计数法测定天麻的腐烂率,计算公式如下:
腐烂率(%)=腐烂个数天麻/天麻总个数×100
1.2.2.3 硬度 天麻硬度采用英国TA.XT.Plus物性测定仪测定,利用P/2柱头(Φ2 mm)对其进行穿刺测试,测试参数:穿刺深度为10 mm,测前速度为2 mm/s,测试速度为1 mm/s,测后速度为2 mm/s。
1.2.2.4 含水量 将天麻切成厚度为1 cm的薄片,称取质量为(5±0.2) g左右的天麻片,在恒温干燥箱中烘12 h,温度为65 ℃,冷却后称量。计算公式如下:含水量(%)=(烘前试样质量-烘后试样质量)/烘前试样质量×100。
1.2.2.5 呼吸强度 呼吸强度的测定均参照张鹏等[10]报道的方法进行测定。
1.2.2.6 色差 采用色差仪进行测定。L*值越大则天麻越亮,L*值越小则天麻越暗(每处理组随机取12个天麻对天麻外表正中部位进行测定,记作为色差外;然后将天麻沿正中部位横切,测量横断面的色差,记为色差内)。
1.2.2.7 可溶性固形物 随机取10个天麻,将天麻切成细小颗粒后混匀,使用PAL-1迷你数显折射仪进行测定,共测定10次。
1.2.2.8 蛋白质 蛋白质含量测定采用考马斯亮蓝法[11]测定天麻中的蛋白质。
1.2.2.9 多糖 多糖含量测定采用苯酚-硫酸法[12]来测定天麻中的多糖。
1.2.2.10 天麻素、腺苷、对羟基苯甲醛和对羟基苯甲醇 参照闫宝庆等[13]研究的方法,采用HPLC方法同时测定天麻中天麻素、腺苷、对羟基苯甲醛和对羟基苯甲醇的含量,有改动。采用ZORBAX Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈-0.05%磷酸,梯度洗脱;体积流量1.0 mL/min;检测波长270 nm。
1.2.2.11 超氧化物歧化酶(SOD)活性测定 SOD活性测定参考曹建康等[14]果蔬采后生理生化实验指导书的方法进行测定(规定0.01 A/min=1U)。
1.2.2.12 多酚氧化酶(PPO)和过氧化物酶(POD)活性测定 POD活性测定采用愈创木酚法,PPO活测定采用邻苯二酚法,均参照张群等[15]测定方法。
1.2.2.13 过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性测定 参照张亚伟等[16]测定方法对天麻过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性进行测定。
1.2.2.14 天麻致病菌的鉴定 天麻致病菌的鉴定方法参照郜海燕等[17]测定方法,有改动,具体如下:
病原菌的分离纯化:腐烂天麻依次用无菌水清洗、0.1%升汞表面消毒3 min、75%乙醇擦拭消毒后,无菌滤纸上吸干水份,置于超净工作台吹干待用。用无菌剪刀剪去腐烂天麻病斑表皮,于病健交界部位取少量天麻组织接种于PDA平板上,置于25 ℃恒温培养箱中培养。2 d后,用接种针挑取菌落边缘的菌丝接种于新的PDA 培养基上,纯化3~4次后使用。
rDNA-ITS 序列扩增:按照上海生工Ezup柱式真菌基因组DNA抽提试剂盒(CAS B518259)进行病原菌基因组DNA提取,以基因组DNA为模板,使用rDNA-ITS序列通用引物ITS1(5′-TCCGTAGG TGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATT GATATGC-3′)进行PCR扩增。20 μL反应体系:2×Taq Master Mix 10 μL、DNA模板1 μL、ITS1和ITS4引物各1 μL,ddH2O补足至20 μL。反应程序为:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃终延伸10 min。
序列分析:PCR产物送生工生物工程(上海)股份有限公司进行测序。测序结果利用NCBI(National Center for Biotechnology Information 美国国家生物技术信息中心)的多序列比对工具BLAST(Basic Local Alignment Search Tool 碱基局部对准检索工具)在序列数据库GenBank中作同源性相似差异性分析,下载同源性较高的序列,使用最大似然法(MI)分析亲缘关系。MI分析采用MEGA7进行,bootstrap重复值1500、选用Kimura 2-parameter model、得到系统发育树后使用iTOL v4在线软件进行整理,最后将病原菌的亲缘分析结果对其进行鉴定。
1.2.2.15 天麻生理品质相关性分析和主成分分析 通过SPSS19.0软件将天麻17个生理品质(硬度、呼吸强度、含水量、色差外、色差内、可溶性固形物、蛋白质、多糖、天麻素、腺苷、对羟基苯甲醇、对羟基苯甲醛、SOD、PPO、POD、CAT、APX)的相关指标进行相关性分析和主成分分析。
1.3 数据处理与分析
采用Origin Pro 2017软件对数据进行统计处理,采用SPSS 19.0软件的Duncan氏新复极差法进行数据差异显著性分析,及用相关性分析和主成分分析法分析各样品生理品质的变化(P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著)。
2 结果与分析
2.1 天麻的冰点
研究表明,农产品在冰点以下贮藏易导致冷害,严重甚至导致冻害[18]。图1表明,放入低温环境后的天麻温度持续降低至-0.3 ℃出现拐点,并且在此温度下持续4 min,这主要是由于在相变的时候会释放热量[17],因此,推断天麻的冰点为-0.3 ℃,考虑到冰箱温度波动及冷库温度波动等原因,为了避免冷害,建议天麻冷藏温度为0~1 ℃。

图1 天麻的冻结曲线Fig.1 The freezing curve of Gastrodia elata
2.2 鲜天麻贮藏期生理品质的变化
2.2.1 腐烂率 腐烂率是农产品贮藏期重要的变化指标之一,它直接影响农产品的价值。图2表明,在0~3 d时,25和1 ℃贮藏的天麻均没有出现腐烂,从3 d开始,25 ℃贮藏的天麻出现腐烂,而1 ℃贮藏的天麻从9 d开始出现腐烂。25 ℃贮藏21 d时,天麻的腐烂率为19.76%,并且天麻腐烂率开始快速上升,而1 ℃贮藏的天麻腐烂率从21 d开始逐渐缓慢上升。在30 d时,25 ℃贮藏天麻的腐烂率高达45.38%,而1 ℃贮藏的天麻腐烂率仅为14.48%,并且从贮藏18 d开始至贮藏30 d,1 ℃贮藏的天麻腐烂率均显著低于25 ℃的贮藏天麻(P<0.05)。说明1 ℃贮藏能够降低天麻的腐烂率。

图2 鲜天麻贮藏期腐烂率的变化Fig.2 Changes of the rot ratio of Gastrodia elata during storage
2.2.2 硬度 硬度值的变化能直接反映出农产品的软化程度,进而衡量农产品的新鲜程度。图3表明采挖时新鲜天麻的硬度为1468.22 g,在贮藏期前9 d时,25 ℃和1 ℃贮藏的天麻硬度没有显著性差异(P>0.05),从贮藏12 d开始,25 ℃贮藏的天麻硬度显著低于1 ℃贮藏的天麻(P<0.05)。在整个贮藏期,1 ℃贮藏天麻硬度的变化没有显著性差异(P>0.05),硬度值在1468.22~1306.82 g范围内波动,没有显著性变化(P>0.05)。25 ℃贮藏的天麻从12 d开始快速下降,贮藏30 d时,25 ℃贮藏的天麻硬度仅为1113.32 g。说明天麻从贮藏期12 d开始,1 ℃贮藏天麻可延缓其硬度的降低,而25 ℃贮藏的天麻从12 d开始快速下降,在贮藏30 d时极显著(P<0.01)低于采挖时天麻硬度值。

图3 鲜天麻贮藏期硬度的变化Fig.3 Changes of the firmness of Gastrodia elata during storage
2.2.3 含水量 含水量可以判断农产品的新鲜度。图4表明,刚采挖的天麻含水量为81.91%,在前6 d,不同温度下的天麻含水量没有显著性差异(P>0.05),从贮藏9 d开始,25 ℃贮藏的天麻含水量开始快速下降,而1 ℃贮藏的天麻含水量下降缓慢,在贮藏30 d时,1 ℃贮藏的天麻含水量71.88%,而25 ℃贮藏的天麻含水量仅为61.69%。说明天麻的含水量随着贮藏期间的延长开始呈现下降的趋势,并且1 ℃有利于减缓天麻含水量的下降,主要因为低温降低了天麻的呼吸强度,从而减缓了水分的流失,这与郭园园等[19]研究不同贮藏温度对青皮核桃保鲜的影响结果一致。

图4 鲜天麻贮藏期含水量的变化Fig.4 Changes of the water content of Gastrodia elata during storage
2.2.4 呼吸强度 呼吸强度是可以评价农产品的生命活动的关键指标之一,通过呼吸强度可以判断农产品营养物质的消耗情况以及衰老情况[19]。图5表明,贮藏期0~3 d的天麻呼吸强度很低,可能由于天麻处于休眠期。从贮藏6 d开始,25 ℃贮藏天麻的呼吸强度开始快速上升,而1 ℃贮藏天麻的呼吸强度缓慢上升,并且从贮藏6 d开始至贮藏30 d内,25 ℃贮藏天麻的呼吸强度显著高于1 ℃贮藏天麻的呼吸强度(P<0.05)。在贮藏15 d时,25 ℃贮藏天麻的呼吸强度达到呼吸高峰,而1 ℃贮藏天麻的呼吸强度在24 d达到呼吸高峰。由此推测,天麻的呼吸类型属于跃变型呼吸,并且1 ℃贮藏能够抑制天麻呼吸强度。

图5 鲜天麻贮藏期呼吸强度的变化Fig.5 Changes of the respiration rate of Gastrodia elata during storage
2.2.5 色差 色差L*值反映天麻颜色的亮度,L*值越大,代表天麻的亮度越大,在贮藏期间天麻的褐变情况影响天麻的L*值。图6(A)表明,25 ℃和1 ℃贮藏的天麻外表色差L*值在贮藏21 d内均没有显著性变化(P>0.05),从贮藏21 d开始快速下降,在贮藏30 d时,1 ℃贮藏的天麻外表色差L*值极显著(P<0.01)高于25 ℃贮藏天麻的L*值。图6(B)表明,25和1 ℃贮藏的天麻内部色差L*值在贮藏12 d内均没有显著性变化(P>0.05),从贮藏12 d开始,25 ℃贮藏天麻的L*值开始下降,并且从贮藏12 d开始至贮藏30 d,1 ℃贮藏的天麻内部色差L*值显著高于25 ℃贮藏天麻的L*值(P<0.05)。由此推测,天麻的褐变从内部开始逐渐向外褐变,并且1 ℃的贮藏能够延缓天麻的褐变。

图6 鲜天麻贮藏期色差的变化Fig.6 Changes of the chromatic aberration of Gastrodia elata during storage
2.3 鲜天麻贮藏期营养品质的变化
2.3.1 可溶性固形物含量 可溶性固形物含量变化是农产品贮藏期间重要的指标之一,通常情况下,农产品会因自身新陈代谢消耗而使可溶性固形物含量下降,这与图7的结果一致。图7表明,刚采挖的天麻可溶性固形物含量为6.73%,随着贮藏时间的延长,25 ℃和1 ℃贮藏的天麻分别呈现不同程度的下降,并且在整个贮藏期间,两处理组没有显著性差异(P>0.05),但从贮藏24 d开始至贮藏30 d,25 ℃贮藏的天麻可溶性固形物含量高于1 ℃贮藏的天麻。说明天麻的可溶性固形物含量随贮藏时间的延长呈现下降趋势,并且25 ℃和1 ℃贮藏的天麻对其可溶性固形物含量的影响没有显著差异(P>0.05)。

图7 鲜天麻贮藏期可溶性固形物含量的变化Fig.7 Changes of the soluble solids content of Gastrodia elata during storage
2.3.2 蛋白质含量和多糖含量 天麻蛋白质是天麻重要的营养指标之一,天麻多糖具有调节机体免疫力、降血压、抗衰老等多种功能[20]。图8(A)表明,天麻的蛋白质含量总体呈现下降的趋势,在整个贮藏期间,25 ℃和1 ℃贮藏的天麻蛋白质含量没有显著差异,但从贮藏12 d开始,25 ℃贮藏的天麻蛋白质含量低于1 ℃的贮藏。图8(B)表明,刚采挖的天麻多糖含量为273.45 mg·g-1,从贮藏开始至贮藏12 d,25 ℃和1 ℃贮藏的天麻多糖含量没有显著性差异(P>0.05)。从贮藏15 d开始至贮藏30 d,25 ℃贮藏的天麻多糖含量显著低于1 ℃的贮藏(P<0.05)。因此,天麻的多糖含量呈现下降的趋势,并且1 ℃的贮藏能够保持天麻的多糖含量。

图8 鲜天麻贮藏期蛋白质含量(A)和多糖含量(B)的变化Fig.8 Changes of the content of protein(A) and polysaccharidet(B)of Gastrodia elata during storage
2.3.3 天麻素含量和腺苷含量 目前的研究认为天麻素是天麻的主要活性成分,是评价天麻质量标准的首要指标,天麻腺苷具有镇静、催眠等作用[21]。图9(A)表明,刚采挖天麻的天麻素含量为685.45 μg·g-1,在贮藏期前3 d,25 ℃和1 ℃贮藏的天麻的天麻素含量没有显著性差异(P>0.05)。从贮藏3 d开始,25 ℃贮藏天麻的天麻素含量开始快速下降,并且从贮藏3 d至贮藏30 d,25 ℃贮藏天麻的天麻素含量低于1 ℃的贮藏,在货架30 d时,1 ℃贮藏天麻的天麻素含量为632.46 μg·g-1,25 ℃贮藏天麻的天麻素含量603.32 μg·g-1。图9(B)表明,刚采挖天麻的腺苷含量为97.22 μg·g-1,在整个贮藏期内,25 ℃和1 ℃贮藏的天麻的腺苷含量没有显著性差异(P>0.05)。在贮藏30 d时,25 ℃和1 ℃贮藏天麻的腺苷含量分别为71.32、76.48 μg·g-1。说明天麻的天麻素含量和腺苷含量在贮藏期间均呈现下降的趋势,并且相较于天麻腺苷,温度对天麻素的含量变化影响更大。
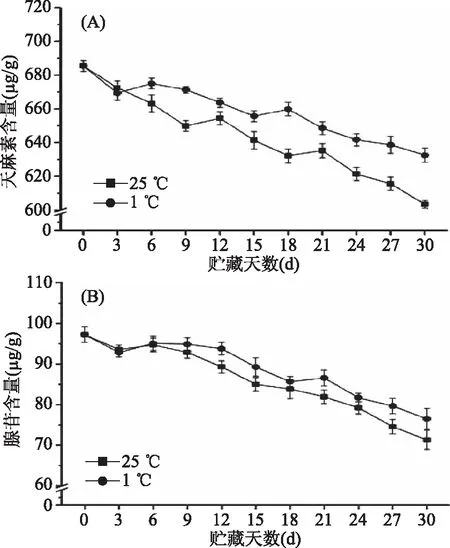
图9 鲜天麻贮藏期天麻素含量(A)和腺苷含量(B)的变化Fig.9 Changes of the gastrodin(A)and adenosine(B) content of Gastrodia elata during storage
2.3.4 对羟基苯甲醇含量和对羟基苯甲醛含量 对羟基苯甲醇含量和对羟基苯甲醛也是天麻重要的活性成分,具有良好的保健功能[22]。图10(A)表明,天麻的对羟基苯甲醇含量呈现下降的趋势,并且从贮藏6 d开始至贮藏30 d,25 ℃贮藏天麻的对羟基苯甲醇含量低于1 ℃贮藏的天麻,贮藏30 d时,25 ℃和1 ℃贮藏天麻的对羟基苯甲醇含量分别为173.32、186.82 μg·g-1。图10(B)表明,天麻的对羟基苯甲醛含量变化与对羟基苯甲醇含量变化相似。采挖的天麻对羟基苯甲醛含量为7.75 μg·g-1,贮藏30 d时,25 ℃贮藏天麻的对羟基苯甲醇含量显著低于1 ℃贮藏(P<0.05)。说明低温能够延缓天麻对羟基苯甲醇含量和对羟基苯甲醛含量的下降。

图10 鲜天麻贮藏期对羟基苯甲醇含量(A)和对羟基苯甲醛含量(B)的变化Fig.10 Changes of the p-hydroxybenzyl alcohol(A) and p-hydroxyben zaldehyde(B) content of Gastrodia elata during storage
2.4 鲜天麻贮藏期酶活性的变化
2.4.1 超氧化物歧化酶(SOD) 超氧化物歧化酶(SOD)能够专一性地清除农产品组织内的超氧化物,将超氧化物歧化过氧化氢酶和氧气,预防农产品组织衰老。图11表明,刚采挖的天麻SOD活性为419.26 U·g-1,在整个贮藏期内,25 ℃贮藏天麻的SOD活性低于1 ℃贮藏天麻的SOD活性,贮藏30 d时,25 ℃和1 ℃贮藏天麻的SOD活性与采挖时天麻SOD活性比较,分别下降了3.79%和1.32%,但均没有显著差异(P>0.05),说明天麻SOD活性在整个贮藏期处于波动状态,低温能够延缓SOD活性的下降。

图11 鲜天麻贮藏期超氧化物歧化酶(SOD)活性的变化Fig.11 Changes the superoxide dismutase activity of Gastrodia elata during storage
2.4.2 多酚氧化酶(PPO)和过氧化物酶(POD) 多酚氧化酶(PPO)能够催化酚类生成醌类的一种氧化酶,当农产品组织受到逆境胁迫或病菌侵染时,PPO活性会快速上升来保护其组织。图12(A)表明,PPO活性随着贮藏时间呈现先上升后下降继续上升的趋势,从贮藏开始至贮藏9 d时,25 ℃和1 ℃贮藏天麻的PPO活性均呈现上升趋势,有可能由于刚采挖的天麻需要克服新的环境而导致PPO活性上升,而1 ℃贮藏天麻PPO活性上升快主要由于低温胁迫加速PPO活性快速上升。随着贮藏期间的延长,天麻开始适应贮藏环境,PPO活性开始降低。而天麻PPO活性再一次上升是由于贮藏期间的天麻开始出现衰老,甚至病菌的浸染。从贮藏21 d开始至贮藏30 d,25 ℃天麻的PPO活性低于1 ℃贮藏的天麻活性。POD能够清除农产品体内的H2O2,把H2O2分解成对细胞没有伤害的H2O和O2,它也是农产品衰老的重要指标之一。图12(B)表明,从贮藏开始至贮藏6 d,25 ℃贮藏天麻的POD呈现下降趋势,而1 ℃贮藏天麻的POD活性呈现上升趋势,这可能是由于低温胁迫导致的,这与图12(A)PPO活性贮藏前期结果相似。在贮藏18 d时,25 ℃贮藏的天麻POD活性达到波峰,而1 ℃贮藏的天麻POD活性在24 d时出现波峰。在贮藏30 d时,1 ℃贮藏天麻的POD活性显著高于25 ℃贮藏天麻的POD活性(P<0.05)。因此,低温胁迫导致天麻PPO活性和POD活性的上升,但随着贮藏期的延长,低温延缓了天麻PPO活性和POD活性的上升。

图12 鲜天麻贮藏期多酚氧化酶(PPO)和过氧化物酶(POD)活性的变化Fig.12 Changes of the polyphenol oxidase activity(A) and the peroxidase activity(B)of Gastrodia elata during storage
2.4.3 过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX) CAT能够在逆境或者植物衰老过程中清除体内多余的活性氧,来维持体内氧代谢平衡,从而抑制其自身的衰老。图13(A)表明,在贮藏期前6 d,天麻的CAT活性呈现下降的趋势,并且1 ℃贮藏的天麻CAT活性下降更快,说明采挖后天麻由于适宜新环境加快呼吸,导致体内产生多余的活性氧从而使其CAT活性下降,并且低温胁迫加速了天麻CAT活性的下降。从贮藏9 d开始至贮藏30 d时,25 ℃贮藏的天麻CAT活性显著(P<0.05)低于1 ℃贮藏的天麻CAT活性。抗坏血酸过氧化物酶(APX)活性是植物体内抗氧化酶之一,其活性与植物体抗氧化水平呈正比。图13(B)表明,刚采挖的天麻APX活性为19.10 U·g-1,从贮藏开始至贮藏结束,1 ℃贮藏天麻的APX活性高于25 ℃贮藏天麻的APX活性,在整个贮藏期天麻APX活性均处于上升与下降的“波动”状态,这可能由于天麻受低温胁迫和其氧化衰老相关。因此,1 ℃贮藏能够保持天麻较高的抗氧化活性,并且整个贮藏期天麻的APX活性呈现“波动”状态。

图13 鲜天麻贮藏期过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性的变化Fig.13 Changes of the catalase activity(A)and the ascorbic acid peroxidase activity(B)of Gastrodia elata during storage
2.5 天麻贮藏期病原菌rDNA-ITS区域核苷酸序列测定与分析
以病原菌基因组DNA为模板进行PCR扩增,得到500~550 bp的rDNA-ITS片段,将测序得到的4个rDNA-ITS基因序列提交到GeneBank,获得登录号分别为MK141012、MK141013、MK141014和MK141015;上述序列于GenBank数据库进行BLAST 同源性比对,下载同源性超过90%的基因序列构建系统发育树如图14所示。结果显示,菌株A位于新壳梭孢菌属(Neofusicoccumsp.);菌株B位于间座壳属(Diaporthesp.);菌株C位于链格孢属(Alternariasp.);菌株D位于镰刀菌属(Fusariumsp.)。因此,可确定天麻病原菌主要为新壳梭孢菌属、间座壳属、链格孢属和镰刀菌属,所有菌株均为该菌属新的菌种。

图14 基于rDNA-ITS序列的天麻病原菌系统发育树Fig.14 Phylogenetic tree of the pathogen of Gastrodia elata and related species based on rDNA-ITS sequences
2.6 相关性分析与主成分分析
2.6.1 天麻生理品质相关性分析 表1表明,硬度分别与呼吸强度、含水量、内部色差、可溶性固形物、蛋白质、多糖、天麻素、腺苷、对羟基苯甲醛和对羟基苯甲醇呈极显著相关(r=-0.844~0.862,P<0.01),而与SOD呈显著正相关(r=0.530,P<0.05);外部色差与内部色差、可溶性固形物、蛋白质、多糖、天麻素、腺苷、对羟基苯甲醇呈极显著正相关(r=0.570~0.746,P<0.01),与对羟基苯甲醛呈显著相关(r=0.533,P<0.05);呼吸强度、含水量、内部色差与天麻营养指标均呈现极显著相关(P<0.01),天麻营养指标相互之间均呈现极显著正相关(r=0.873~0.975,P<0.01);SOD与呼吸强度呈显著负相关(r=-0.719,P<0.05);PPO与可溶性固形物、蛋白质、多糖、天麻素、腺苷、对羟基苯甲醇呈极显著负相关(r=-0.647~-0.567,P<0.01),

表1 天麻生理品质相关性分析Table 1 The correlation analysis of physiological quality of Gastrodia elata
与对羟基苯甲醛呈显著负相关(r=-0.486,P<0.05);POD与外部色差和SOD呈显著正相关(P<0.05);CAT与含水量和内部色差呈显著正相关(P<0.05);APX与其他指标均呈现不显著相关(P>0.05)。
2.6.2 天麻生理品质主成分分析 表2和表3表明,前三个主成分的贡献率为84.587%,说明可以用这3个主成分较好地代替上述17生理品质指标来评价天麻的生理品质变化规律。决定第一主成分的主要是硬度、呼吸强度、多糖、天麻素、腺苷、对羟基苯甲醇、对羟基苯甲醛等性状,第一主成分反映了原始数据信息量的62.575%,这几个指标均属于天麻的生理和营养品质。因此,可以把第一主成分称为生理营养因子。决定第二主成分大小的主要为SOD、PPO、POD、CAT、APX,其贡献率为13.307%,其中这几个指标均属于天麻的酶活性。所以可以把第二主成分称为酶活性因子。决定第三主成分的是外部色差,其贡献率为8.706%,称其为外部色差因子。

表2 总方差解释Table 2 Total variance explained
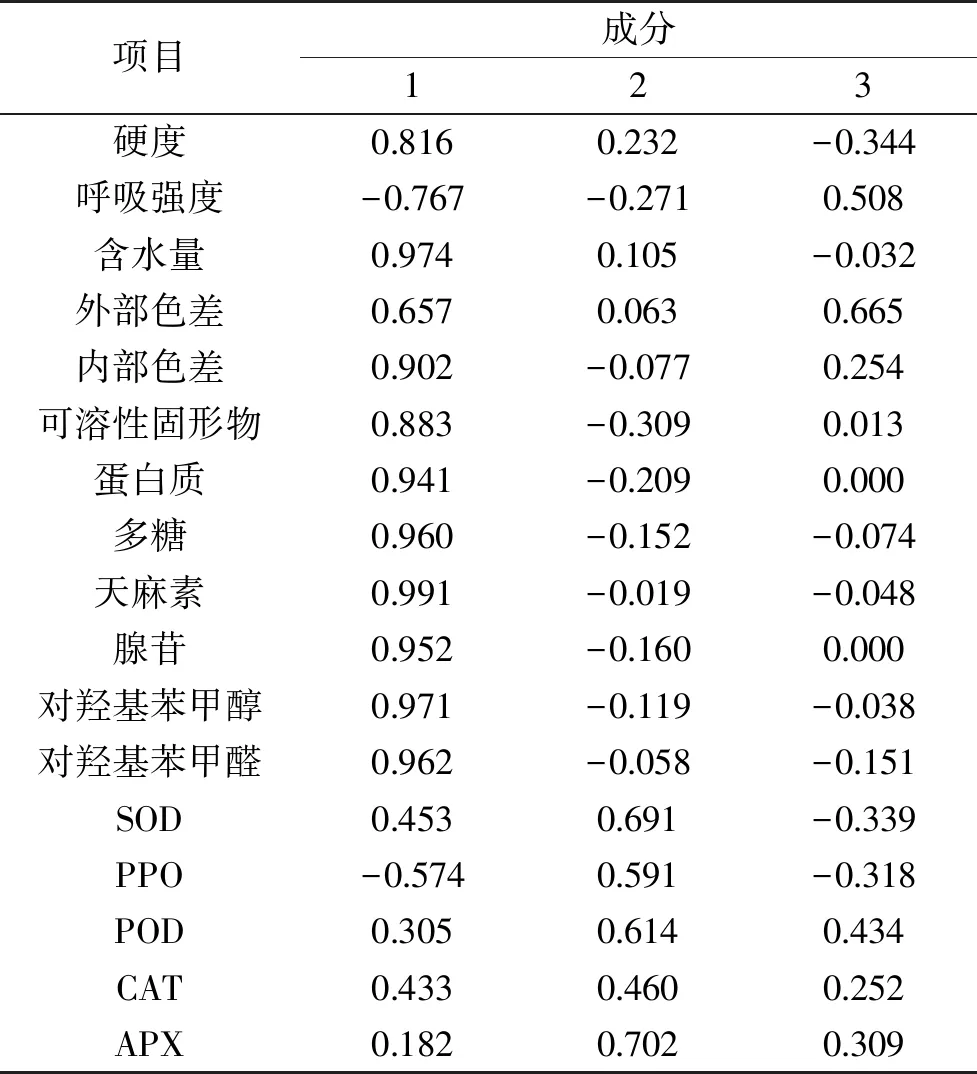
表3 成分矩阵Table 3 Component matrix
用三个主成分对天麻质地进行综合评价并计算综合得分[23]。以F1、F2、F3做线性组合,并以每个主成分的方差贡献率作为权数建立综合评价函数:F=(62.575% F1+13.307% F2+8.706% F3)/84.587%,其中F1:第一主成分得分,F2:第二主成分得分,F3:第三主成分得分,F为综合得分,F得分越高,说明生理品质越好。
3 结论
综上分析,通过研究鲜天麻采后贮藏期生理品质变化规律,结果表明,低温(1±0.5) ℃能够延缓鲜天麻采后的生理品质变化,建议天麻冷藏温度为0~1 ℃。天麻贮藏期主要的病原菌为新壳梭孢菌、间座壳属、链格孢属和镰刀菌属。相关性分析表明,鲜天麻采后生理品质均呈现良好的相关性,并且天麻的营养指标相互之间均呈现极显著正相关(P<0.01)。另外,通过主成分分析建立了天麻品质的综合评价函数,用于对天麻贮藏品质变化进行评价。

