拟南芥NO敏感突变体rsn1的特性分析
夏金婵,从人愿,张小莉
(河南中医药大学,河南 郑州 450008)
植物激素脱落酸(Abscisic acid,ABA)在种子休眠与萌发、植物生长发育及其对生物与非生物胁迫反应过程中发挥着重要的调控作用[1]。高盐、干旱等逆境胁迫能够增加植物体内的ABA含量。当细胞内ABA含量增加时,ABA与受体PYR(Pyrabactin resistance 1)/PYL(PYR1-like)/RCAR(Regulatory component of ABA receptor)结合形成复合物[2-3],进而抑制PP2C(Protein phosphatase 2C)磷酸酶的活性[4]。PP2C是ABA信号通路的一个负调控因子,在信号传递过程中ABA可以抑制PP2C磷酸酶的活性,从而解除PP2C对SnRK2(Sucrose nonfermenting 1 related protein kinase 2)的抑制作用,使SnRK2表现出其激酶的活性[5],SnRK2磷酸化下游转录因子ABF(ABRE-binding factors)/AREB(ABA-response elements)或离子通道KAT1 (K+channel inArabidopsisthaliana1),诱导ABA应答基因表达,引起气孔关闭,增强植物的抗逆能力等[6]。正常生长条件下,植物细胞内ABA含量低,不能激活下游转录因子ABF/AREB等。一氧化氮(Nitric oxide,NO)是植物体中重要的信号分子之一,大量研究证明,NO参与植物生长发育过程,如种子萌发、叶与根的生长、细胞凋亡以及植物的抗逆反应[7],而且,NO在调控植物生长发育与抗逆反应过程中与植物激素之间有密切联系。NO参与ABA合成[8]、乙烯合成[9]。在植物中ABA可以诱导第二信使的产生,如NO、钙离子、过氧化氢、磷酸肌醇等[10-12]。NO通过亚硝基化OST1(Open stomata)/SnRK2.6负调控ABA的信号传递过程[13],在根与保卫细胞中ABA能够诱导NO的产生[14-15]。由于植物大部分生长发育现象都受到植物激素的调控,因此,通过激素起作用可能是植物内源NO的作用机制之一。截至目前,关于NO与植物激素ABA之间关系的分子机制研究相对较少,基于此,采用正向遗传学的方法,以甲基磺酸乙酯(EMS)诱变后的拟南芥突变体库为材料,外源添加硝普钠(SNP)为筛选条件,成功获得根长对NO敏感的突变体rsn1(Root sensitive to NO),并对该突变体进行初步的表型及基因定位分析,为揭示植物的NO信号分子调控机制提供遗传材料。
1 材料和方法
1.1 材料
拟南芥(Arabidopsisthaliana)野生型为Columbia(Col-0)生态型。通过EMS诱变野生型拟南芥种子获得突变体库。
1.2 方法
1.2.1 植物培养及突变体rsn1的筛选 拟南芥在无菌培养皿中的培养过程:将拟南芥种子用10%~15%次氯酸钠溶液处理10~15 min,之后点播于1/2MS培养基上,为了使幼苗生长一致,4 ℃黑暗条件下处理4 d,放置在人工气候室内进行培养。培养条件:光照周期为16 h光照/8 h黑暗、光照强度为120~150 μmol/(m2·s)、温度为(22±2)℃、相对湿度为80%。NO敏感性检测:在灭菌后的1/2MS培养基中添加0、10、20、30、40、50、60 μmol/L SNP,生长20 d后测量根长,并计算相对根长(相对根长=处理条件下的根长/正常培养基上生长的根长×100%),得到根长表型对NO敏感的突变体rsn1。
1.2.2 背景纯化与遗传分析 以rsn1突变体为母本,与野生型杂交得到F1,在F1中观察突变基因的显隐性,F1自交后产生群体F2。把F2点种在含有50 μmol/L SNP的1/2MS培养基上,生长20 d后,统计根长的分离比,判断突变是否是单基因突变。得到纯合的单基因隐性突变体后,将其与另一种生态型拟南芥(Ler)杂交,得到F′1种子,自交得到F′2,从F′2中选取对NO敏感的个体进行基因定位。
1.2.3 NO含量分析 内源NO含量的测定采用DAF-2DA(4,5-diaminofluorescein diacetate)染色法进行。分别取在1/2MS培养基上生长7 d的野生型拟南芥和rsn1突变体幼苗的根,在含有1 mmol/L CaCl2、0.25 mmol/L KCl、5 mmol/L MES-KOH的缓冲液(pH值5.7)中温浴2 h后,用10 μmol/L DAF-2DA染色15 min,同时将所有材料从染液中取出,在缓冲液中清洗后观察。用配有CCD的荧光显微镜(ZEISS Stemi SV 11)对叶片发射的荧光进行记录和分析。激发光波长为495 nm,发射光波长为515 nm(滤光片),采集图像的曝光时间恒定。
1.2.4 生理指标测定 气孔直径:取正常生长20 d的野生型拟南芥与rsn1突变体的叶片表皮,放入缓冲液(10 mmol/L CaCl2、50 mmol/L KCl、10 mmol/L MES,pH值6.15) 中,放置在培养间2 h,利用显微镜(DMRE,Leica,Germany)观察气孔大小[16],添加ABA处理后2 h,测定60个气孔直径,重复3次,求平均值。失水率:分别取野生型拟南芥与rsn1突变体叶片各20片置于培养皿中,放入人工气候室(22 ℃,相对湿度50%)并于1、2、3、4、5、6、7 h称质量,计算失水率,重复3次,取平均值。
1.2.5 植物基因组DNA提取 将rsn1突变体和Ler杂交得到的分离群体F′2种子点种在含有50 μmol/L SNP的1/2MS培养基上,生长20 d,将对NO具有明显敏感表型的突变体移至正常培养基上,生长7 d后单株取材作为图位克隆的作图群体。挑选根生长受到抑制的幼苗,即具有突变体表型的个体,作为基因定位的群体,把挑选的幼苗放在1.5 mL离心管中,加600 μL抽提Buffer[0.2 mol/L Tris-HCl(pH值9.0)、0.4 mol/L LiCl、25 mmol/L EDTA、1%SDS],研磨;4 ℃、14 000 r/min离心10 min,取上清;加等体积的氯仿,混匀,4 ℃、14 000 r/min离心5 min,取上层,加等体积的异丙醇,混匀后置-20 ℃ 30 min;4 ℃、14 000 r/min离心10 min,弃上清液。
1.2.6 图位克隆 图位克隆(Map-based cloning)参考LUKOWITZ等[17]描述的方法。将提取得到的DNA沉淀,用1 mL 75%乙醇洗1次,风干;加适量含RNA酶的ddH2O;电泳检测DNA质量。所用Marker均来自TAIR网站(www.arabidopsis.org),根据表型与标记的连锁关系分析突变基因的定位。
2 结果与分析
2.1 NO敏感突变体rsn1的表型验证
从EMS诱变的拟南芥突变体库中筛选对NO敏感(以根长为标准)的突变体,其中,突变体rsn1在根的伸长方面表现出对NO敏感的表型。为了进一步验证该表型,将突变体分单株收取种子后,点种在含有不同浓度SNP的1/2MS培养基上验证其表型。在正常生长条件下,rsn1突变体的萌发率与野生型没有明显区别,但根长较野生型拟南芥稍短,约是野生型的2/3。突变体rsn1对NO胁迫表现出敏感表型,在SNP处理下,突变体rsn1根生长受到的抑制程度明显大于野生型,在50 μmol/L SNP处理下生长20 d后,野生型拟南芥的相对根长为48.7%,而突变体rsn1的相对根长仅为5.3% (图1A、B)。这些结果表明,rsn1基因参与了NO调控的信号转导途径,但对植物的正常生长发育没有明显影响。由于nox1和gsnor1突变体对NO敏感,与体内NO含量的升高有关[18],为明确突变体rsn1中NO含量的高低,故检测了突变体rsn1根中的NO含量,结果发现,突变体rsn1中NO含量与野生型无明显区别(图1C)。
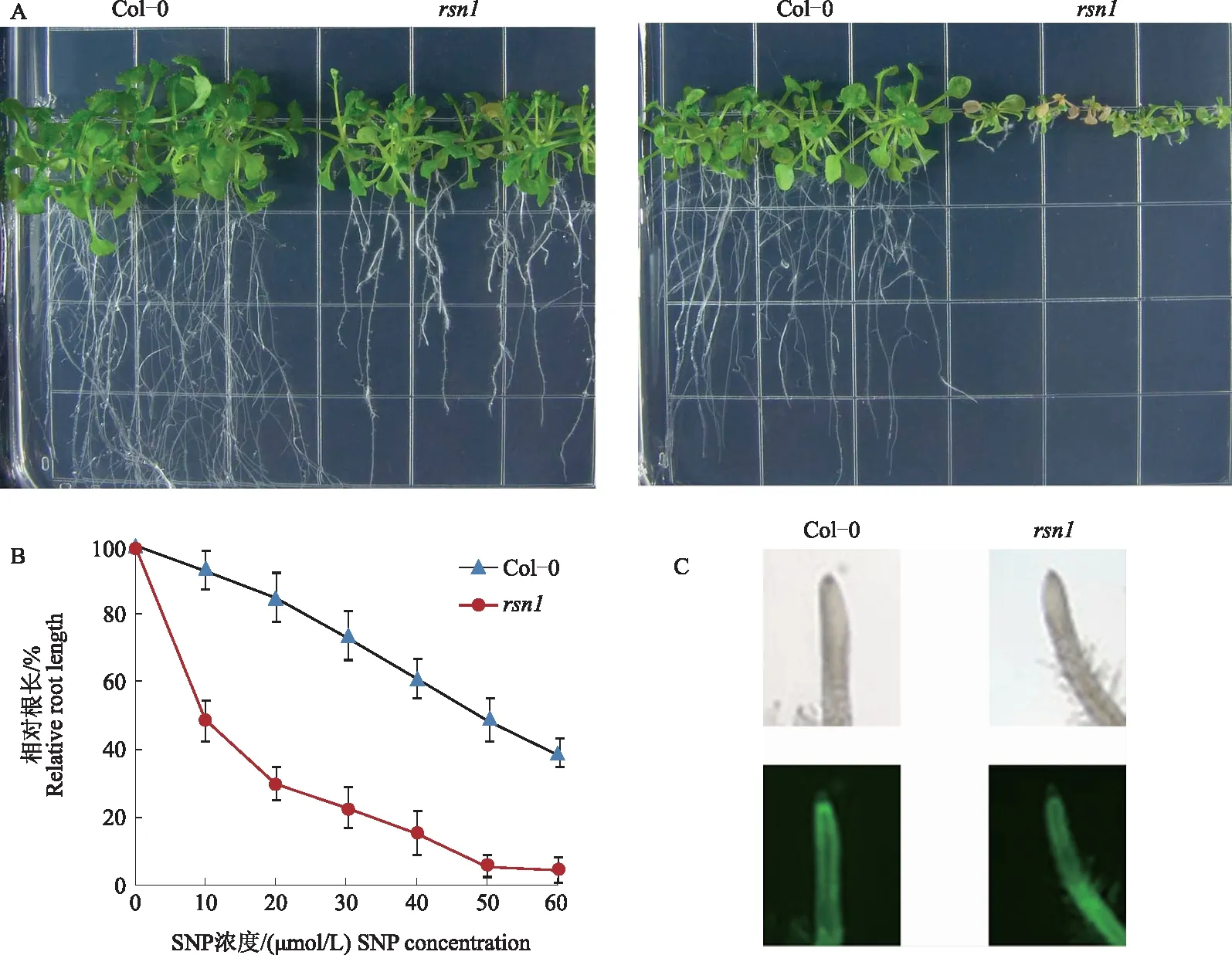
A.野生型拟南芥和突变体rsn1在含有0(左)、50(右)μmol/L SNP的培养基上生长20 d的表型; B.SNP处理条件下野生型拟南芥和突变体rsn1 生长20 d的相对根长; C.根中NO含量分析,用DAF-2DA染色采集荧光图片,上图为与下图对应的明场图像A.Phenotypes of wild-type and rsn1 seedlings grown on half-strength MS media supplemented with 0(left) and 50(right) μmol/L SNP; B.Relative root length of rsn1 mutant and wild-type Arabidopsis thaliana growing for 20 days under different concentration of SNP treatment; C.NO content in roots is reflected by fluorescent images of roots stained with DAF-2DA,and the above image is a bright field image corresponding to the image below图1 突变体rsn1对NO敏感的表型Fig.1 NO-sensitive phenotype of the mutant rsn1
2.2 突变体rsn1的遗传分析
为了分析rsn1的遗传学特性,将rsn1与野生型(Col-0)进行杂交,获得F1种子。F1幼苗自交后获得F2种子。检测F1和F2代对NO的抗性。结果表明,用50 μmol/L SNP处理F1植株,F1植株的根长与野生型拟南芥无明显差异,即对SNP不敏感,表明该突变体为隐性突变。进一步的遗传分析证实,在与野生型杂交的F2群体中发生了性状分离,根对NO敏感的植株分离比例为998/2 990,卡方检验结果表明,符合孟德尔遗传分离规律(1∶3,表1)。可见,rsn1对NO敏感的表型为单基因突变引起的隐性性状。

表1 rsn1突变体表型的遗传分析Tab.1 Genetic analysis of the mutant rsn1 phenotype
2.3 rsn1基因的粗定位
把rsn1与Ler生态型拟南芥杂交,获得F′1,F′1自交得到F′2。将F′2种子表面消毒后点种在含有50 μmol/L SNP的1/2MS培养基上生长20 d,将对NO具有明显敏感表型的突变体移至正常培养基上,生长7 d后单株取材作为进行图位克隆的作图群体。取F′2中分离得到的rsn1突变体,每50株rsn1突变体的DNA混合为1个库(Pool),共混合了2个,以此为模板,以5号染色体上的SSLP分子标记为引物,进行PCR扩增(图2),每个泳道上都有2条电泳条带,除nga129外,其他分子标记扩增出的条带Col-0(上面的条带)比Ler(下面的条带)大。从图2可知,以nga129为引物的PCR扩增产物电泳条带中Col-0的条带(下面的条带)比较亮(图2箭头所指),并且相邻的以ciw9为引物扩增出的条带中Col-0的条带(上面的条带)也比较亮,说明突变位点在nga129附近。而且,从5条染色体上选取不同的SSLP分子标记进行粗定位,提取F′2纯合子植株的DNA,通过PCR扩增发现,F′2重组率在nga129标记附近最低(表2),因此,rsn1中的突变基因位于5号染色体的nga129标记附近。

Pool1和Pool2均为50株突变体DNA的混合物;SSLP分子标记:1.nga139,2.nga76,3.PHYC,4.ciw9,5.nga129,6.ciw10Pool1 and Pool2 are both DNA mixture of 50 mutants; SSLP molecular markers:1.nga139,2.nga76,3.PHYC,4.ciw9,5.nga129,6.ciw10图2 第5号染色体上SSLP引物PCR扩增F′2中分离出的rsn1突变体的电泳图谱 Fig.2 Gel electrophoresis of PCR proclucts amplified by SSLP primer on chromosome 5 in the rsn1 mutant of F′2

表2 rsn1基因粗定位时各种SSLP分子标记的重组率 Tab.2 Recombination rate of various SSLP molecular markers in rough location of the rsn1 gene
2.4 rsn1基因参与ABA调控气孔运动过程
NO是植物体内一种重要的信号分子,不仅参与根的形态建成、种子萌发等生长发育过程,以及植物对干旱、盐度、重金属等非生物胁迫的响应过程,还调节植物细胞的气孔运动过程[19]。进一步测定正常生长20 d的野生型拟南芥和突变体rsn1叶片的气孔直径和失水速率,发现正常条件下突变体rsn1与野生型的气孔直径相近,但在10 μmol/L ABA处理下,突变体rsn1的气孔直径是野生型的1.9 倍,变化小于野生型,且突变体rsn1的失水率高于野生型拟南芥(图3),说明rsn1基因参与ABA调控气孔运动的过程。

图3 ABA处理下野生型拟南芥和突变体rsn1的气孔直径(A)和失水率(B)Fig.3 Stomatal diameter(A) and water loss rate(B) of wild type and rsn1 mutant Arabidopsis under ABA treatment
3 结论与讨论
信号分子NO能够调节植物的生长发育,增强植物的抗逆能力。研究表明,NO能够缓解干旱胁迫对植物的影响[20],外源NO能够降低小麦的气孔导度,提高其抗旱能力[21]。气孔作为控制二氧化碳吸收和蒸腾作用水分散失的通道,是植物与外界进行物质与能量交换的门户,NO也参与了气孔运动的调节过程。ABA能够诱导第二信使如NO、活性氧、三磷酸肌醇、钙离子的产生,接着第二信使参与ABA诱导的气孔关闭和其他生理过程[22],其中已证实NO参与ABA的信号转导过程,在保卫细胞和根尖中ABA诱导NO的产生[15]。外源施加NO能够诱导气孔的关闭,NO清除剂(c-PTIO)能够抑制气孔的关闭[23]。研究证实,NO可以通过调控一个内向K+通道和cGMP参与ABA对气孔运动的调节过程[24-26]。植物激素ABA在植物生长发育和适应环境过程中也扮演着重要角色,NO含量低的nia1nia2noa1三突变体中气孔对ABA胁迫不敏感[15]。WANG等[13]、杨凤博等[27]研究表明,NO通过OST1/SnRK2.6[Open stomata 1/sucrose nonfermenting 1(SNF1)-related protein kinase 2.6]的亚硝基化负调控ABA诱导的气孔关闭过程。但由于NO相关突变体较少,目前对于其调控的分子机制了解的还较少,筛选突变体是进行分子机制研究的一种重要方法[28]。
本研究通过正向遗传学方法筛选得到1株对NO敏感的拟南芥突变体rsn1,该突变体正常条件下与野生型拟南芥的萌发率没有明显区别,但在SNP处理下根表现出敏感的表型。进一步分析发现,突变体rsn1叶片的气孔对ABA引起的气孔关闭不敏感,而失水率高于野生型,说明rsn1基因可能参与了ABA调控的气孔运动过程。遗传学分析表明,rsn1是单基因隐性突变。该突变体的获得将为植物中NO调控ABA的信号途径研究提供理想的遗传材料。

