普通菜豆生长素调节蛋白基因PvARP1的克隆及表达分析
薛仁风,丰 明,赵 阳,陈 剑,李 韬,葛维德
(辽宁省农业科学院 作物研究所,辽宁 沈阳 110161)
生长素调节蛋白(Auxin-regulating protein,ARP)是一类参与植物生长发育调控的重要蛋白质因子。天然植物生长素的主要活性形式是吲哚-3-乙酸(Indole-3-acetic acid,IAA),生长素在调控植物的生长发育中发挥重要作用,在植物的抗病反应调控中也同样具有重要功能,许多植物病原菌通过自身产生生长素或者操纵植物合成生长素,从而干涉植物的正常发育过程[1-4]。拟南芥生长素不敏感突变体dth9对几种病菌的侵染表现更加敏感[5],而其生长素敏感突变体却增强了植株对病原物的抗性[6-7]。植物大多数生长素调节蛋白均具有IAA酰胺合成酶的活性,通过结合IAA并使其氨酰化,维持植物体内的生长素动态平衡[8]。DING等[9]证明水稻受白叶枯病原菌诱导产生生长素,生长素积累刺激了松弛细胞壁的蛋白质——伸展蛋白的产生,从而诱导植物细胞壁的松弛蛋白质的表达,弱化植物细胞壁作为天然屏障的防御作用,而植物则可以通过激活一类IAA酰胺合成酶GH3-8使生长素的主要形式IAA失活,抑制生长素信号和细胞壁松弛蛋白质表达,从而增强细胞壁抵抗病原菌侵染的能力。另外,GH3-8受不同病原物诱导,包括白叶枯病菌和稻瘟病菌[10],说明GH3-8参与的寄主抗性不具有小种专一性,其参与调节基础抗性。镰孢菌菜豆专化型(Fusariumoxysporumf.sp.phaseoli)引起的镰孢菌枯萎病是普通菜豆生产中的重要土传真菌性病害,严重影响菜豆产量,然而关于普通菜豆(PhaseolusvulgarisL.)抗镰孢菌枯萎病相关生长素调节蛋白基因的克隆及其表达特性的研究尚未见报道。鉴于此,从镰孢菌枯萎病原菌诱导的普通菜豆根组织中分离出1个编码生长素调节蛋白的基因,命名为PvARP1(GenBank登录号:MK301448),利用生物信息学方法对其序列进行初步分析,同时,对该基因在病原菌诱导下的表达特点和体外生物学活性进行分析,以期进一步探讨该基因在菜豆抗枯萎病过程中的作用机制。
1 材料和方法
1.1 试验材料及处理
供试普通菜豆感病品种BRB130和抗病品种260205由中国农业科学院国家作物种质资源库提供,普通菜豆镰孢菌枯萎病原菌FOP-DM01菌株(Fusariumoxysporumf.sp.phaseoliisolate FOP-DM01)由中国农业科学院作物科学研究所保存。7~10 d的普通菜豆幼苗用于病原菌的接种,参照XUE等[11]的方法进行。接种病原菌0、24、48、72、96、120 h后于根部取样,以未接种病原菌普通菜豆根组织作为对照。利用100 μmol/L水杨酸(SA)、100 μmol/L IAA、0.01%乙烯(ET)、100 μmol/L茉莉酸(JA)分别浸泡菜豆BRB130和260205幼苗根2~3 min,处理后移栽于灭菌营养土中,分别于0、24、48、72、96、120 h从根部取样,以分别浸泡0.001% 乙醇溶液和0.015% Silwet L-77的菜豆根为对照[12-13]。在菜豆不同器官中取样,通过qRT-PCR检测PvARP1基因在根、茎、叶、花、荚中的表达量。将所取样品迅速置于液氮中,-80 ℃保存备用。
1.2 总RNA的提取与cDNA合成
采用Trizol试剂提取各组织样品的总RNA,具体方法参照试剂说明书。以提取总RNA中mRNA为模板,利用Reverse transcriptase system 试剂盒(Promega,USA)合成第1链cDNA,用于基因克隆和表达量分析。
1.3 PvARP1基因全长cDNA克隆
根据中国农业科学院作物抗病鉴定及评价课题组构建的cDNA-AFLP差异显示文库中已有的一条EST序列CBFi28[14], 采用Phytozome 12.0数据库中BLAST功能进行序列比对,将包含CBFi28片段序列的基因确定为普通菜豆生长素应答GH3基因家族基因(Phvul.003G238700.1),根据该GH3基因序列设计引物,AF-1为5′-GCAGCCATCACTTTCTGATACCAACA-3′,AF-2为5′-AACCACCACCCATTCCTTTCACTCT-3′,以从菜豆260205根所提取RNA反转录的cDNA为模板,进行cDNA全长的扩增。PCR程序:95 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min;4 ℃保存。将PCR产物送北京英潍捷基生物公司测序。
1.4 PvARP1序列分析
利用生物信息学软件在线分析PvARP1基因编码的蛋白质氨基酸序列、理化参数、一级结构、跨膜结构域、信号肽序列、疏水结构域、二级结构和三级结构。利用ClustalX和MEGA软件分别进行氨基酸序列同源性比对和进化树分析。
1.5 PvARP1基因表达量分析
通过qTOWER 2.2实时定量PCR仪(Analytikjena,Germany),采用SuperReal PreMix (SYBR green,Tiangen,China)荧光定量PCR分析PvARP1基因表达量。试验数据采用2-ΔΔCt法分析,确定基因的相对表达量,每个取样点设3个重复。荧光定量PCR引物(F:5′-AATCGGAGACGAAGACGC-3′; R:5′-GGAAGGAATCAGGGCAGA-3′)根据PvARP1的cDNA序列设计,以普通菜豆的ACTIN基因作为内参,设计引物(F:5′-GAAGTTCTCTTCCAACCATCC-3′; R:5′-TTTCCTTGCTCATTCTGTCCG-3′)[15-16]。
1.6 PvARP1基因原核表达及蛋白质纯化
通过引物(5′-GCCATATGATGGCCATTGCTGCTGAC-3′/5′-GCCTCGAGACGACGACGTTCGGG-GGA-3′)在PvARP1基因上游和下游分别引入NedⅠ和XhoⅠ内切酶位点,经NedⅠ和XhoⅠ双酶切将基因连接入经相同酶切的pET42a(+)载体,构建PvARP1基因的原核表达载体,连接产物转化大肠杆菌感受态细胞BL21(DE3),挑取阳性克隆测序,命名为pET-PvARP1。将鉴定正确的阳性克隆单菌落接种于含50 μg/mL Kan的LB液体培养基,37 ℃、200 r/min振荡培养12 h。将上述菌液按1∶100接种于新鲜LB液体培养基(含50 μg/mL Kan),37 ℃条件下200 r/min振荡培养2~3 h,加入终浓度为0.5 mmol/L的IPTG,继续振荡培养,诱导重组蛋白表达。表达蛋白用6×His融合蛋白纯化试剂盒(Pierce,Rockford,IL) 纯化,操作步骤:收集诱导表达菌体,通过超声波破碎菌体细胞壁,4 ℃、12 000 r/min离心30 min,取上清液,用亲和层析柱吸附重组表达蛋白,缓冲液清洗2~3次,去除非特异性吸附蛋白质,用含有500 mmol/L咪唑的洗脱缓冲液收集重组表达蛋白。
1.7 PvARP1重组蛋白活性分析
蛋白质活性测定反应程序参照STASWICK等[8]的方法,具体操作:在20 μL反应体系中加入50 mmol/L Tris (pH值7.5)、3 mmol/L MgCl2、3 mmol/L ATP、1 mmol/L DTT、1 mmol/L IAA、1 mmol/L 氨基酸、5 μL的PvARP1纯化蛋白质,25 ℃分别反应0、5、10、20、30 min,反应结束后在体系中加入100 μL的甲醇溶液,取5 μL样品定量分析反应产物。采用高效液相色谱仪(Agilent 1100,Agilent technologies,Palo alto,CA)进行检测,使用Agilent C18 Zorbax ODS column (250 mm×5 mm) 色谱柱,程序运行温度为25 ℃,流动相(0.1% H3PO4)维持5 min,然后在4 min内以线性梯度逐渐转换为40%甲醇溶液,持续8 min,流速为1 mL/min,检测波长为230 nm。
1.8 数据处理
采用SPSS 19.0和Excel 2007进行数据统计分析。
2 结果与分析
2.1 普通菜豆生长素调节蛋白基因PvARP1全长cDNA序列克隆和分析
包含普通菜豆生长素调节蛋白基因PvARP1的片段全长为2 428 bp,经ORF finder预测,具有完整开放阅读框。通过PCR扩增得到预期长度的产物,将其命名为PvARP1。将完整的PvARP1基因开放阅读框序列连接至克隆载体pMD18-T,测定DNA序列。结果显示,原序列508―2 325位核苷酸为开放阅读框,长1 818 bp,编码605个氨基酸组成的蛋白质。蛋白质结构预测表明,PvARP1蛋白含有14个α-螺旋结构、17个β-折叠结构,其余为Loop结构(图1)。

下划线部分为α-螺旋结构,灰色部分为β-折叠结构
2.2 普通菜豆生长素调节蛋白基因PvARP1编码蛋白质序列分析
PvARP1所编码蛋白质的预测分子质量为68.26 ku,理论pI值为5.81。蛋白质结构预测结果表明,该蛋白质不含跨膜区,无明显的疏水结构域,无信号肽序列,不属于分泌蛋白。PvARP1的氨基酸序列与小豆(XP_017412459.1)、木豆(XP_020231129.1)、黎豆(RDY08267.1)等多种作物的ARP基因所编码的氨基酸序列具有很高的同源性。系统进化树分析(图2)结果表明,PvARP1与小豆的ARP蛋白(VaARP)亲缘关系最近,达到94%。
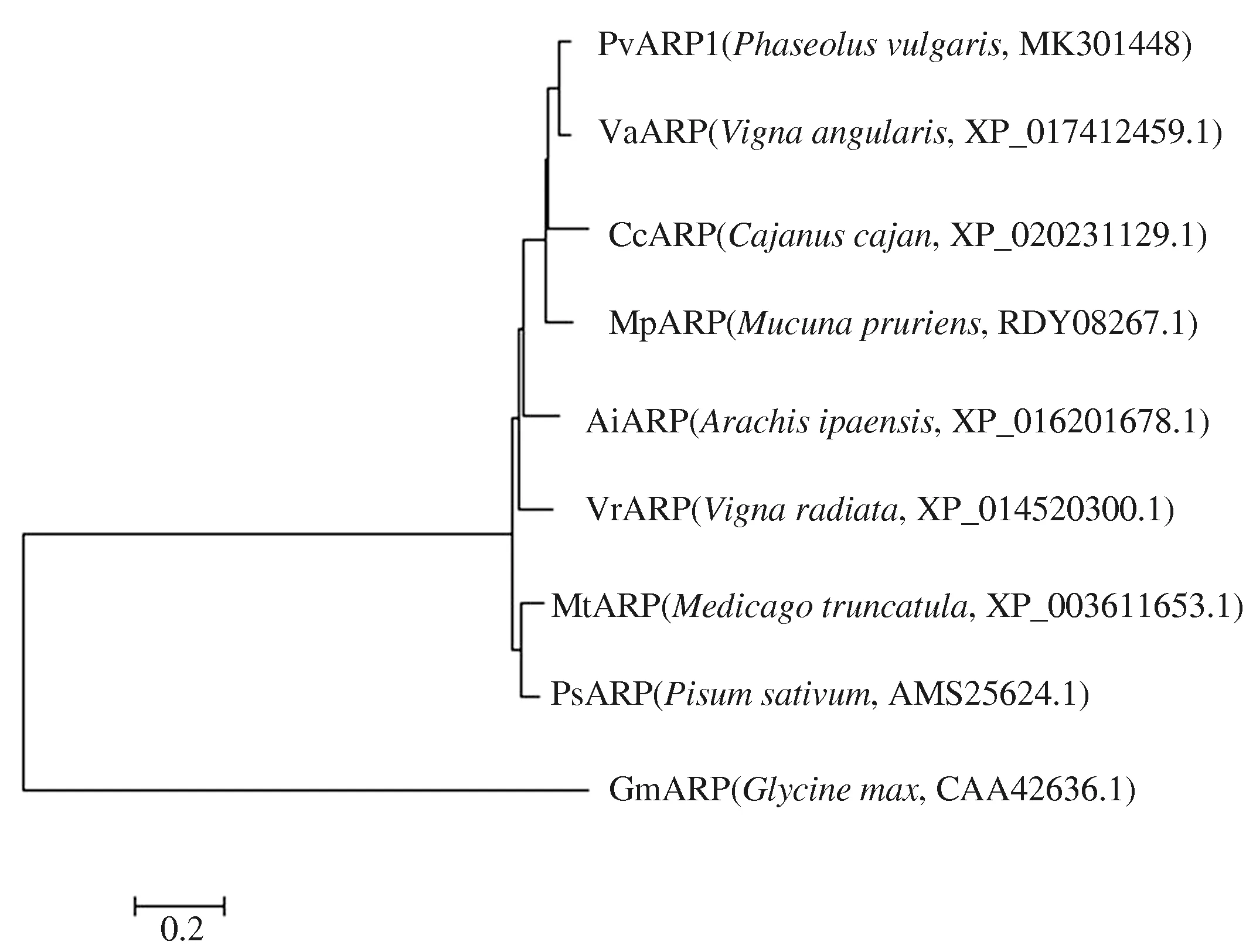
图2 普通菜豆生长素调节蛋白PvARP1与8个其他来源的ARP蛋白的进化关系Fig.2 Evolutionary relationship of auxin-regulating protein PvARP1 in common bean and 8 ARP proteins from other species
2.3 普通菜豆生长素调节蛋白基因PvARP1的表达分析
2.3.1 枯萎病原菌诱导普通菜豆生长素调节蛋白基因PvARP1表达分析 接种病原菌后,抗病材料260205和感病材料BRB130根中PvARP1表达量与各自接种0 h相比,均显著升高(P<0.05)。同一接种时间260205表达量均显著高于BRB130,接种24 h 260205根中PvARP1表达量上调最高,达到其接种0 h基因表达量的111倍;接种48~120 h,260205根中PvARP1表达量仍然维持在较高水平,可达其接种0 h基因表达量的42~56倍(图3)。上述结果表明,PvARP1基因受FOP-DM01菌株诱导表达量显著上调,即抗病材料表达量显著高于感病材料。
2.3.2 外源激素诱导普通菜豆生长素调节蛋白基因PvARP1表达分析 SA、JA和ET处理不同时间BRB130和260205中PvARP1基因表达量变化并不明显,甚至略有降低。IAA处理后BRB130和260205根中PvARP1基因表达量显著或极显著高于其他激素处理,感病材料BRB130的表达量在72 h达到最高,上升至处理0 h表达量的57倍,抗病材料260205基因表达量在处理96 h达到最大,上升至处理0 h表达量的92倍。SA、JA处理48 h和72 h的基因表达量略有升高(图4)。上述结果表明,IAA是PvARP1基因参与的抗病信号传导途径中的重要因子,而其他植物激素在PvARP1基因参与调节的防御反应中并不发挥关键作用。

*代表同一接种时间BRB130与260205之间的表达水平差异显著(P<0.05)
2.3.3 普通菜豆生长素调节蛋白PvARP1基因不同组织表达量分析 qRT-PCR分析结果表明,生长素调节蛋白PvARP1基因在普通菜豆根、茎、叶、花、荚中均有不同程度表达(图5)。菜豆花和荚中PvARP1基因表达量明显高于根、茎和叶中的表达量。以根中PvARP1基因表达量为参照,抗病材料260205茎和花中的表达量显著和极显著高于感病材料BRB130,根、叶、荚中的表达量没有显著差异。PvARP1基因在抗病材料260205花中表达量最高,可达根中表达量的53倍。

*和**分别代表同一处理时间BRB130与260205不同处理

*和**分别代表BRB130与260205在同一器官中表达水平差异显著(P<0.05)和极显著(P<0.01)
2.4 普通菜豆生长素调节蛋白基因PvARP1原核表达分析
本研究中,PvARP1重组表达蛋白以无活性的包涵体沉淀形式存在。将包涵体蛋白溶解于8 mmol/L尿素溶液,采用镍柱亲和层析技术纯化重组蛋白,通过透析技术逐渐降低蛋白质溶液中尿素浓度,获得复性的PvARP1重组蛋白。通过SDS-PAGE电泳验证重组蛋白纯化效果与分子质量,得到融合表达蛋白6×His-PvARP1的单一条带,重组蛋白分子质量约为68 ku,与PvARP1基因预测编码蛋白质的分子质量一致(图6)。
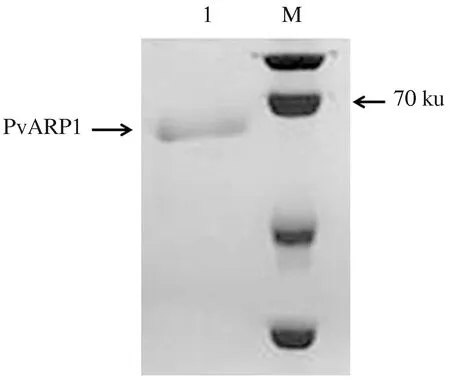
1.纯化的PvARP1重组蛋白;M.蛋白质分子质量标准
2.5 普通菜豆生长素调节蛋白基因PvARP1表达重组蛋白活性测定
如图7所示,在PvARP1重组蛋白的作用下,IAA逐渐被氨基化合成IAA-Asp(天冬酰吲哚乙酸)和IAA-Ala(丙氨酰吲哚乙酸)。IAA的初始浓度为1 mmol/L,反应开始后IAA浓度逐渐降低,反应30 min后,IAA的浓度降低至0.2 mmol/L。反应产物IAA-Asp和IAA-Ala的浓度随着反应进行逐渐升高。30 min后,IAA-Asp的浓度达到0.6 mmol/L,IAA-Ala浓度为0.17 mmol/L。上述结果表明,PvARP1编码蛋白质具有酰胺合成酶活性,在PvARP1重组蛋白的催化下具有活性的IAA被转化为无活性化合态,从而降低了植物细胞内游离IAA浓度,激发了IAA参与的寄主抗病相关反应。

*代表同一反应时间浓度差异显著(P<0.05)
3 结论与讨论
本研究将从前期构建的普通菜豆与镰孢菌枯萎病原菌互作的cDNA-AFLP差异显示文库中获得的1个EST片段作为“种子”序列(该片段序列与大豆生长素调节蛋白GH3基因相似性达80%),应用PCR技术从普通菜豆260205中分离出生长素调节蛋白基因PvARP1的cDNA全长序列,其编码的蛋白质与镰孢菌枯萎病抗病性相关。植物生长素不但与植物生长和发育密切相关,同时也参与调节植物对病原菌的抗性反应[9,17-19]。拟南芥生长素敏感突变体dth9对几种不同病原菌的侵染更加敏感,而生长素敏感突变体增强了植株对病原物的抗性[5-7]。尽管有研究表明,病原生长素可作为侵染植物的毒性因子[6-7,19-22],但关于其在病原物侵染过程中的分子功能以及与植物防御系统互作的相关报道仍然较少。
SA和JA信号途径调节许多植物对不同病原物的防御反应[24]。O′DONNELL等[21]研究表明,拟南芥应答野油菜黄单胞菌侵染时,其体内IAA等激素水平的变化与SA并无直接联系。拟南芥IAA信号途径的转录因子AtARF6和AtARF8能够显著提高JA含量,表明生长素介导植物抗性不需要激活依赖JA的抗病信号传导途径[25]。前人研究显示,基础抗性和R基因介导的抗性可能存在重叠,导致形成了防御信号途径互相交叉的网络[26-27],DING等[9]研究结果表明,水稻中IAA参与的白叶枯病抗病信号传导途径是独立的,并不依赖SA和JA介导的植物抗病反应,而IAA、SA、JA 3种信号途径也存在相互作用。本研究结果表明,PvARP1基因能够被枯萎病病原菌显著诱导表达(P<0.05),而且受外源IAA诱导表达量明显升高,其他外源植物激素处理对基因表达量没有显著影响,但SA诱导下表达量略有提高,表明IAA可能参与菜豆对枯萎病菌的抗病反应,并不需要直接依靠其他类型激素参与的信号传导途径,而不同激素信号途径可能存在相互作用。不同组织表达量分析结果表明,花和荚中PvARP1基因表达量明显高于根、茎和叶中的表达量(P<0.05)。
NAVARRO等[6]研究显示,超量表达生长素受体使生长素合成量增加,提高了植株对病原菌的敏感性,相反,通过RNA干扰技术抑制生长素受体的合成,从而抑制生长素信号的传导,提高了植株对病原菌的抗性。KIDD等[12]证明,生长素介导的信号传导途径激发了拟南芥对镰孢菌枯萎病原菌的感病性,病原菌通过色氨酸途径诱导寄主IAA的过量合成,从而使寄主更易感病。上述结果表明,生长素提高了植物对病原物的敏感性。水稻生长素调节蛋白GH3-8可以氨酰化IAA,调节植物体内IAA的含量,从而抑制了水稻表皮细胞壁中α-伸展蛋白和β-伸展蛋白的合成,阻止了细胞壁松弛,形成天然屏障,抑制病原菌在水稻中生长和繁殖[9]。此外,相关研究还表明,通过激活GH3类蛋白质抑制生长素信号增强了对细菌病原物的抗性,增强的抗性可能和激活了PR-1基因的表达有关[28-29]。本研究结果表明,PvARP1基因的重组表达蛋白在体外试验中具有酰胺合成酶活性,能将IAA转化为无活性化合态IAA-AA,说明PvARP1可能通过调节植物生长素的合成和代谢从而正向地调控植物对枯萎病病原菌的防御反应。

