矮牵牛同源多倍体诱导及其初期表型差异分析
蒋 卉,袁 欣,冯乃馨,张 晶,李艳敏,符真珠,高 杰,董晓宇,王慧娟,王利民,张和臣
(河南省农业科学院 园艺研究所,河南 郑州 450002)
多倍体化普遍存在于被子植物中,是植物物种形成、多样化和进化的重要方式[1-2],能产生巨大的表型变异,也是人类生产活动以来进行植物育种的重要方法[3]。多倍体通常在植株形态和植物生理生化方面与二倍体植株存在较大差异,例如根、节结、叶、果实、花和种子等,表现为整株增大、生长缓慢、花期滞后和生长周期延长,对干旱、盐碱、温度和病虫害等逆境的适应能力增强等[4-5],与人工选育方向高度契合。
人工诱导多倍体的方法有多种,包括物理法、化学法和生物学法。其中,物理诱导法包括温度激变、超声波和射线照射等[6],但诱导率较低。化学诱导剂主要有秋水仙素、甲基氨草磷(APM)、吲哚乙酸、鬼臼树脂、富民隆、甲基氨草磷、安磺灵、氟乐灵等[7-8]。目前秋水仙素处理效果最佳[9],主要通过真空处理花、浸泡植株、滴沾顶端分生组织,棉球敷叶腋,浸泡胚、种子或花粉母细胞,混合培养叶片、叶柄外植体等方法诱导[10],秋水仙素特异性地与微管蛋白质原件结合,阻止分裂细胞中纺锤丝的合成,中断有丝分裂,形成染色体加倍的核。秋水仙素处理效果因植物种类、处理材料、诱导方式或试剂、处理剂量和处理时间而不同,掌握最佳的诱导剂、处理剂量和处理时间是提高诱导效率的关键。
矮牵牛是茄科矮牵牛属多年生草本植物。花型、花色丰富艳丽,温室栽培可四季开花,是重要的装饰性花卉。矮牵牛的育种方法主要有杂交育种、基因工程育种、体细胞杂交育种和倍性育种等,多倍体育种是倍性育种的重要方式。国外对矮牵牛多倍体研究具有一定历史,因涉及商业机密,缺乏相关报道资料,国内矮牵牛多倍体育种报道也较少,主要内容是通过调节秋水仙素质量分数、选择合适的处理材料诱导多倍体。早期国外培育的多倍体具有花径大、花色丰富、开花周期长等特点。张敩方等[11]采用0.05%秋水仙素处理矮牵牛种子24 h后,获得较佳的诱导效果和变异植株存活率。矮牵牛B3种子经0.1%秋水仙素处理48 h后,获得了26.7%的诱导率[12]。此外,对一叶一心期的矮牵牛采用0.2%秋水仙素处理3 d后,也获得较高的多倍体诱导率[13]。矮牵牛组培苗茎尖经0.1%秋水仙素处理36 h后,获得20%的多倍体诱导效率[14]。但以上研究均存在较高频率的混倍体。鉴于此,拟在无菌条件下,使用秋水仙素处理矮牵牛种子,获得更高纯合度和更高倍性的诱导植株,提高诱导植株存活率,并分析变异植株的表型数据,为后续研究提供依据。
1 材料和方法
1.1 试验材料
矮牵牛野生品种(Petuniaaxillaris)种子由河南省农业科学院园艺研究所园林花卉研究室提供。
1.2 秋水仙素诱导矮牵牛种子
处理方法为无菌种子浸渍法。将矮牵牛种子用5%NaClO浸泡4~5 min后,用无菌水冲洗2~3次,采用不同质量分数的秋水仙素水溶液(0.05%、0.10%和0.20%)浸泡种子。将每个处理种子分为4份,每份种子数量为90~120粒,分别于25 ℃暗培养12、24、36、48 h,用无菌水冲洗2~3次后接种到MS固体培养基,每瓶30~40粒,每个处理3瓶,以无菌水浸泡48 h的种子为对照(CK)。所有处理样品均置于25 ℃、光照/黑暗(16 h/8 h)条件下培养。50 d后依据是否长出1对真叶,统计存活率。
1.3 流式细胞仪鉴定多倍体
采用流式细胞仪进行鉴定。将诱导存活的幼苗,切取0.5 cm2嫩叶置于培养皿中,加入萃取裂解缓冲液,快速切碎并完全浸泡于萃取液CyStain@ DNA 1 step staining solution(Sysmex,Germany)中,过滤后获得单细胞悬液,遮光静置5~8 min。将样品管插入CyFlow Cube 3分析仪中分析DNA含量,以CK发芽幼苗为标样,每个处理测定10~15株样品,重复2次。根据流式细胞仪绘制的分离峰,统计矮牵牛2x、4x和8x变异植株的数量,统计4x诱导率和8x诱导率。
1.4 变异植株形态观察和叶绿素、类胡萝卜素含量测定
观察无菌苗时期变异植株形态特征,包含叶色、株高、节间距(叶)和气孔等。
取无菌苗叶片,撕取下表皮置于载玻片上,经I2-KI染色后,加盖玻片,在显微镜下选择2~3个视野记录气孔数目、保卫细胞长度和宽度及叶绿体数等,计算气孔密度、细胞长度/宽度,并拍照。
取组培苗叶片,称取0.02 g左右剪碎并用95%乙醇浸泡后,遮光过夜保存,得到其浸泡液,采用分光光度计测定浸泡液在649、665、470 nm处的吸光度,计算叶绿素a、叶绿素b、类胡萝卜素含量,重复3次,取其平均值。
叶绿素a含量(mg/g)=(13.95×A665-6.88×A649)×V/1 000W
叶绿素b含量(mg/g)=(24.96×A649-7.32×A665)×V/1 000W
叶绿素总含量(mg/g)=叶绿素a含量+叶绿素b含量
类胡萝卜素含量(mg/g)=(100×A470-2.05×叶绿素a含量-114.8×叶绿素b含量)×V/1 000W/245
式中,A665、A649、A470分别为相应波长下的吸光度,V为提取液体积,W为叶片质量。
2 结果与分析
2.1 矮牵牛多倍体诱导及流式细胞仪检测结果
对矮牵牛种子进行消毒处理后,使用灭菌秋水仙素(0.05%~0.20%)浸泡12~48 h,转入MS培养基进行芽诱导培养,获得变异植株,通过流式细胞仪检测正常植株和突变植株单片叶。检测结果表明,单片叶测定的分离峰均为单峰(图1),说明单片叶倍性一致、未有嵌合体情况发生。抽样测定发现,单株变异植株不同叶片分离峰的位置均相同,也均为单峰,表明诱导植株的倍性较为稳定。但发现有个别变异植株虽然倍性一致,不同区段表型差异较大,分株培养后依然维持差异表型,后续将对其进行进一步研究(未提供图片)。此外,抽样检测的变异植株的分离峰均在2x、4x和8x处,表明秋水仙素处理矮牵牛种子加倍获得的变异植株,大部分为染色体整体加倍。
2.2 不同倍性矮牵牛变异植株形态特征比较
未经秋水仙素处理的矮牵牛种子,其植株正常生长,叶微发黄,叶呈椭圆形或细长,叶尖较尖(图1A、表1)。诱导加倍为4x的变异植株,子叶较2x厚,多毛但不明显;第1~2片真叶卵圆,叶色偏绿或叶脉中心深绿,叶片厚度稍增加而不明显,叶毛稍增加不明显;>第3片真叶后叶片形态逐渐与CK叶片形态相似;节间距与CK类似或变短,节间距为2~3 cm或1~2 cm;40 d后株高为8~10 cm、5~6 cm或3~4 cm不等;植株的生长速度与CK类似或稍慢(图1C、表1)。诱导加倍为8x的变异植株,下胚轴较粗,近根尖局部膨大加粗,部分根生长受阻,下胚轴附近呈现黄褐色愈伤;子叶相对4x更加肥厚短小、多毛;第1~2片真叶卵圆、深绿,叶片加厚,叶毛增加明显;节间距缩短严重,为1~3 mm;植株生长速度很慢,40 d左右变异植株高度1~2 cm或<1 cm、多数<0.5 cm,较大比例变异植株处于刚长出子叶状态(图1D、表1)。4x倍性变异植株形态介于2x和8x倍性变异植株中间,可根据形态推测,但倍性的确定还需依据流式细胞仪检测结果。
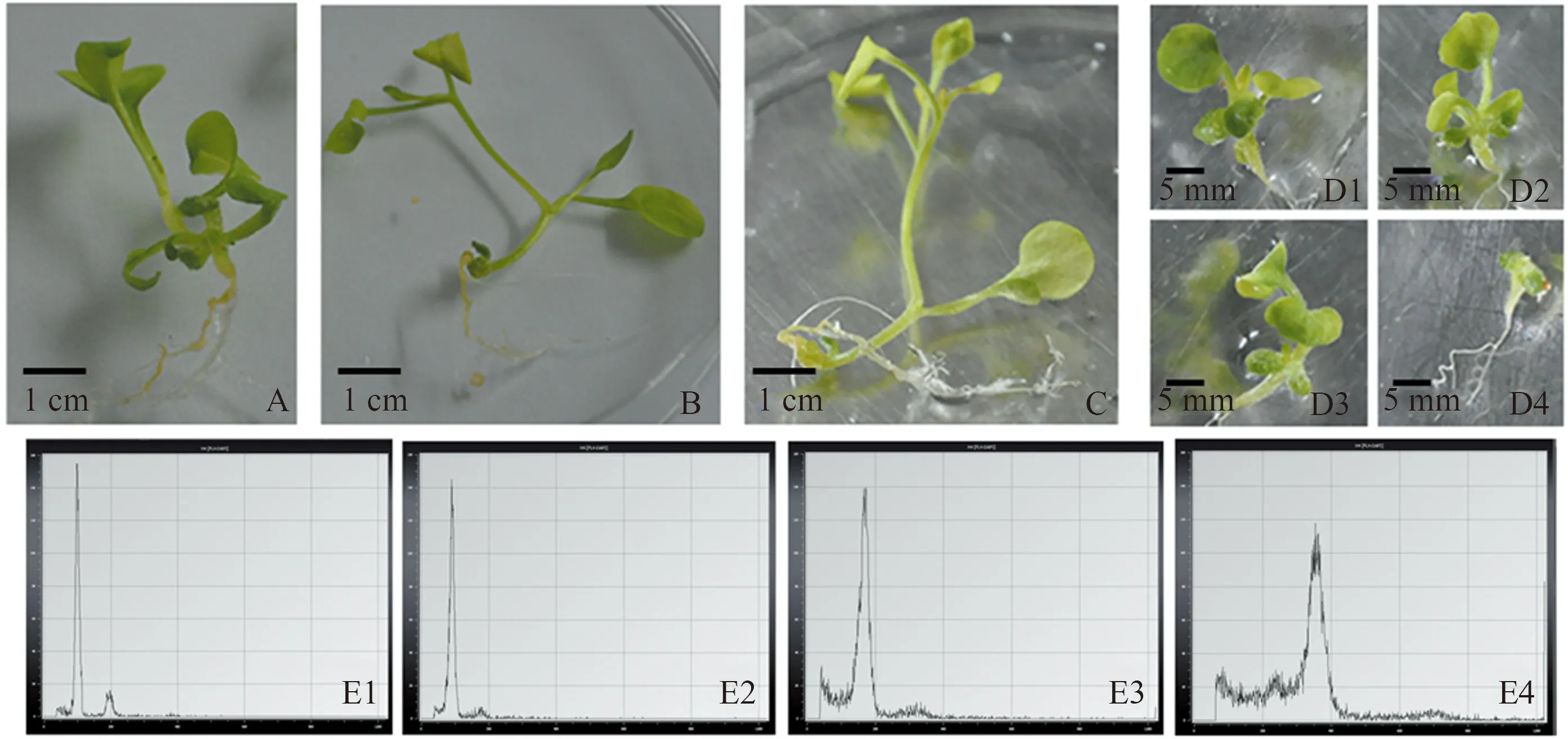
A:CK;B:2x矮牵牛植株形态;C:4x矮牵牛植株形态;D1—D4:8x矮牵牛植株形态;E1—E4:分别为CK、2x、4x和8x矮牵牛变异植株流式细胞仪测定的分离峰

倍性Ploidy子叶厚度Cotyledonthickness第1~2片真叶1stto2ndtrueleaves节间距Pitchspace株高Plantheight下胚轴直径Hypocotyldiameter根RootCK1~2mm叶微黄,叶呈椭圆形或细长,叶尖较尖2~3cm40d后株高为8~10cm1~2cm细长,为3~7根4x较2x厚,多毛但不明显第1~2片真叶卵圆,叶色偏绿或叶脉中心深绿,叶片厚度稍增加而不明显,叶毛稍增加不明显与CK类似或变短,节间距为2~3cm或1~2cm40d后株高为8~10cm、5~6cm或3~4cm不等较2x粗细长,为3~7根8x较4x更加肥厚短小,2~3mm,多毛第1~2片真叶卵圆、深绿,叶片加厚,叶毛增加明显缩短严重,为1~3mm植株生长速度极慢,40d左右变异植株高度1~2cm或<1cm、多数<0.5cm;较大比例变异植株处于刚长出子叶状态较粗短,<5mm近根尖局部膨大加粗,部分根生长受阻,下胚轴附近呈现黄褐色愈伤
2.3 秋水仙素对矮牵牛种子倍性诱导的影响
结合流式细胞仪检测结果,由表2可知,随着秋水仙素质量分数或处理时间的增加,矮牵牛种子的存活率逐渐降低,秋水仙素质量分数为0.05%~0.10%时,随着秋水仙素质量分数增加,4x和8x的诱导率增加;当秋水仙素质量分数为0.10%~0.20%时,随着秋水仙素质量分数增加,4x诱导率降低,8x诱导率增加;0.20%处理时间>24 h时诱导的均为8x突变体植株。秋水仙素质量分数为0.05%时,48 h时的4x和8x倍性诱导率合计为44.44%,存活率为44.44%。秋水仙素质量分数为0.10%时,随着诱导时间的增长,诱导率逐渐增加,至24 h时4x诱导率达到47.37%,8x诱导率达到21.05%;诱导时间进一步增长时,诱导率继续增加,但种子存活率快速下降,48 h时仅为8.33%。秋水仙素质量分数为0.20%时,最高存活率仅为8.00%。综上表明,0.10%秋水仙素处理24 h后的矮牵牛种子,在保证一定存活量同时,倍性诱导率最高,诱导的大部分为4x和8x突变植株,并可根据植株形态和生长状况进行初步的推测。如需定向诱导8x变异植株,可将0.10%秋水仙素处理时间延长至36 h左右。同时也表明,通过秋水仙素处理矮牵牛种子获得的倍性变异植株具有一定的规律,质量分数较低时诱导率也较低,突变植株以4x为主,随着秋水仙素质量分数和处理时间的增加8x变异植株的比例增加。
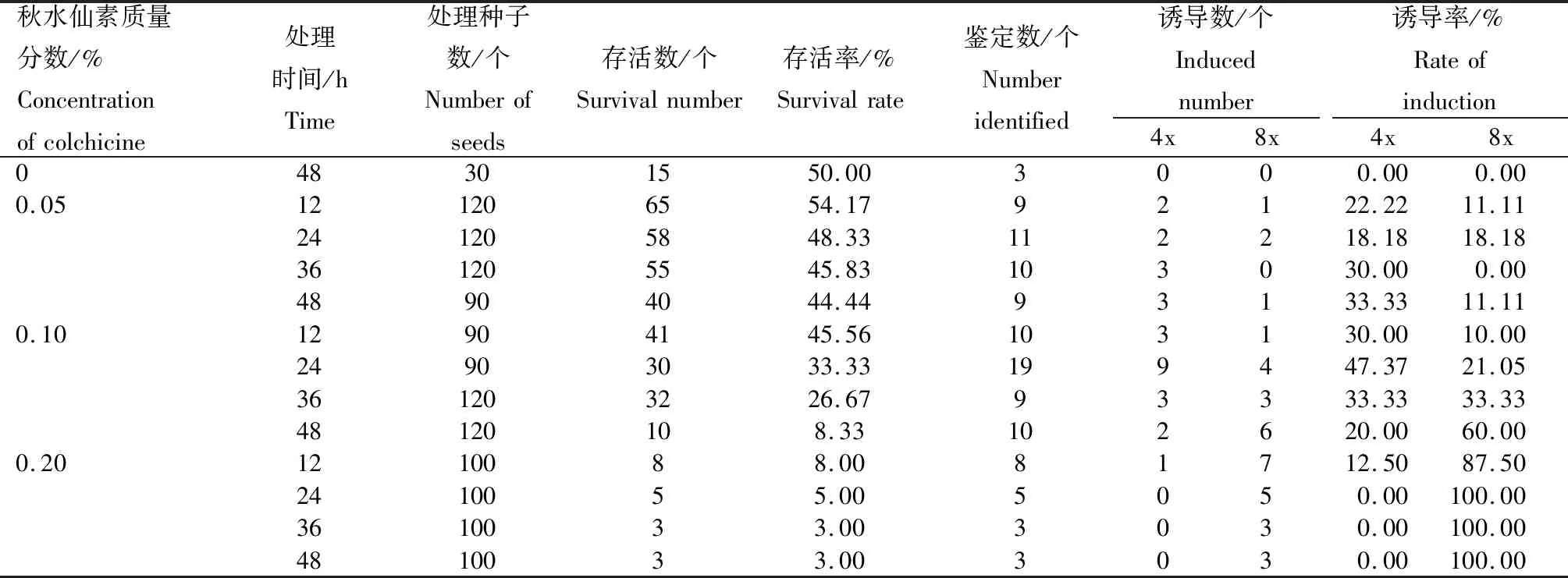
表2 秋水仙素对矮牵牛种子多倍体诱导的影响Tab.2 Effects of colchicine on polyploidy induction of Petunia axillaris seeds
注:鉴定数为通过流式细胞仪鉴定的植株数;诱导数为通过流式细胞仪鉴定的倍性植株数;诱导率=流式细胞仪鉴定倍性植株数/鉴定总数×100%。
Note: Identification number is the number of plants identified by flow cytometry; induction number is the number of ploidy plants identified by flow cytometry; induction rate=the number of ploidy plants by flow cytometry identification/total number of identification×100%.
2.4 不同倍性矮牵牛植株叶片气孔比较
对不同倍性矮牵牛气孔和保卫细胞观察(图2、表3)发现,气孔密度随着倍性的增加而快速降低,不同倍性间差异显著,2x的气孔密度最高,为137.39个/mm2,是4x的5.4倍,是8x的10.8倍,表明由4x至8x气孔密度降低了50%。8x保卫细胞的长度/宽度较2x和4x增大,2x和4x的长度/宽度为1.07和0.99,均近圆球形,而8x的长度/宽度为1.28,近椭圆形。此外,4x气孔长宽度和保卫细胞长宽度约是CK或2x的2倍,8x气孔和保卫细胞长度约是4x的2倍,表明不同倍性矮牵牛气孔和保卫细胞的长度随着倍性的增加而成倍增加,但倍性增加为8x时,变异植株的气孔和保卫细胞宽度未成倍增加。
2.5 不同倍性矮牵牛叶片叶绿素和类胡萝卜素含量比较
由图3可见,矮牵牛叶片叶绿素a和叶绿素b含量因秋水仙素的处理而表现降低,且差异显著;加倍后植株(4x或8x)较未加倍植株叶绿素a和叶绿素b含量低,且差异显著;但8x较4x变异植株的叶绿素a和叶绿素b含量有所增加,8x变异植株间标准差值增加,表明8x变异植株间叶绿素a和叶绿素b含量差异变化幅度较大。秋水仙素处理后,植株的类胡萝卜素含量升高,且差异显著,8x变异植株类胡萝卜含量较4x植株稍降低,差异不显著。

A.2x叶片气孔形态;B.4x叶片气孔形态;C.8x叶片气孔形态
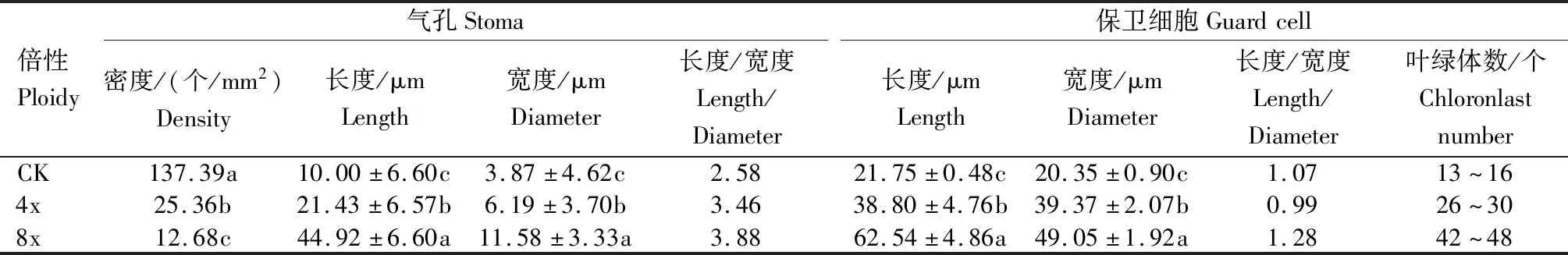
倍性Ploidy气孔Stoma密度/(个/mm2)Density长度/μmLength宽度/μmDiameter长度/宽度Length/Diameter保卫细胞Guardcell长度/μmLength宽度/μmDiameter长度/宽度Length/Diameter叶绿体数/个ChloronlastnumberCK137.39a10.00±6.60c3.87±4.62c2.5821.75±0.48c20.35±0.90c1.0713~164x25.36b21.43±6.57b6.19±3.70b3.4638.80±4.76b39.37±2.07b0.9926~308x12.68c44.92±6.60a11.58±3.33a3.8862.54±4.86a49.05±1.92a1.2842~48

CK为未处理二倍体矮牵牛;2x为诱导后未加倍二倍体矮牵牛;4x为四倍体矮牵牛;8x为八倍体矮牵牛。不同小写字母表示不同倍性间差异显著(P<0.05)
3 结论与讨论
本研究采用无菌培养的方法,通过1% NaClO消毒矮牵牛种子后,使用秋水仙素处理不同时长,获得了4x、8x倍性的变异植株,并获得4x变异植株的最佳诱导条件为0.10%秋水仙素处理24 h,8x变异植株的最佳诱导条件为0.10%秋水仙素处理36 h。通过本研究方法在获得较高诱导频率的同时,也提高了8x变异植株的存活概率,此前未见矮牵牛8x变异植株的报道。虽然染色体数量检测和流式细胞仪检测是目前最有效的方法,但流式细胞仪具有快速、准确、高效的优点[15]。本研究通过流式细胞仪检测单个变异植株不同部位材料,发现倍性具有一致性,出现的倍性均为4x和8x,表明本处理方法具有降低嵌合体和促进加倍的效果,获得的变异植株嵌合率较低,这可能与消毒后表皮的损伤导致加倍效果增强有关。此外消毒后即时进行秋水仙素处理,与种子萌发时期一致,在细胞快速分裂时期可能更有利于多倍体的诱导。
通过流式细胞仪鉴定获得的4x变异植株除第1~2片真叶叶尖变圆、叶宽增加外,其他表型不明显,但8x变异植株与CK、2x和4x表型差异较大,表现为节间变短、叶肥厚深绿、生长缓慢,可以作为鉴别矮牵牛相应倍性的重要依据[16]。多倍体植株通常具有气孔变大、气孔密度降低、保卫细胞中叶绿体数量增加的特点,这些特征可以高效地辨别多倍体[17]。本研究中下表皮气孔密度、气孔的大小和形态特征也可以作为相应倍性的鉴定条件,2x气孔密度为137.39个/mm2,为4x的5.4倍,是8x的10.8倍;2x气孔长度为10.00 μm, 4x是2x的2倍,8x是2x的4倍,因此,可以通过观察变异植株下表皮气孔特征快速进行倍性的鉴定。此外,本研究对不同倍性变异植株的叶绿素含量进行了检测,表明倍性的增加导致叶绿素含量降低,倍性继续加倍使叶绿素含量稍回升,与李柯[14]的研究结果一致,但与LI等[18]的结果相反,可能与检测时间为无菌苗时期,高倍体生长相对缓慢有关。
本研究通过处理方法的改进,更高效地获得了4x和8x矮牵牛,同时具有低嵌合率,对于观赏园艺植物倍性育种研究具有重要意义。此外,通过流式细胞仪和气孔观察方法进行倍性的鉴定准确性高,对于快速鉴定矮牵牛倍性植株具有重要指导意义。

