超声介导载sPD-1和miR-206基因纳米微泡协同抑制小鼠H22肝癌皮下移植瘤
谭妍迪,赵 云*,刘朝奇,周 军,郑智唯,马 瑶,姜矜君
(1.三峡大学医学院,湖北 宜昌 443002;2.宜昌市中心人民医院超声科,湖北 宜昌 443000)
肝细胞癌(hepatocellular carcinoma, HCC)是全球癌症死亡的第4大原因[1],目前对晚期HCC和耐药HCC的治疗方法较为有限。可溶性程序性死亡因子1(soluble programmed cell death 1 receptor, sPD-1)基因是免疫治疗的靶基因,通过阻断程序性死亡因子1(programmed cell death 1 receptor, PD-1)/PD-1配体(PD-1 ligand, PD-L1)信号通路激活机体免疫系统而抗肿瘤。HCC组织中miR-206表达显著降低,靶基因c-met表达增加,促进细胞异常增殖[2]。超声纳米微泡转载基因可保护基因不被降解[3],同时超声破裂微泡产生的空化作用和声孔效应等使基因转染效率显著提高,且微泡安全性较常用的病毒载体更好[4]。本研究探讨超声介导载sPD-1联合miR-206纳米微泡对小鼠H22肝癌皮下移植瘤的干预效果。
1 材料与方法
1.1 主要材料与仪器
1.1.1 实验动物及瘤株 SPF级雄性昆明小鼠45只,体质量18~20 g,由三峡大学实验动物中心提供,动物许可证号:SYXK(鄂)2010-0010。H22肝癌细胞瘤株,由三峡大学医学院湖北省重点实验室提供。
1.1.2 主要试剂 聚乙二醇-2000-二硬脂酰磷脂酰乙醇胺(DSPE-PEG2000,Avanti)、DC胆固醇(Dc-Chol,Avanti)、二棕榈酰磷脂酰胆碱(DPPC,Avanti)、全氟丙烷气体、miR-206和sPD-1质粒,总RNA提取试剂盒、逆转录试剂盒(大连宝生物科技有限公司)、PCR引物(生工生物工程股份有限公司合成)等。
1.1.3 主要仪器 纳米粒度及ZETA电位分析仪(马尔文仪器公司)、超声波清洗仪(SONICS)、超声治疗仪(UGT1025)、微量核酸蛋白检测仪(Thermo Scientific)、实时荧光定量PCR仪(Applied Biosystems,Step One Plus)、高速振荡仪、旋转蒸发仪、多功能显微镜及图像分析系统(Nikon)等。
1.2 sPD-1和miR-206基因构建 查找基因库[5-6]中小鼠sPD-1和miR-206基因序列,据其采用Prime 5.0软件设计引物,将上、下游引物分别引入限制性内切酶位点。以小鼠cDNA为模板,利用引物进行PCR扩增,采用琼脂糖凝胶电泳分离纯化其产物,以凝胶回收试剂盒回收目的基因。将目的基因与线性化空载体质粒于16℃连接过夜后转化感受态细胞,涂于含卡那霉素LB皿后37℃培养过夜,次日挑取菌落于含卡那霉素LB培养瓶中克隆扩增培养,抽提质粒后测序鉴定。
1.3 载基因阳离子纳米脂质微泡制备 取适量DSPE-PEG2000、DPPC、Dc-Chol混合于玻璃球管中,于旋转蒸发仪中40℃减压蒸发1 h,抽真空3 h除尽残余氯仿,加入甘油与PBS混合液,于超声波清洗机内至膜脱落后45℃水浴1 h,分装至西林瓶后将瓶中气体置换为C3F8,最后将西林瓶高频振荡得到阳离子脂质微泡。使用血球计数板计算浓度,粒度仪测量粒径电位。将1 μg质粒与107~108个微泡置于EP管中,共同孵育30 min,得到载miR-206或sPD-1阳离子纳米脂质微泡。采用琼脂糖凝胶电泳观察阳离子微泡与等量质粒是否结合,确定质粒连接最多时的微泡数量。将14 μg质粒与35 μl荧光染料碘化丙啶混合,进行荧光染色15 min,再与100 μl微泡共同孵育30 min,以共聚焦显微镜观察质粒与微泡结合情况。
1.4 实验动物分组及处理 将冻存的H22肝癌细胞株复苏培养后注入小鼠腹腔,饲养1周后抽取腹腔积液,分别取0.2 ml浓度为1×107/ml的细胞悬液接种于45只小鼠右前侧肩部,待移植瘤直径达0.5~1.0 cm即建模成功。于40只小鼠成功构建H22肝癌移植瘤模型,将其随机分均为5组,即模型组、空微泡组、sPD-1微泡组、miR-206微泡组、联合组,每组8只,均每2天经尾静脉注射1次;模型组给予生理盐水,空微泡组、sPD-1微泡组、miR-206微泡组给予相应微泡,联合组给予sPD-1微泡及miR-206微泡,剂量均为0.2 ml;于每次注射后给予超声辐照瘤体治疗1次,辐照条件:功率1 W/cm2,频率1 MHz,占空比50%,每只辐照时间90 s。5次注射及治疗后处死小鼠并剥离肿瘤,测量肿瘤质量及体积,计算肿瘤体积及质量抑瘤率。体积或质量抑瘤率=(模型组小鼠肿瘤体积或质量-实验组小鼠肿瘤体积或质量)/模型组小鼠肿瘤体积或质量。

图1 纳米脂质微泡特征 A.共聚焦显微镜下纳米脂质微泡呈球形,表面光滑; B.粒径分布图示纳米脂质微泡分散均匀,粒径均一; C.Zeta电位

图2 纳米脂质微泡的基因携载能力 A.共聚焦显微镜示质粒与微泡结合; B.琼脂糖凝胶电泳图
1.5 肿瘤组织形态及Bax、Bcl-2凋亡蛋白表达检测 釆用多聚甲醛将肿瘤组织固定后脱水包埋形成蜡块并切片,行HE染色观察肿瘤组织形态,采用免疫组织化学染色检测Bax、Bcl-2凋亡蛋白表达:与模型组比较表达量增加记为高表达,反之为低表达。
1.6 肿瘤组织Bcl-2、Bax、γ干扰素(interferon-γ, IFN-γ)、c-met、PD-L1 mRNA表达检测 采用RT-PCR。分别取各组肿瘤组织50 mg,以Trizol法提取组织RNA,逆转录得到cDNA。以GAPDH为内参,通过PCR反应扩增目的基因。PCR反应体系:引物(表1)1 μl,cDNA 1 μl,双蒸水10.5 μl,PCR Master mix 12.5 μl。琼脂糖凝胶电泳检测扩增产物,釆用Imagine J软件观察结果。
1.7 肿瘤组织miR-206表达检测 采用实时荧光定量PCR。反应体系:SYBR GreenⅠ 5 μl,上下游引物各0.25 μl(上游:5′-GGATCCAGGCCAAGATGGCACC TTAC-3′,下游: 5′-GAATTCCCTGAAACCCAGTATTGTGGG-3′),模板cDNA 2 μl,双蒸水2.5 μl。扩增程序:95℃预变性20 s;95℃变性3 s,58℃退火30 s,30个循环;每个样品重复测量3次,采用相对定量法计算结果。
1.8 统计学分析 釆用SPSS 19.0统计分析软件。计量资料均符合正态分布,以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 纳米脂质微泡特征 共聚焦显微镜下纳米脂质微泡呈球形,表面光滑,分散均匀,粒径均一,平均粒径(288.93±7.98)nm,Zeta电位(17.87±0.57)mV,见图1。共聚焦显微镜示质粒与微泡结合(图2A);琼脂糖凝胶电泳(图2B)示,1 μg质粒与30 μl微泡结合时,样品滞留于加样孔,无多余质粒向正极移动,即1 μg质粒结合30 μl微泡的结合比例恰当。

表1 Bcl-2、Bax、IFN-γ、PD-L1、c-met引物及序列
2.2 小鼠肿瘤生长情况 模型组小鼠肿瘤生长迅速,部分小鼠前肢出现运动障碍、全身呈恶病质状态。各组小鼠肿瘤体积、肿瘤质量、体积抑瘤率及质量抑瘤率差异均有统计学意义(P均<0.01),与模型组比较,各组肿瘤体积、肿瘤质量均降低,体积抑瘤率及质量抑瘤率均升高(P均<0.05),尤以联合组为著(P均<0.01)。见表2。
2.3 肿瘤组织形态 模型组肿瘤细胞排列紊乱,异型性明显;其余各组肿瘤细胞均见损伤,如核固缩溶解,大量均质红染的细胞碎片等,联合组上述表现更严重(图3)。
2.4 肿瘤组织Bax、Bcl-2蛋白和Bax、Bcl-2 mRNA表达 免疫组织化学染色及RT-PCR 结果显示,各组Bax、Bcl-2蛋白和Bax、Bcl-2 mRNA表达总体差异有统计学意义(P均<0.01)。与模型组比较,其余各组Bax蛋白和mRNA均高表达、Bcl-2蛋白和mRNA均低表达,以联合组为著(P均<0.01)。见表3。
2.5 肿瘤组织c-met、PD-L1、IFN-γ、miR-206 mRNA表达 各组小鼠肿瘤组织c-met、PD-L1、IFN-γ、miR-206 mRNA表达差异均有统计学意义(P均<0.01)。联合组c-met mRNA表达低于模型组、空微泡组、sPD-1微泡组,高于miR-206微泡组(P均<0.05);联合组PD-L1 mRNA表达低于模型组、空微泡组、miR-206微泡组,高于sPD-1微泡组(P均<0.05);联合组IFN-γ mRNA表达高于模型组、空微泡组及miR-206微泡组(P均<0.05);联合组miR-206表达高于模型组,低于miR-206微泡组(P均<0.05)。见表3。
3 讨论
基因在血液中易被核酸酶等降解清除,常用基因载体为重组病毒,对机体有免疫原性和侵入性[7]。本研究所选脂质微泡采用安全无毒的原材料,纳米级微泡可直接透过血管间隙进入肿瘤组织,在保护基因到达肿瘤组织的同时促进基因转染[8],且在超声辐照微泡破裂过程中产生的空化作用和声孔效应对肿瘤血管具有破坏作用,可进一步抑制肿瘤生长[9]。本研究结果显示,模型组小鼠肿瘤生长迅速,而其他各组肿瘤生长均受抑制,尤以联合组为著。
免疫治疗是肿瘤领域的研究热点。美国、欧洲肝病研究协会等制定的国际指南[10]提出,免疫治疗是肝癌晚期的有效治疗手段。PD-1/PD-L1是常用免疫检查点的分子靶点,通过阻碍PD-1与PD-L1结合而抑制信号通路,减轻癌细胞对免疫系统的抑制,从而激活免疫系统抵抗肿瘤。PD-1抗体如nivolumab已用于临床,可提高晚期HCC患者总生存率,且安全性尚可[11]。本研究结果显示,sPD-1及靶向PD-L1的miR-206联合治疗可有效阻断PD-1与PD-L1结合,促进肿瘤微环境IFN-γ上调及PD-L1下调,逆转被抑制的T细胞,提高NK细胞及T细胞活性,进而提高细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)的抗肿瘤作用。Pan等[12]釆用sPD-1治疗H22肝癌小鼠的实验也证明sPD-1可通过上调促炎症因子IFN-γ而增强小鼠的抗肿瘤免疫,但该研究采用裸质粒局部注射于肿瘤部位,临床可操作性小;本研究采用的载基因脂质微泡通过静脉注射即可进行微创治疗。
表2 各组小鼠肿瘤体积、质量及其对应的抑瘤率比较(±s,n=8)

表2 各组小鼠肿瘤体积、质量及其对应的抑瘤率比较(±s,n=8)
组别 肿瘤体积(mm3) 肿瘤质量(g) 体积抑瘤率质量抑瘤率 模型组9 845.57±1 495.867.29±2.21 0 0空微泡组6 147.71±1 203.97*4.20±1.86*0.38±0.03**0.44±0.13**miR-206微泡组1 342.22±1 404.47**##0.16±0.08**#0.87±0.12**##0.98±0.00**sPD-1微泡组3 675.43±1 006.00**1.17±0.99**0.63±0.06**#0.86±0.09**联合组602.95±262.74**##0.11±0.06**#0.94±0.02**##△0.99±0.00**F值31.7015.53 110.25 108.59 P值<0.01 <0.01 <0.01 <0.01
注:*:与模型组比较,P<0.05;**:与模型组比较,P<0.01;#:与空微泡组比较,P<0.05;##:与空微泡组比较,P<0.01;△:与sPD-1微泡组比较,P<0.05
表3 各组小鼠肿瘤组织Bax、Bcl-2、c-met、PD-L1、IFN-γ、miR-206 mRNA表达比较(±s)

表3 各组小鼠肿瘤组织Bax、Bcl-2、c-met、PD-L1、IFN-γ、miR-206 mRNA表达比较(±s)
组别BaxBcl-2c-met模型组938.68±50.389 167.03±89.6910 286.57±444.80空微泡组3 820.36±266.24*5 392.26±178.99*7 174.44±585.30*miR-206微泡组8 335.26±777.67*#3 272.93±130.43*#3 717.32±396.19*#sPD-1微泡组4 563.38±324.67*▲▲1 332.39±58.00*#▲▲9 892.57±386.27#▲▲联合组14 083.47±838.75*#▲▲△674.27±67.33*#▲▲△5 206.62±488.55*#▲△F值258.782 731.44113.56 P值<0.01<0.01<0.01组别PD-L1IFN-γmiR-206模型组13 490.73±183.301 550.75±191.321.00±0.00空微泡组12 708.96±225.50*1 573.78±60.351.50±0.14*miR-206微泡组10 457.00±207.86*#2 323.35±246.68*4.67±1.07*#sPD-1微泡组4 826.28±189.45*#▲▲10 437.68±747.27*#▲▲2.31±0.37*▲▲联合组7 754.46±250.97*#▲▲△9 906.28±755.24*#▲▲2.62±0.23*▲▲F值851.30257.0822.37P值<0.01<0.01<0.01
注:*:与模型组比较,P<0.01;#:与空微泡组比较,P<0.01;▲:与miR-206微泡组比较,P<0.05;▲▲:与miR206微泡组比较,P<0.01;△:与sPD-1微泡组比较,P<0.01
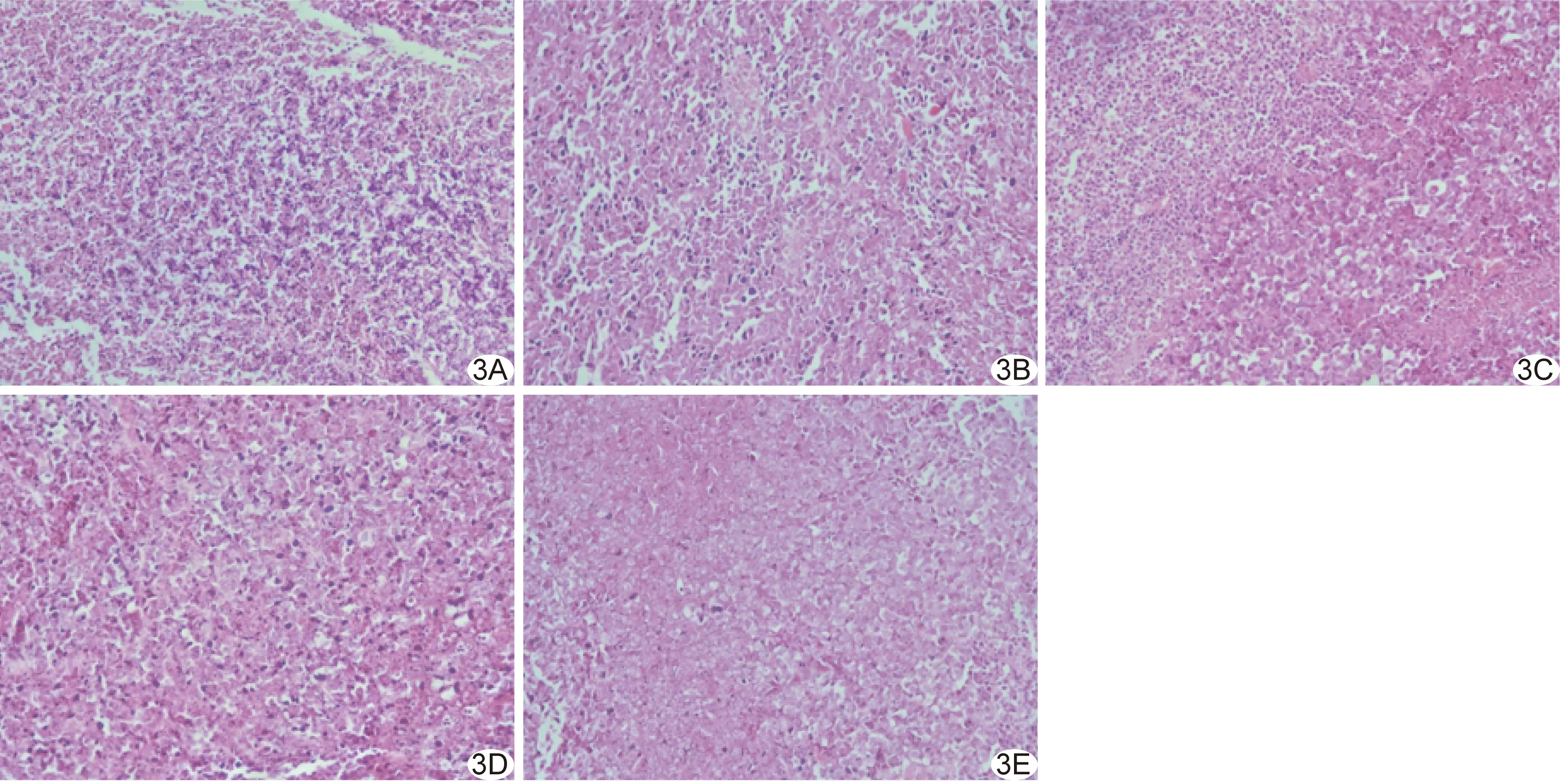
图3各组小鼠肿瘤组织病理图(HE,×200) A.模型组; B.空微泡组; C.miR-206微泡组; D.sPD-1微泡组; E.联合组
miRNA可作为抑癌基因或致癌基因,调控恶性肿瘤细胞的增殖、侵袭、迁移和凋亡。miR-206是miR-1家族成员,可靶向下调c-met、PD-L1等癌基因。肝癌组织中miR-206表达减少,与肿瘤形成、转移及预后相关[13]。促进miR-206表达可阻滞肿瘤细胞周期而促凋亡,抑制细胞增殖、分化和迁移。本课题组曾以miR-206治疗宫颈癌小鼠移植瘤,使miR-206靶向调控的c-met表达下调[14]。本研究结果显示,与模型组比较,miR-206微泡组和联合组中miR-206表达增加,PD-L1和c-met表达下调。Liu等[15]釆用脂质体将miR-206转染至肝癌HepG2细胞,结果显示miR-206抑制细胞增殖并促进凋亡;本研究进一步在动物实验层面验证了miR-206对肝癌的抑制作用。
miR-206可靶向抑制PD-L1,miR-206与sPD-1联合可更有效阻断PD-1/PD-L1信号通路,进一步促进机体抗肿瘤免疫。miR-206还可通过靶向c-met癌基因,促进肝癌细胞凋亡。本研究联合组相对单独治疗组表现出更好的抗肿瘤作用。Bcl-2和Bax调控HCC的内源性凋亡通路。Bcl-2是通过改变线粒体通透性而抑制细胞凋亡的抗凋亡蛋白,而Bax高表达可拮抗Bcl-2的上述作用[16]。本研究从基因和蛋白水平均证实了各治疗组肿瘤组织中Bax高表达,Bcl-2低表达,联合组更加明显。
综上所述,本课题组成功构建了载sPD-1和miR-206纳米阳离子脂质微泡,超声介导sPD-1联合miR-206纳米微泡通过调节多种凋亡基因和蛋白表达,协同抑制小鼠H22肝癌皮下移植瘤生长。
——一道江苏高考题的奥秘解读和拓展

