miR-338-3p和MACC1基因在卵巢上皮性癌(EOC)组织中的表达及其意义
张瑞涛 史惠蓉 任 芳 刘哲颖 姬鹏程 张微微 王文文
(郑州大学第一附属医院妇科 郑州 450052)
微RNA(microRNAs,miRNAs)的突变和异常表达与各种人体肿瘤的发生发展相关,miRNAs能调控多种肿瘤相关基因的表达,可作为癌基因或抑癌基因而发挥作用[1]。在胃癌、结肠癌、甲状腺癌等肿瘤组织中miR-338-3p的表达水平明显低于正常组织,miR-338-3p可能作为抑癌基因参与肿瘤侵袭和转移[2-7]。MET转录调剂因子MACC1在结肠癌、胃癌、肺癌和肝细胞癌等多种恶性肿瘤组织中表达异常,与肿瘤的侵袭和转移关系密切,在晚期患者的肿瘤组织中表达明显升高,可作为评价患者预后和转归的肿瘤标志物[8-11]。
研究表明,在胃癌、肝癌、宫颈癌等恶性肿瘤组织中miR-338-3p可靶向调控MACC1基因,进而参与肿瘤的侵袭和转移[12-14]。目前miR-338-3p在卵巢上皮性癌(epithelial ovarian cancer,EOC)组织中的表达情况及其与MACC1基因的相互关系尚不清楚。本研究采用实时荧光定量PCR技术检测miR-338-3p和MACC1基因在正常卵巢组织、良性卵巢肿瘤及EOC中的表达情况,初步分析二者表达的相关性及其与卵巢癌临床病理参数之间的关系,探讨其临床意义及其在卵巢癌发生发展中的作用。
资料和方法
组织标本和临床资料收集郑州大学第一附属医院妇科2012年10月至2015年10月间入组且随访资料完善的EOC患者105例,所有入组患者均因妇科疾病首次就诊和接受治疗,术前均无其他药物和放射治疗史,未合并其他器官或系统严重疾病或恶性肿瘤。不符合上述标准和妊娠的患者均予以排除。105例入组患者均留取手术新鲜卵巢组织标本,其中正常卵巢组织20例(标本来自因多发子宫肌瘤,或单侧卵巢肿瘤且对侧卵巢无受累,而接受子宫+双附件切除术或单纯双附件切除术的患者),良性卵巢上皮性肿瘤组织20例(标本来自因良性卵巢肿瘤行卵巢囊肿剥除术或卵巢切除术的患者,其中浆液性囊腺瘤16例,黏液性囊腺瘤4例),初诊EOC患者原发病灶组织65例。
65例EOC患者年龄28~76岁,中位年龄50岁。早期患者(Ⅰ~Ⅱ期)行全面分期手术,晚期患者(Ⅲ~Ⅳ期)行肿瘤细胞减灭术(残余病灶<1 cm)。临床分期(FIGO2014):Ⅰ期8例,Ⅱ期4例,Ⅲ期48例,Ⅳ期5例(其中腹壁肌层转移灶2例,腹膜后非淋巴结转移灶3例)。组织学分级:高级别38例,低级别27例。组织学类型:浆液性癌52例,黏液性癌13例。腹膜后淋巴结清扫均达到肠系膜下动脉水平,有淋巴结转移者32例(其中仅盆腔淋巴结转移者26例,仅腹主动脉旁淋巴结转移者1例,两处淋巴结均转移者5例),无淋巴结转移者33例。
本研究所有组织标本的收集和用途均获得患者或家属知情同意,并经郑州大学第一附属医院伦理委员会批准。3组患者(正常、良性、癌)的年龄、BMI等一般资料差异无统计学意义。EOC患者术后依据临床分期均接受规范化疗(多西他赛联合顺铂或卡铂)3~6个疗程,耐药或复发患者采用二线化疗药物单药或联合化疗(包含多西他赛、吉西他滨、依托泊苷、脂质体阿霉素、奥沙利铂等)。
主要试剂Trizol(美国Invitrogen公司),TaqMan MicroRNA逆转录试剂盒(美国Applied Biosystems公司),RevertAid first strand cDNA合成试剂盒(加拿大Fermentas公司),SYBR Green荧光定量PCR试剂盒(日本Takara公司)。
Real-time PCR检测Trizol提取组织总RNA,纯化后以分光光度计定量,取2 μg总RNA参照TaqMan microRNA逆转录试剂盒说明书逆转录合成cDNA模板,用于miR-338-3p表达的检测,以U6作为内参。另取2 μg总RNA参照RevertAid first strand cDNA合成试剂盒说明书逆转录合成cDNA模板,用于MACC1基因表达的检测,以β-actin作为内参。逆转录产物参照SYBR Green荧光定量PCR试剂盒说明书,采用Applied Biosystems 7500 Fast Real-Time PCR System(美国Thermo Fisher Scientific公司)进行PCR反应,PCR所用引物由上海生物工程有限公司合成,引物序列见表1,PCR反应条件为:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,共40循环。每次PCR实验重复3次,相对表达量用2-ΔΔCt表示。

表1 RT-PCR引物序列Tab 1 Primer sequences for RT-PCR
F:Forward;R:Reverse.

结 果
不同卵巢组织中miR-338-3p和MACC1基因的表达在正常卵巢组织、良性卵巢肿瘤组织和EOC组织中miR-338-3p的相对表达量分别为0.821±0.008、0.781±0.013和0.331±0.038,MACC1基因的相对表达量分别为0.059±0.011、0.315±0.034和0.774±0.025。与正常卵巢组织和良性卵巢肿瘤组织相比(图1),EOC组织中miR-338-3p表达水平明显下调(F=77.916,P<0.001),MACC1基因表达水平明显上调(F=77.945,P<0.001)。
不同性质卵巢组织中miR-338-3p和MACC1基因表达的相关性首先以TargetScan Human 7.1在线数据库为基础,查询miRNA-靶基因调节关系,进而利用starBase V2.0 数据库交互查询5个权威miRNA靶标预测数据库(TargetScan、picTar、RNA22、PITA和miRanda)中miRNA-靶基因调节关系的交集,显示MACC1基因是miR-338-3p下游的靶向调节基因之一。本研究的105例不同性质卵巢组织经Spearman相关性分析显示,miR-338-3p和MACC1的表达水平呈明显负相关(r=-0.968,P<0.001,图2)。
EOC组织中miR-338-3p和MACC1基因表达与临床病理参数的关系65例EOC组织中miR-338-3p和MACC1的中位相对表达水平分别为0.320±0.014和0.782±0.033,据此划分为相对高表达(≥中位表达量)和相对低表达(<中位表达量)。分组统计显示,临床分期越晚、组织级别越高、有淋巴结转移的EOC组织中miR-338-3p表达越低而MACC1表达越高(表2)。
Log-rank和Cox回归分析Log-rank单因素分析miR-338-3p表达、MACC1表达、年龄、临床分期、组织分化、组织类型、腹水、淋巴结转移等参数与65例EOC患者复发和死亡的关系,结果显示miR-338-3p低表达(P=0.038,HR=4.139,95%CI:1.271~8.078)、临床分期较晚(P=0.022,HR=2.346,95%CI:1.014~10.329)和淋巴结转移(P=0.007,HR=5.032,95%CI:2.003~11.371)与EOC患者复发相关;miR-338-3p低表达(P=0.008,HR=3.007,95%CI:1.217~7.431)、临床分期较晚(P=0.012,HR=3.678,95%CI:1.204~11.240)、组织分化高级别(P=0.029,HR=4.304,95%CI:1.742~10.630)和淋巴结有转移(P=0.003,HR=4.432,95%CI:1.797~10.930)与EOC患者死亡相关。Cox多因素回归分析显示,上述因素均非EOC患者复发和死亡的独立影响因素。
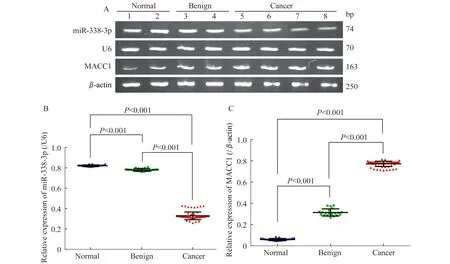
A:Real-time PCR;B and C:Relative expression.Normal:Normal ovarian;Benign:Benign epithelial ovarian tumor;Cancer:EOC.
图1 不同卵巢组织中miR-338-3p和MACC1基因的表达
Fig 1 Expression of miR-338-3p andMACC1 gene in different ovarian tissues

表2 EOC组织中miR-338-3p和MACC1基因表达与临床病理参数之间的关系Tab 2 The relationships between miR-338-3p and MACC1 gene expressions in EOC tissues and clinicopathological parameters of EOC [n (%)]
MACC1:High≥0.782±0.033;miR-338-3p:High≥0.320±0.014.(1)Fisher exact probability method.
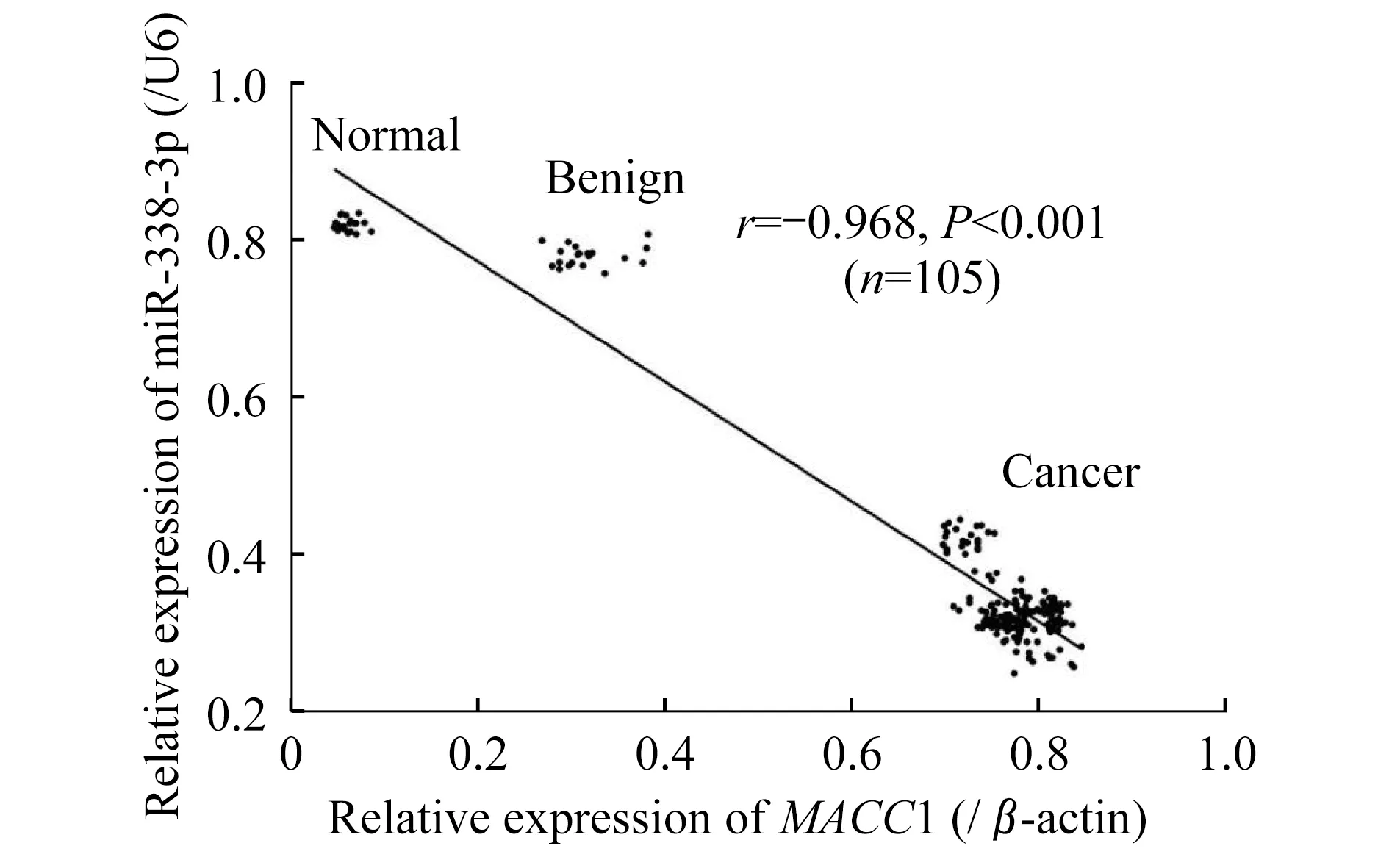
图2 不同卵巢组织中miR-338-3p和MACC1基因表达的相关性Fig 2 The correlation between miR-338-3p and MACC1 gene expression in different ovarian tissues
Kaplan-Meier生存分析截至2018年2月底随访结束时,入组患者随访时间为16~61个月,中位随访时间38个月,46人存活,19人死亡(表3)。在65例EOC患者中,miR-338-3p低表达同时MACC1高表达患者的总体生存率和无进展生存率均显著低于其他类型患者(χ2=16.960,P=0.001;χ2=18.930,P=0.000)(图3)。
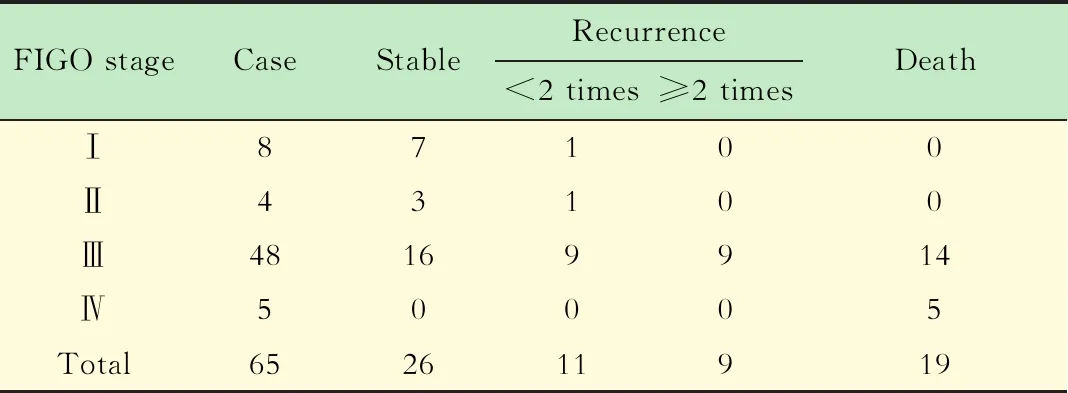
表3 随访结束时65例EOC患者情况Tab 3 The status of 65 EOC patients at the end of follow-up (n)
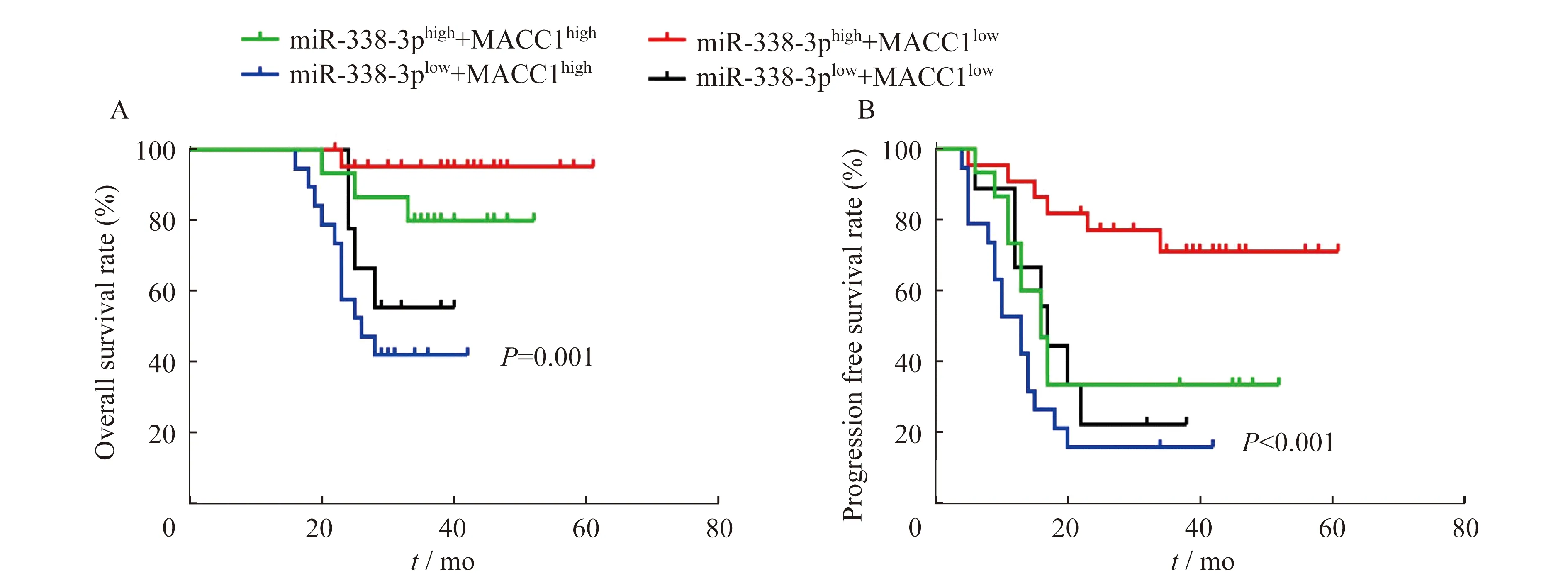
A:Overall survival rate;B:Progression free survival rate.
图3 EOC组织中miR-338-3p和MACC1表达与患者生存率的关系
Fig 3 Relationships between miR-338-3p and MACC1 expression in EOC tissues and survival rate of EOC patients
讨 论
卵巢癌是威胁女性生殖健康的主要疾病之一,大部分患者发现时临床分期较晚,盆腹腔存在癌灶广泛侵犯和转移是患者预后较差的重要原因之一。研究卵巢癌侵袭和转移的分子机制,是卵巢癌基础和临床研究中的严峻课题。miRNAs是一种高度保守的内源性非编码小RNA。人类基因组中有千余种miRNA,这些miRNA调控约1/3蛋白质编码基因的表达,是最大的一类基因表达调控因子,在多种生理和病理过程中发挥重要作用[15]。miRNAs还与上皮-间质转化(epithelial-mesenchymal transition,EMT)、血管生成、肿瘤细胞微环境等恶性肿瘤侵袭和转移相关过程关系密切,参与包括卵巢癌在内的多种恶性肿瘤的侵袭和转移,可作为恶性肿瘤治疗的潜在靶点[16-18]。
研究显示,miR-338-3p在胃癌、结肠癌、甲状腺癌等恶性肿瘤组织中的表达水平明显低于正常组织,可能作为抑癌基因参与上述恶性肿瘤的侵袭和转移[2-7]。MACC1与多种恶性肿瘤的侵袭和转移密切相关,本课题组前期采用免疫组织化学法、RT-PCR法和Western blot法研究显示,EOC组织中存在MACC1 mRNA和蛋白质异常高表达,临床分期越晚、组织分化越差、伴随淋巴结转移的癌组织中MACC1 mRNA和蛋白质表达越高,MACC1表达增加可能提示EOC患者预后不良,MACC1可作为晚期EOC预后监测的标志物[19-21]。本研究采用RT-PCR技术检测正常卵巢组织、良性上皮性卵巢肿瘤和EOC组织中miR-338-3p和MACC1基因的表达情况,结果显示与正常卵巢组织和良性上皮性卵巢肿瘤相比,EOC组织中miR-338-3p表达明显降低且MACC1基因表达明显增高,提示二者异常表达可能参与卵巢癌的发生和发展。
miRNAs主要通过靶向调控下游相关基因的表达或信号通路的活性,进而参与各种生理和病理过程。在恶性肿瘤的发生发展过程中,多数miRNAs参与调控癌基因或抑癌基因,甚至同一个miRNA在不同的癌组织中表现出相反的调控作用[22]。研究表明,胃癌、肝癌、宫颈癌等恶性肿瘤组织中存在miR-338-3p低表达和MACC1基因高表达,miR-338-3p可靶向调控MACC1基因,进而参与恶性肿瘤的侵袭和转移[12-14]。本研究中,经miRNA调节靶基因在线开放数据库检索显示,MACC1基因是miR-338-3p的下游调节靶基因之一。目前尚无卵巢癌组织中miR-338-3p靶向调控MACC1基因的相关报道。本研究进一步分析表明,不同性质卵巢组织中miR-338-3p和MACC1的表达呈明显负相关,临床分期越晚、组织级别越高、伴淋巴结转移的EOC组织中miR-338-3p表达越低且MACC1表达越高,miR-338-3p低表达与EOC患者的复发和死亡相关,miR-338-3p低表达同时MACC1高表达患者的总体生存率和无进展生存率显著降低。上述结果提示miR-338-3p低表达和MACC1高表达可能与EOC患者预后不良相关,结合既往相关报道推测可能是miR-338-3p靶向调控MACC1的表达,进而共同参与卵巢癌的进展和复发,二者有作为卵巢癌预后不良标志物的潜在价值。
综上所述,本研究结果显示EOC组织中存在miR-338-3p和MACC1异常表达,且与患者的预后不良相关,二者可能共同参与EOC进展和复发。在此基础上进一步研究卵巢癌细胞中miR-338-3p靶向调控MACC1基因的分子机制,进一步阐明卵巢癌侵袭和转移的分子机制,可为临床探寻新的卵巢癌治疗的分子靶点,从而为卵巢癌的精准治疗提供新的方向。

