对比芬太尼试验与简明儿童OSAS量表识别重度阻塞性睡眠呼吸暂停综合征(OSAS)的价值
吴 茹 王 炫
(复旦大学附属儿科医院麻醉科 上海 201102)
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是儿童常见疾病,发病率为1%~4%[1],目前主要的治疗方式是扁桃体伴腺样体切除术。重度OSAS患儿术后阿片类药物相关性呼吸道不良事件的发生率高达29.6%,是轻度OSAS 患儿的10倍左右[2]。2014年美国麻醉医师学会建议将这类患者的阿片类药物剂量减少一半[3]。但目前缺乏简单可靠的方法识别出重度OSAS儿童。多导睡眠监测(polysomnography,PSG)是诊断OSAS的金标准,但昂贵、费时、复杂,所以仅低于10%[4]的儿童使用PSG确诊过OSAS。夜间血氧测定法较PSG方便,但仍需要彻夜监测。根据病史或者扁桃体腺样体大小判断 OSAS的轻重程度也不可靠[5]。
Gozal 等[6]发明了只有6个问题的简明儿童OSAS量表(简称量表),随后张静等[7]在中国儿童中应用此量表并证实其对筛查儿童中重度OSAS具有较好的信度和效度。根据重度OSAS患儿对阿片类药物敏感性增加[8]的理论,我们设计出芬太尼试验,即观察患儿在自主呼吸下静脉注射1 μg/kg芬太尼前后呼吸频率的变化,呼吸频率下降>50%,定义为阳性(敏感);反之为阴性(不敏感)。通过前瞻性观察性研究,证明芬太尼试验阳性患儿术后吗啡需要量少,阴性患儿术后吗啡需要量多[9]。因此假设:芬太尼试验可以识别出OSAS。
本研究于术前实施芬太尼试验,阳性患儿认为是重度OSAS,阴性患儿认为是非重度OSAS,评价其判断OSAS严重程度的价值,并与OSAS量表进行对比,以寻找一种简单可靠的方法识别出重度OSAS患儿,从而指导术中、术后给予镇痛药,提高围术期安全性。
资料和方法
研究对象前瞻性选取我院2018年6—11月择期行扁桃体伴腺样体切除术的连续病例。纳入标准:(1)父母知情同意;(2)美国麻醉医师学会(ASA)分级 Ⅰ~Ⅱ 级;(3)年龄≥3岁;(4)术前接受过PSG诊断。排除标准:(1)颅面部畸形;(2)术前服用过其他镇痛药物;(3)合并其他神经肌肉疾病或遗传性疾病;(4)精神发育迟缓;(5)BMI>30 kg/m2。
伦理本研究获得复旦大学附属儿科医院伦理委员会批准(批准号:2018156),并在ClinicalTrials.gov上注册(注册号:NCT03705780),芬太尼试验以及量表的实施获得患儿监护人知情同意。
研究方法根据纳入以及排除标准选择研究对象,由一位专门负责数据的医师记录所有患儿的PSG诊断结果。由另一位预先未知PSG诊断结果的医师于术前访视时指导患儿家长根据孩子近6个月的睡眠情况填写量表。计算量表得分,记录量表诊断的结果。患儿进入手术室后,由第3位未知PSG以及量表结果的麻醉医师实施麻醉:常规监测心率、血压、脉搏血氧饱和度。七氟烷8%,氧气6 L/min,预充回路。将面罩置于患儿口鼻并密闭之,嘱咐其用力吸气并屏气。患儿睫毛反射消失后开始置入口咽通气道,成功置入后调节呼气末七氟烷浓度至3.0%。呼吸频率稳定后(30 s内呼吸频率变化±1次),记录此时的呼吸频率RR1,并静脉注射1 μg/kg 芬太尼,射时间10~30 s后观察3 min,记录3 min之内呼吸频率的最低值RR2。分析并记录芬太尼试验诊断的结果。分别将量表与芬太尼试验诊断结果与PSG诊断结果对比,计算量表及芬太尼试验的灵敏度、特异度、阳性预测值、阴性预测值以及准确度,并绘制两种方法诊断重度OSAS的ROC曲线,计算AUC,比较量表与芬太尼试验诊断重度OSAS的差异。
诊断标准
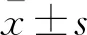
OSAS诊断标准 根据PSG报告中的阻塞性呼吸暂停低通气指数(apnea hypopnea index,AHI)将患儿分为重度OSAS(AHI>10)与非重度OSAS(AHI≤10),非重度OSAS患儿包括非OSAS患儿(AHI<1);轻度OSAS(1≤AHI≤5);中度OSAS(5 芬太尼试验诊断标准 静脉注射1 μg/kg芬太尼后呼吸频率下降:>50%者诊断为重度OSAS,≤50%者为非重度OSAS。 量表诊断标准 量表得分≥2.32分为重度OSAS,<2.32分为非重度OSAS(表1)。 表1 简明儿童OSAS量表Tab 1 The short pediatric OSAS scale Q1-Q4,Q6 are scored as:0,never;1,rarely (1 time/wk);2:occasionally (2 times/wk);3,frequently (3-4 times/wk);4,almost always(>4 times/wk).Q5 is scored as:0,mildly quiet;1,medium loud;2,loud;3,very loud;4,extremely loud.The scoring is the cumulative average score of all six questions,according to the following formula:A=(Q1+Q2)/2;B=(A+Q3)/2;C=(B+Q4)/2;D=(C+Q5)/2;and the score on the Severity Hierarchy of Complaints=(D+Q6)/2. 一般情况共102名患儿符合纳入排除标准并最终完成研究。经PSG诊断为重度OSAS 46 例(45.1%),非重度56例(54.9%),其中中度OSAS 22例(39.3%),轻度23 例(41.1%),非OSAS 11 例(19.6%)。重度与非重度患儿在性别、年龄、体重以及身高等方面差异无统计学意义(表2)。 表2 患儿的一般情况Tab 2 Demographics of pediatric patients OSAS量表及芬太尼试验诊断结果与PSG诊断结果的比较量表诊断出重度OSAS 32例,非重度OSAS 43例(表3);芬太尼试验诊断出重度OSAS 40例,非重度OSAS 49例(表4)。 表3 OSAS量表诊断结果与PSG诊断结果的比较Tab 3 Comparison of diagnostic results of the short pediatric OSAS scale and PSG (n) 表4 芬太尼试验诊断结果与PSG诊断结果的比较Tab 4 Comparison of diagnostic results of fentanyl test and PSG (n) OSAS量表与芬太尼试验诊断价值的比较量表诊断重度OSAS的灵敏度、特异度、阳性预测值、阴性预测值以及准确度均低于芬太尼试验,差异均有统计学意义(P<0.05,表 5)。 表5 OSAS量表与芬太尼试验的诊断价值对比Tab 5 Comparison of diagnostic value of the short pediatric OSAS scale and fentanyl test 两种诊断方式ROC曲线分析量表诊断重度OSAS的AUC为 0.788(95% CI:0.696~0.863),芬太尼试验诊断重度OSAS的AUC为0.908(95%CI:0.835~0.957),两组比较,差异有统计学意义(P=0.020,图 1)。 图1 OSAS量表与芬太尼试验诊断重度OSAS的ROC曲线 本研究通过比较芬太尼试验与量表识别重度OSAS的能力发现,芬太尼试验诊断出重度OSAS的灵敏度为87.0%,特异度为87.5%,量表诊断重度OSAS的灵敏度为69.6%,特异度为76.8%。与量表相比,芬太尼试验诊断出重度OSAS具有较高的灵敏度与特异度。这一发现提示我们,对于扁桃体伴腺样体切除术的患儿而言,芬太尼试验可以作为一种简单可靠的方法识别出重度OSAS患儿,为这类患儿术后吗啡需要量提供参考依据,提高重度OSAS患儿术后镇痛的安全性。 重度OSAS 患儿常常伴随睡眠期反复严重的低氧血症,引起体内阿片受体的上调,导致其对阿片类药物敏感性增加[10]。芬太尼是一种常见的短效阿片类药物,对阿片类药物越敏感的人在注射芬太尼以后呼吸频率下降越显著[11]。本课题组根据以上理论首次提出,通过芬太尼试验观察患者呼吸频率的下降程度,判断其对阿片类药物的敏感程度,从而间接判断OSAS的轻重。Brown等[8]根据OSAS的轻重对22名OSAS儿童进行分组,比较两组患儿术后达到相同疼痛状态时的吗啡需要量,发现OSAS重症组的术后吗啡用量只有轻症组的一半。Li等[9]对80名择期行扁桃体伴腺样体切除术的儿童进行芬太尼试验,观察这些患者进入麻醉苏醒室后,疼痛评分≤6分时的吗啡需要量。该研究发现芬太尼试验阳性患者术后吗啡需要量比阴性者少。以上这些研究结果从另一方面支持芬太尼试验阳性患儿是重度OSAS的推测。本研究通过诊断试验的方法分析得出芬太尼试验具有较高的阳性预测值,验证了芬太尼试验阳性的儿童可能是重度OSAS儿童的推测。 由于PSG临床使用受限,越来越多的研究者致力于寻找出术前评估OSAS严重程度的替代办法。Brouillette等[12]利用血氧饱和度测定法(麦吉尔评分法)诊断 OSAS 的阳性预测值为 97%,但阴性预测值仅为47%。筛查问卷是一种常用工具,可用于评估儿科睡眠质量,但是大部分问卷没有经过验证和标准化[13]。本研究选择的问卷最初由Gozal等设计出,只有6个问题,完成问卷不到5 min,相对简便,且在1 133名社区儿童中证实,量表诊断OSAS的灵敏度为59.03%,特异度为82.85%,阳性预测值为35.4%,阴性预测值为72.7%[6]。随后Kadmon等[14]以及Pires等[15]分别在加拿大睡眠门诊以及巴西睡眠实验室的儿童中验证了该量表的有效性,量表得分与AHI之间具有较好的一致性。2015年,张静等[7]在中国儿童中验证了该量表具有较好的内部一致性与结构效度(克朗巴赫α系数为0.785,各因子包含的问题项的载荷系数均>0.5),可用于筛查儿童中重度OSAS。但是所有问卷存在措辞简单、容易受到主观情感影响等固有问题,从而出现过度报道或少报道的现象,这可能就是其诊断能力不高的原因。Gozal等[16]对60名经PSG证实的OSAS儿童、30名原发性打鼾以及30名健康儿童的清晨尿蛋白进行评估,发现尿调节素、尿皮质素-3、血清类黏蛋白-1和激肽释放酶对OSAS具有有利的预测价值。并且联合这4种中的3种或3种以上蛋白质具有95%的灵敏度和100%的特异度预测OSAS。该研究并没有表明尿液蛋白质组学分析在识别重度OSAS方面的价值。这种方法作为筛查OSAS的工具可能是未来的研究方向,但是就目前而言几乎没有临床价值。与上述方法相比,芬太尼试验诊断效能较高,且经济简便。 儿童对阿片类药物的敏感性除了受OSAS严重程度的影响外,还受个体差异的影响。如果个人本身对阿片类药物敏感,即使不是重度OSAS,在注射1 μg/kg芬太尼后呼吸频率也可能下降超过50%,甚至呼吸停止,出现假阳性结果。目前的观点认为基因多态性是影响阿片类药物敏感性个体间差异的关键因素[17],针对这一原因导致的假阳性目前在临床上尚无可靠的解决办法。这是芬太尼试验的一大局限。但是不论是重度OSAS还是其他难以排除因素导致的儿童在注射1 μg/kg芬太尼后呼吸频率下降超过50%甚至呼吸停止,可以肯定的是这类儿童对阿片类药物敏感性高,这一点对于提高术后镇痛安全性依然十分有利。 本研究的局限性:(1)芬太尼试验只能用于手术患儿,识别出重度OSAS,对于将OSAS从普通人群中筛查出来以及对OSAS轻重程度进行分层的作用有限。但是临床工作中,往往是严重的OSAS儿童围术期不良事件发生率高,需要投入大量的医疗资源进行管理。(2)排除了3岁以下以及合并其他疾病(如神经肌肉疾病、唐氏综合征)的儿童,这类儿童本身就对阿片类药物比较敏感,会影响芬太尼试验的诊断价值。(3)这是一项小样本单中心研究,研究结果应在更多儿科患者群体中去验证。 综上所述,对于扁桃体伴腺样体切除术儿童,芬太尼试验对于诊断出重度OSAS具有较好的价值,可作为一种简便实用的方法指导围术期阿片类药物的使用。
结 果
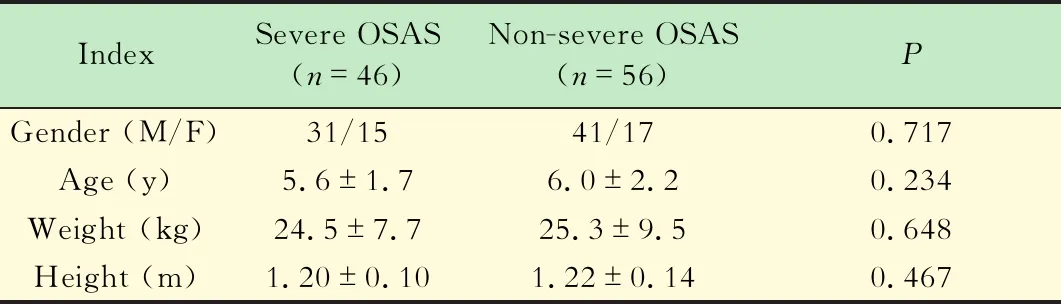
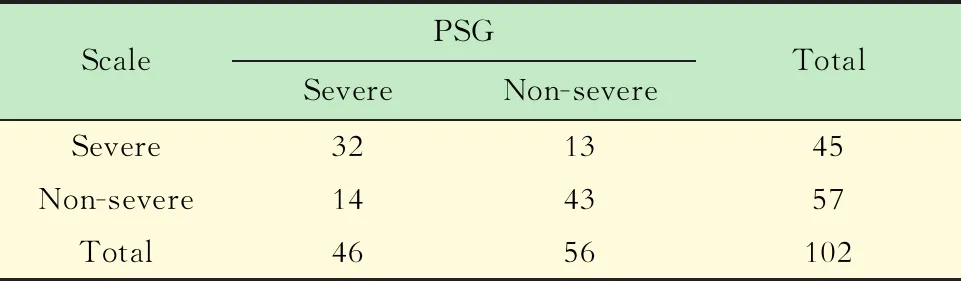


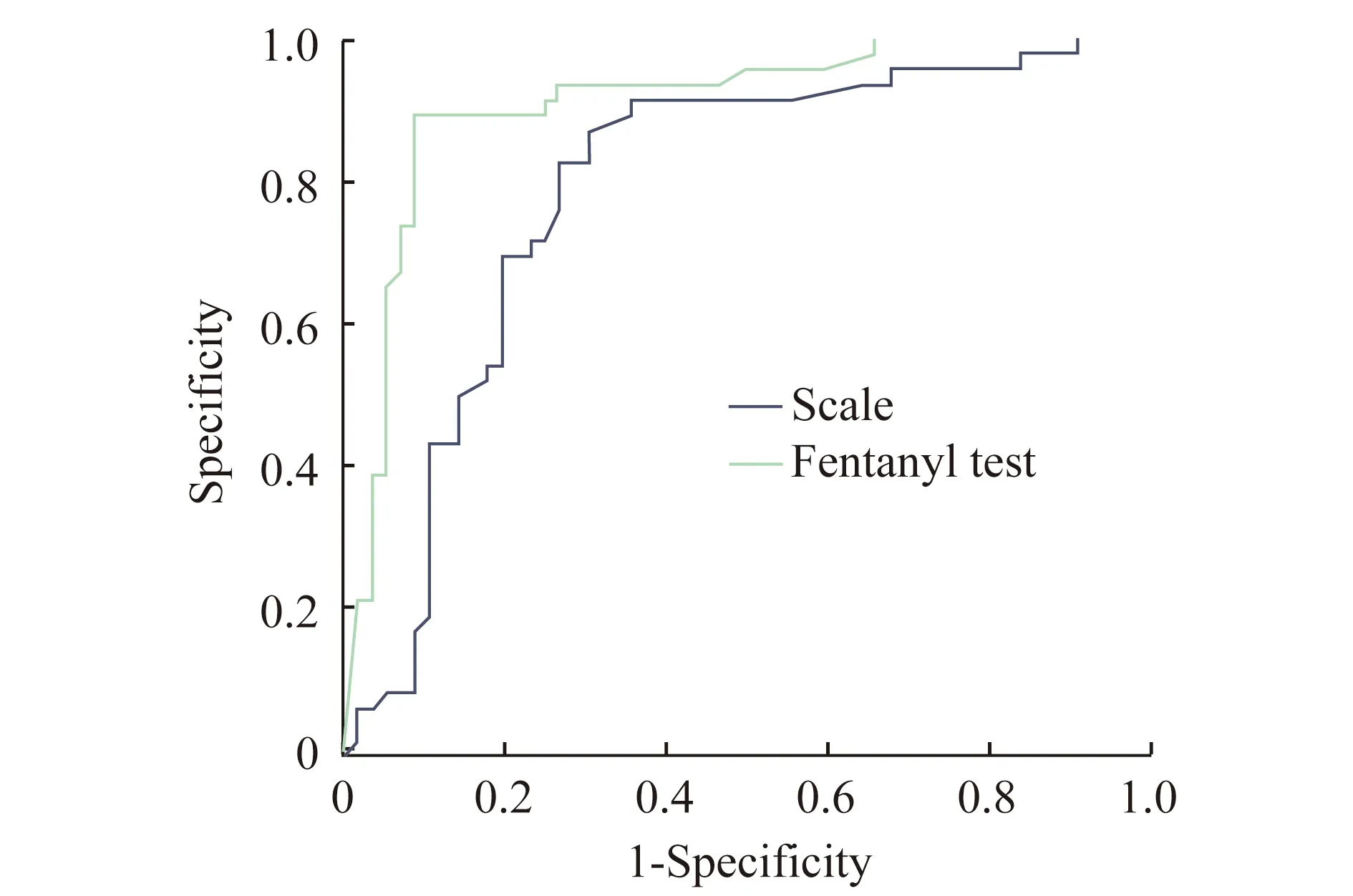
Fig 1 ROC curve for scale and fentanyl test indiagnosing severe OSAS讨 论

