超高效液相色谱-四极杆/静电场轨道阱高分辨质谱对粮谷产品中20种真菌毒素的快速筛查和确证
胡巧茹, 曹 鹏, 丛中笑, 梁君妮, 沙美兰, 李晓玉, 尹大路, 鲁 闽
(烟台海关技术中心, 山东 烟台 264000)
真菌毒素(mycotoxins)也叫霉菌毒素,是产毒真菌在适宜环境条件下的次级代谢产物,具有生物毒性。截至目前已分离得到100多种真菌,可产生大约300种有毒的次级代谢产物[1]。农产品中常见的真菌毒素有黄曲霉毒素(aflatoxin)、赭曲霉毒素(ochratoxin)、玉米赤霉烯酮(zearalenone)、伏马毒素(fumonisin)、杂色曲霉素(sterigmatocystin)、单端孢霉烯族毒素(trichothecenes)以及橘青霉素(citrinin)等。粮谷类农作物在种植过程中和贮藏期间容易受到真菌的侵染,导致真菌毒素污染情况普遍存在[2]。由于近年来受全球气候变暖、干旱等因素的影响,世界各国真菌毒素暴露事件屡见不鲜,特别是粮谷产品中多种真菌毒素混合污染现象频频发生[3-6],真菌毒素多残留检测受到越来越多的关注和重视。
目前,真菌毒素采用的检测方法主要是酶联免疫法(ELISA)[7]、薄层层析色谱法(TIC)[8]、气相色谱法(GC)[9]、气相色谱串联质谱法(GC-MS)[10]、液相色谱法(HPLC)[11,12]、液相色谱串联质谱法(HPLC-MS/MS)[13-17]等。其中ELISA法具有特异性强、灵敏度高、前处理简单、无需昂贵仪器、易于推广等优点,该方法存在一定的假阳性,只能作为一种筛选法[7]。TIC法在确证新发现真菌毒素和检测方法学研究方面,具有一定的优越性,但此法精确度低、操作过程复杂,在检测领域的应用受到限制,通常只能做定性试验以及粗略的定量试验[8]。GC和GC-MS技术常用于分析热稳定、易挥发性的化合物,但大多数真菌毒素对热不稳定,主要用来检测单端孢霉烯族化合物[9,10],分析种类有限。HPLC采用紫外或荧光检测器可用于大多数真菌毒素的分析,具有稳定可靠、灵敏度高等特点,是近年来真菌毒素检测的主流方法,但该方法通常需要结合免疫亲和柱净化[11,12],检测费用高,检测目标单一。HPLC-MS/MS具有灵敏度高、适合多组分同时分析等特点,在真菌毒素检测方面的应用研究较多[13-17],但HPLC-MS/MS为低分辨质谱,难以完全阐明化合物的结构裂解信息,可能产生假阳性现象,在处理复杂基质样品中多种目标筛查物时,具有一定的局限性。近年来,高分辨质谱(HRMS)发展迅速,在此基础上建立的液相色谱-高分辨质谱联用的分析技术在痕量多组分检测方面得到越来越多的重视和应用[18-20],它能够在超高分辨率下测定化合物及其碎片离子的精确分子质量,具有较强的抗干扰能力,适用于高通量筛查及目标化合物的确证分析。
本研究运用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱仪测定粮谷产品中20种真菌毒素。样品经乙腈(含2%(体积分数,下同)甲酸)提取、Captiva EMR-Lipid小柱净化,在正、负离子同扫模式下,以甲醇-乙腈(1∶1, v/v)作为有机相、5 mmol/L甲酸铵水溶液作为水相,进行梯度洗脱,采用Thermo Hypersil Gold C18柱(100 mm×2.1 mm, 1.9 μm)分离,以高分辨质谱(Q-Exactive)的一级质谱全扫描加数据依赖的二级质谱扫描方式(Full MS/dd MS2)进行筛查和确证。该方法准确高效,重现性好,可实现对粮谷产品中20种真菌毒素的快速筛查分析,满足大通量检测要求。
1 实验部分
1.1 仪器、试剂与材料
四极杆/静电场轨道阱高分辨质谱仪Q-Exactive、UltiMate 3000高效液相色谱仪,Thermo Hypersil Gold C18柱(100 mm×2.1 mm, 1.9 μm)(美国Thermo Fisher Scientific公司); Captiva EMR-Lipid净化柱(3 mL,美国Agilent公司); 3K15离心机(德国Sigma公司);DL-5C低速大容量离心机(上海安亭科学仪器厂); OA-SYS氮吹仪(美国Organomation公司); Milli-Q超纯水纯化系统(美国Millipore公司);涡旋混合器(德国IKA公司)。
黄曲霉毒素B1标准品溶液(aflatoxin-B1,质量浓度为2.0 mg/L)、黄曲霉毒素B2标准品溶液(aflatoxin-B2,质量浓度为0.5 mg/L)、黄曲霉毒素G1标准品溶液(aflatoxin-G1,质量浓度为2.0 mg/L)、黄曲霉毒素G2标准品溶液(aflatoxin-G2,质量浓度为0.5 mg/L)购自美国Trilogy公司;黄曲霉毒素M1(aflatoxin M1,纯度为99.8%)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,纯度为99.6%)、3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyl deoxynivalenol,纯度为99.0%)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyl deoxynivalenol,纯度为99.0%)、赭曲霉毒素A(ochratoxin-A,纯度为99.9%)、黄曲霉毒素M2(aflatoxin M2,纯度为99.0%)、玉米赤霉烯酮(zearalenone,纯度为99.0%)、黄绿青霉素(citreoviridin,纯度为98.0%)、蛇形菌素(diacetoxyscirpenol,纯度为98.0%)、伏马毒素B1标准品溶液(fumonisin B1,质量浓度为99.7 mg/L)、伏马毒素B2标准品溶液(fumonisin B2,质量浓度为100 mg/L)、伏马毒素B3标准品溶液(fumonisin B3,质量浓度为100 mg/L)、HT-2毒素(HT-2 toxin,纯度为99.0%)、T-2毒素(T-2 toxin,纯度为98.0%)、杂色曲霉素(sterigmatocystin,纯度为99.2%)均购自美国Achemtek公司,桔青霉素标准品溶液(citrinin,质量浓度为10 g/L)购自以色列Fermentek公司。
乙腈和甲醇(色谱纯,德国Merck公司);甲酸(色谱纯,美国Dikma公司);甲酸铵(色谱纯,上海麦克林公司);无水硫酸镁和氯化钠(优级纯,天津科密欧公司)。
1.2 样品前处理
准确称取5.00 g样品于50 mL聚丙烯具塞离心管中,加入10 mL水,涡旋混匀,再加入10 mL乙腈(含2%甲酸)、4 g硫酸镁和1.5 g氯化钠,振荡提取10 min,在4 ℃条件下,以5 000 r/min的速度离心5 min,移出8 mL上层乙腈相,加入2 mL水,涡旋混合。取3 mL萃取液上样到Captiva EMR-Lipid净化柱,使其在重力作用下流过净化柱并收集净化液,待萃取液完全流过后,加压排空净化柱。取2.5 mL净化液于40 ℃水浴中氮吹至近干,用5 mmol/L甲酸铵(含0.1%甲酸)-乙腈溶液(5∶5, v/v)定容至1 mL,充分混匀后,过0.22 μm有机相滤膜,进样分析。
1.3 色谱-质谱条件
1.3.1液相色谱条件
Thermo Hypersil Gold C18柱(100 mm×2.1 mm, 1.9 μm);柱温:40 ℃;进样量:10 μL。流动相:A为5 mmol/L甲酸铵水溶液,B为乙腈-甲醇(1∶1, v/v);流速:0.35 mL/min。梯度洗脱条件:0~0.8 min, 2%B; 0.8~3.0 min, 2%~24%B; 3.0~4.0 min, 24%B; 4.0~6.0 min, 24%~95%B; 6.0~9.0 min, 95%B; 9.0~9.5 min, 95%B~2%B; 9.5~12.0 min, 2%B。
1.3.2质谱条件
加热电喷雾离子源(HESI)温度:350 ℃;毛细管电压:3.5 kV;离子传输管温度:320 ℃;鞘气流速:40 unit;辅助气流速:10 unit; Full MS/dd MS2扫描模式:采集范围为100~800m/z,正负离子同时采集;一级质谱分辨率为70 000,二级质谱分辨率为17 500;归一化碰撞能量(NCE)为30、45和60 eV。
2 结果与讨论
2.1 前处理方法
2.1.1提取溶剂的选择
因为本研究所检测的真菌毒素种类较多,需要兼顾各类目标待测物的提取效率。真菌毒素常用的提取试剂有乙腈、甲醇、乙酸乙酯、丙酮、氯仿、正己烷、二氯甲烷等,考察不同提取剂对目标物的提取效果,其中甲醇、乙腈对各种真菌毒素均有较好的提取效率,优于其他几种提取剂。乙腈为极性较强的低毒溶剂,具有优良的溶解性,对大多数非极性和部分极性真菌毒素有较高的提取率,并可促使蛋白质变性沉淀,提高提取效率[21],因此本研究选用乙腈(或乙腈体系)作为提取剂。部分真菌毒素对pH、极性范围比较敏感,可在提取时加入辅助试剂增强联合提取效果,研究[22-25]发现乙腈作为提取剂加入甲酸可以提高伏马毒素、赭曲霉毒素等的提取效果,经过实验优化最终选择乙腈(含2%甲酸)作为提取液,各种目标待测物均取得了良好的提取效果。
2.1.2净化剂条件的优化
四极杆/静电场轨道阱高分辨质谱仪分辨率高、抗干扰能力强,能有效避免假阳性的发生,对于样品的净化处理要求相对较低,考虑到复杂的样品基质会对色谱柱以及质谱检测器等造成一定污染、缩短寿命,因此对样品提取液进行进一步净化处理。目前多种真菌毒素检测的净化方式主要是采用QuEChERS技术[21,26,27]和多功能净化柱[28-30]。QuEChERS技术中常用的净化剂为乙二胺-N-丙基硅烷(PSA)、石墨化炭黑(GCB)、C18(或十八烷基硅烷键合相吸附剂(ODS))、氰丙基键合硅胶(-CN)、胺丙基键合硅胶(-NH2)等,这些净化剂可通过极性相互作用或非极性相互作用使目标物和杂质相互分离,实验中发现,PSA、GCB、C18、-CN和-NH2几种净化剂单一或组合对样品基质进行净化时,均存在对部分真菌毒素的吸附作用,其中采用PSA和C18对大部分真菌毒素的吸附影响较小,但赭曲霉毒素A的回收率偏低,吸附效应明显。常用的真菌毒素多功能净化柱有Mycosep 226柱和MycoSpin 400柱,其原理是提取液通过不同类型的吸附剂装填而成的柱体,通过填料的选择性吸附作用吸附杂质,达到净化的目的。郑翠梅等[28]在研究中发现使用Mycosep 226柱时,会吸附伏马毒素FB1、伏马毒素FB2和赭曲霉毒素A。叶金等[31]采用直接提取稀释法与MycoSpin 400柱净化方法进行回收率试验,结果显示MycoSpin 400对于赭曲霉毒素A、伏马毒素FB1、伏马毒素FB2及3-乙酰基脱氧雪腐镰刀菌烯醇的回收率不高,影响定量结果的准确性。本研究在参考文献和综合实验结果的基础上采用Captiva EMR-Lipid柱进行净化处理,Captiva EMR-Lipid柱结合体积排阻和疏水作用两种机制,在允许目标分析物通过的同时捕获脂质等杂质,试验结果显示,采用Captiva EMR-Lipid柱进行净化处理后,20种真菌毒素无明显吸附,且操作过程简便,无需活化洗脱程序,直接过滤有效地降低了基质干扰,达到预期净化目的。
2.2 色谱条件的优化
2.2.1色谱柱的选择
对比了Thermo Hypersil Gold C18(100 mm×2.1 mm, 1.9 μm)超高效色谱柱与普通C18柱的分析效果。结果表明,普通的色谱柱柱效偏低,不能保证每种目标物都有较好的峰形,而且分析时间长;Thermo Hypersil Gold C18柱采用亚微米填料技术,具有更高的分离度,更快的分析速度,该柱在较短的时间内,梯度洗脱分析出20种真菌毒素,且各目标化合物的保留良好,峰形对称。
2.2.2流动相的选择和优化
在流动相的选择中,对比了用乙腈和甲醇作为有机相以及水、甲酸铵水、甲酸水作为水相对20种真菌毒素分离的影响。试验结果显示,有机相采用甲醇时,黄曲霉毒素G1和黄曲霉毒素M1、黄曲霉毒素G2和黄曲霉毒素M2的分离效果差,难以实现基线分离,有机相采用乙腈时,大部分目标分析物信号强度降低。综合考虑,采用甲醇-乙腈(1∶1, v/v)作为有机相。为提高检测通量,分析时采用正负离子切换方式,20种真菌毒素的优势加合离子不同,采用甲酸铵水溶液可有效得到[M+H]+、[M+NH4]+、[M-H]-、[M+HCOO]-等多种准分子离子;在甲酸铵水溶液中加入甲酸,虽然可提高[M+H]+的响应强度,但[M-H]-的离子强度显著降低,对玉米赤酶烯酮的检出灵敏度影响较大。结合实验条件,最终选用5 mmol/L甲酸铵的水溶液作为水相,通过优化梯度洗脱程序,目标化合物得到了最佳分离。20种真菌毒素标准溶液的提取离子流色谱图见图1。
2.3 质谱条件优化
本研究采用高分辨质谱的一级质谱全扫描加数据依赖的二级质谱扫描方式(Full MS/dd MS2)。鉴于不同真菌毒素的结构性质不同,分析时采用正负离子切换方式提高检测通量。黄曲霉毒素B、G、M族,黄绿青霉素,桔青霉素,伏马毒素,赭曲霉毒素A和杂色曲霉素正离子模式下响应高,母离子为[M+H]+;蛇形菌素和T-2毒素正离子模式下响应高,母离子为[M+NH4]+;玉米赤霉烯酮负离子模式下响应高,母离子为[M-H]-; HT-2毒素、脱氧雪腐镰刀菌烯醇及其乙酰衍生物负离子模式下响应高,母离子为[M+HCOO]-。首先在分辨率为70 000下对20种目标物进行一级质谱全扫描,将理论精确质量数与实际测量质量数的误差控制在5×10-6范围内,当母离子强度达到设定阈值(1×106)时,自动触发二级质谱扫描,同时得到母离子的精确质量数以及二级质谱的全扫描信息。20种真菌毒素的质谱参数见表1。
2.4 方法学考察
2.4.1方法的线性范围和检出限
采用空白样品基质溶液准确配制不同质量浓度的混合标准工作液,经高分辨质谱检测,以色谱峰面积(Y)为纵坐标、对照溶液的质量浓度(X, μg/L)为横坐标绘制标准曲线。高分辨质谱使用目标物的精确质量数提取,基线噪音很低,信噪比往往无穷大,因此不采用以3倍信噪比(S/N)确定化合物检出限、10倍信噪比确定化合物定量限(LOQ)的方法,而是用向空白样品中逐级降低加标浓度,以各目标物在线性范围中满足回收率值在60%~120%区间内的最低浓度为方法的定量限。结果表明,20种真菌毒素在相应浓度范围内呈良好的线性关系,相关系数(r2)均>0.99,定量限为0.25~20 μg/kg,可满足检测要求。20种真菌毒素的线性范围、线性方程、r2和定量限见表2。
2.4.2回收率和精密度
选取空白小麦、玉米样品,分别添加低、中、高3个不同浓度水平的混合标准溶液,按1.2节进行前处理,每个水平重复测定6次,计算其回收率和相对标准偏差(RSD)。如表3所示,20种目标化合物的回收率为72.9%~117.8%, RSDs为2.9%~15.2%。该方法具有较好的回收率和重复性,可以满足粮谷产品中20种真菌毒素日常监测的要求。
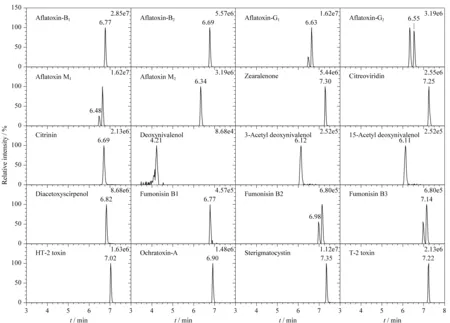
图 1 20种真菌毒素混合标准溶液的提取离子流色谱图Fig. 1 Extracted ion chromatograms of mixed standard solution of 20 mycotoxins

表 1 20种真菌毒素的质谱参数Table 1 Mass parameters for the 20 mycotoxins
表 220种真菌毒素的线性范围、线性方程、r2和定量限
Table 2Linear ranges, linear equations, correlation coefficients (r2), and limits of quantitation (LOQs) of the 20 mycotoxins

CompoundLinear range/(μg/L)Linear equationr2LOQ/(μg/kg)Aflatoxin B11.0-20Y=1.056×107X+1.004×1060.99951.0Aflatoxin B20.25-5.0Y=3.245×106X-3.226×1050.99920.25Aflatoxin G11.0-20Y=1.234×107X-3.214×1060.99931.0Aflatoxin G20.25-5.0Y=1.574×107X-1.226×1060.99900.25Aflatoxin M11.0-20Y=4.158×106X+2.462×1060.99931.0Aflatoxin M21.0-20Y=5.668×106X-2.473×1050.99971.0Zearalenone5.0-100Y=4.246×106X-5.467×1050.99875.0Citreoviridin5.0-100Y=3.289×107X+2.145×1060.99895.0Citrinin5.0-100Y=4.356×106X+2.445×1050.99855.0Deoxynivalenol5.0-100Y=2.589×106X-4.321×1050.99555.03-Acetyl deoxynivalenol20-400Y=5.214×107X+2.789×1060.99812015-Acetyl deoxynivalenol20-400Y=5.265×106X-5.241×1050.998020Diacetoxyscirpenol1.0-20Y=1.286×107X-3.245×1060.99941.0Fumonisin B110-200Y=2.455×107X-1.548×1060.999310Fumonisin B210-200Y=5.228×106X+3.126×1060.998910Fumonisin B310-200Y=6.594×106X-3.717×1050.998710HT-2 toxin5.0-100Y=4.385×106X+5.429×1050.99925.0Ochratoxin-A1.0-20Y=1.488×107X-2.528×1060.99961.0Sterigmatocystin1.0-20Y=2.865×106X-6.421×1050.99911.0T-2 toxin5.0-100Y=4.659×106X+1.478×1060.99935.0
Y: peak area;X: mass concentration, μg/L.
表 320种真菌毒素在小麦和玉米样品中的加标回收率和相对标准偏差(n=6)
Table 3Spiked recoveries and relative standard deviations (RSDs) of the 20 mycotoxins in the wheat and corn samples (n=6)

CompoundSpiked level/(μg/kg)WheatRecovery/%RSD/%CornRecovery/%RSD/%CompoundSpiked level/(μg/kg)WheatRecovery/%RSD/%CornRecovery/%RSD/%Aflatoxin B1189.56.988.77.63-Acetyl 2079.77.481.29.2291.65.494.28.0deoxynivalenol4094.76.589.46.71096.85.297.24.920091.04.290.26.3Aflatoxin B20.25102.17.496.88.615-Acetyl 2087.59.576.86.70.590.34.888.96.7deoxynivalenol4084.76.284.54.32.596.85.1103.67.220090.55.887.95.7Aflatoxin G1189.27.895.38.5Diacetoxyscirpenol190.65.489.04.6296.26.590.26.4294.53.293.54.41092.66.093.44.61097.82.896.53.8Aflatoxin G20.2594.49.195.88.6Fumonisin B11080.08.976.89.30.5101.66.5104.35.42074.57.777.59.22.5117.84.0107.14.210079.87.484.25.8Aflatoxin M1185.75.686.87.2Fumonisin B21073.87.684.211.2294.74.389.96.72081.66.389.67.51091.02.993.66.310079.86.976.45.1Aflatoxin M2187.55.690.37.7Fumonisin B31075.58.577.85.0284.74.984.24.32084.94.984.64.61092.54.488.96.710088.05.280.94.2Zearalenone585.68.288.47.6HT-2 toxin582.75.478.97.61089.86.491.28.71092.64.280.85.65090.55.687.64.45084.73.691.44.4Citreoviridin575.410.677.49.4Ochratoxin A189.73.688.05.41078.98.974.88.7295.44.187.64.75080.26.581.66.81092.32.295.13.8Citrinin572.911.375.610.2Sterigmatocystin174.66.577.27.01075.910.178.46.2287.66.978.65.25079.87.574.94.61082.25.284.54.6Deoxynivalenol5116.815.2109.810.4T-2 toxin587.55.584.98.410109.410.3114.27.21091.74.688.75.250104.58.197.85.35095.63.292.65.3
2.5 实际样品分析
采用本文建立的方法对52份玉米、小麦、大米等样品进行分析,其中5份样品中检出黄曲霉毒素B1和B2, 2份样品检出玉米赤霉烯酮,1份样品中检出脱氧雪腐镰刀菌烯醇。
以一份检出黄曲霉毒素B1的玉米样品为例,将样品采集数据中的母离子精确质量数、保留时间以及二级碎片离子信息等与建立的谱库进行对比,进行20种真菌毒素的快速筛查,并对筛查出的黄曲霉毒素B1进行确证和准确定量。黄曲霉毒素B1的提取离子色谱图和二级质谱图见图2和图3。

图 2 (a)标准溶液和(b)阳性样品中黄曲霉毒素B1的提取离子色谱图Fig. 2 Extracted ion chromatograms of aflatoxin B1 in (a) the standard solution and (b) the positive sample

图 3 (a)标准溶液和(b)阳性样品中黄曲霉毒素B1的二级质谱图Fig. 3 MS2 spectra of aflatoxin B1 in (a) the standard solution and (b) the positive sample
3 结论
本研究利用高效液相色谱-四极杆/静电场轨道阱高分辨质谱,快速筛查和确证了粮谷产品中20种真菌毒素。高分辨质谱保证了复杂样品中基质干扰的消除,显著提高了目标物定性和定量结果的准确性。该方法快速、灵敏、准确,可满足粮谷产品中真菌毒素的大通量快速筛查和确证。

