中华眼镜蛇膜毒素12对膀胱癌细胞增殖、凋亡及自噬的影响*
(昆明医科大学第二附属医院 泌尿外科,云南 昆明 650101)
膀胱癌是全球第9大常见癌症,是泌尿系统肿瘤中最常见的恶性肿瘤之一[1]。根据2015年中国国家癌症登记中心的数据,膀胱癌发病率在男性癌症中位居第6,在中国的发病率及病死率呈上升趋势[2]。在对现有治疗手段进行规范和改进的同时,探究新的肿瘤治疗药物及靶点成为当今学界的研究热点。
眼镜蛇膜毒素12(membrane toxin 12,MT-12)是从中华眼镜蛇毒粗毒中提取出来的一种碱性膜活性多肽,主要是通过破坏细胞膜来发挥其毒性,故称为膜毒素[3]。根据毒性生物学效应不同,又可以命名为心脏毒素、细胞毒素。研究人员发现蛇毒对多种癌细胞均有明显的抑制作用[4-5]。蛇毒抗肿瘤机制尚未明确,目前研究认为其与对肿瘤细胞膜结构的破坏、干扰肿瘤细胞的DNA合成、诱导肿瘤细胞死亡等有关[6]。动物毒液诱发自噬能力的研究是毒素学领域的一个新兴趋势,文献中关于这一问题的研究较少[7]。故本实验探究MT-12对膀胱癌细胞株RT4和T24细胞增殖、凋亡的影响及与细胞自噬的关系,为进一步分析动物毒素MT-12与膀胱癌细胞自噬相关分子机制的研究提供一定的实验基础。
1 材料与方法
1.1 材料
膀胱癌细胞株RT4细胞、T24细胞(昆明医科大学第二附属医院实验室),MT-12(分子质量约为6 700 kD,中国科学院昆明动物所动物毒素研究室),RPMI 1640培养基、二甲基亚砜(DMSO)、胎牛血清(FBS)、胰蛋白酶(含EDTA)(美国Gibco公司),青霉素、链霉素、Western blotting配胶、电泳及转膜液试剂盒、V-ZAD-FMK和氯喹(上海碧云天生物技术有限公司),CCK-8试剂盒(上海东仁化学科技公司),Annexin-V-FITC/PI凋亡检测试剂盒(南京凯基生物科技发展有限公司),甲基噻唑基四唑(MTT)、LC3b一抗(美国 Sigma公司),Lipofectamine 2000(美国Invitrogen公司),辣根过氧化酶标记的羊抗鼠二抗(北京中杉金桥公司),内参抗体β-actin(北京博奥森生物技术有限公司),全自动凝胶图像分析系统(美国Bio-Rad公司),荧光倒置显微镜(日本Nikon公司),FACS Calibur流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞培养2株膀胱癌细胞 RT4 及 T24,于含10% FBS、1% 双抗的 RPMI 1640 培养基,5% 二氧化碳CO2培养箱中培养,实验细胞均处于对数生长期。
1.2.2 CCK-8法检测细胞增殖 取处于对数生长期的膀胱癌细胞,计数后调节细胞浓度为5×104个/ml,加入96孔培养板,每组设5个复孔,200 μl/孔,待细胞贴壁后丢弃原培养液再加入药物。实验组分别加入浓度为 0.10、0.25 和 0.50 μg/ml MT-12 的 RPMI 1640完全培养基 200μl;对照组加入 0.00 μg/ml MT-12的RPMI 1640完全培养基200 ml,无细胞的空白对照加入 200μl RPMI 1640 完全培养基。加药后细胞在37℃、5% CO2培养箱中分别孵育0、24、48、72、96及 120 h,然后加入 CCK-8 10 μl/孔,置 37℃、5%CO2培养箱2 h后,用酶标仪在490 nm处检测各孔的光密度(OD)值。每组实验重复3次。
1.2.3 流式细胞术检测细胞凋亡取处于对数生长期状态良好的膀胱癌细胞,常规消化、分离、收集细胞及细胞计数,接种于6孔板中,每组设3个复孔,培养24 h 后加药处理,实验组加入 0.50 μg/ml MT-12 的RPMI 1640 完全培养基,对照组加入 0.00 μg/ml MT-12的RPMI 1640完全培养基,同时设置NC溶媒对照组。消化收集MT-12处理6及24 h的膀胱癌细胞,离心弃上清液,用预冷的磷酸盐缓冲液(PBS)洗涤。用 1×Annexin-binding Buffer液重悬细胞,调整细胞浓度为 1×106个 /ml,每份标本体积为 100 μl;5 μl AnnexinV-FITC 和5 μl碘化丙啶染色溶液,室温下避光反应 10 min,加入 400 μl 1×Annexin-binding Buffer,在冰面上轻轻摇匀,上流式细胞仪进行检测分析。
1.2.4 细胞活性检测取处于对数生长期的膀胱癌细胞,计数后调节细胞浓度为5×104个/ml,细胞接种于96孔板培养贴壁12 h后加药处理:实验一组分组为(200 μl MT-12 0.50 μg/ml组、200 μl V-ZAD-FMK 50.00 μmol/L 组、100 μl MT-12 0.50 μg/ml组 +100 μl V-ZAD-FMK 50.00 μmol/L 组),对照组加入 200 μl RPMI 1640 完全培养基;实验二组(200 μl MT-12 1.00 μg/ml组、100 μl MT-12 1.00 μg/ml+100 μl氯喹5.00 μmol/L 组、100 μl MT-12 1.00 μg/ml+100 μl氯喹 10.00 μmol/L 组),对照加入 200μl RPMI 1640 完全培养基,设5个复孔,设置空白对照组。置37℃、5%CO2培养箱24 h,离心弃培养液,PBS清洗后,加入10 μl 5 mg/ml的 MTT 溶液培养 4 h,弃原培养基,加入DMSO 100 μl,用酶标仪在 490 nm处测定各孔的OD值。每组实验重复3次。
1.2.5 GFP-LC3转染实验 收集膀胱癌细胞,以 6×105个/孔接种于6孔板,孵育24 h后用无血清无双抗的RPMI 1640培养液进行培养;混合含GFP-LC3质粒和Lipofectamine 2000的培养液,室温孵育30 min后并缓慢倒入6孔板,培养箱孵育6 h,换含血清的RPMI 1640培养液。将对照组和MT-12(0.50 μg/ml)作用于经GFP-LC3转染后的膀胱癌细胞,且按1×105个/ml种植爬片,待细胞贴壁。细胞贴壁后用PBS洗涤细胞2次,4℃丙酮5 min固定后自然干燥。在荧光倒置显微镜下观察绿色荧光斑点并拍照。
1.2.6 Westernblotting 检测蛋白表达情况 收集膀胱癌细胞,以6×105个/孔接种于6孔板,孵育24 h后,对照组和 MT-12(0.50 μg/ml)处理 24 h,用细胞裂解液RIPA充分提取蛋白并检测蛋白浓度,均衡每组蛋白浓度后,以12% SDS-PAGE凝胶电泳分离,90 V条件下电泳,然后 100 V 4℃电转膜 2 h,5%脱脂奶粉封闭 1 h,TBST 漂洗,加入 LC3b 一抗(1:1 000),4℃过夜,TBST洗3次,再分别加入辣根过氧化酶标记的羊抗鼠二抗(1:5 000)室温1 h,TBST洗3次,化学发光显色后胶片成像。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件。计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,多个时间点的比较采用重复测量设计的方差分析,多组间两两比较采用LSD-t检验,两个时间点的比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MT-12对膀胱癌细胞增殖的影响
不同浓度的MT-12处理后0、24、48、72、96和120 h的细胞OD值比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞OD值有差异(RT4:F =7 208.771,P =0.000 ;T24:F =4 778.191,P =0.000);②实验组与对照组的细胞OD值有差异(RT4:F =264.599,P =0.000;T24:F =243.995,P =0.000),实验组较对照组细胞OD值降低,抑制作用增强,细胞生存率降低。③实验组与对照组的细胞OD值变化趋势有差异(RT4:F =173.869,P =0.000;T24:F =143.520,P =0.000)。不同浓度 MT-12 组处理后细胞OD值均呈下降趋势,差异有统计学意义(P<0.05),即时间因素和分组因素存在交互作用;不同浓度MT-12组在同一时间48 h前,细胞OD值无差异(P >0.05);48 h后细胞 OD 值有差异(P<0.05)。见图1和表1、2。
2.2 MT-12对膀胱癌细胞凋亡的影响
用 0.50 μg/ml MT-12 处理 RT4、T24 细胞 6 h 后,可观察到RT4、T24细胞凋亡的增加(见图2)。在6及24 h时,对照组与NC溶媒组凋亡率比较,差异无统计学意义(P >0.05)。MT-12组细胞凋亡率与对照组比较,差异有统计学意义(P<0.05),24 h凋亡率较6 h大幅度增加(见表3)。MT-12能够诱导T24细胞的早期和晚期凋亡,而RT4则是主要发生早期凋亡(见图3)。
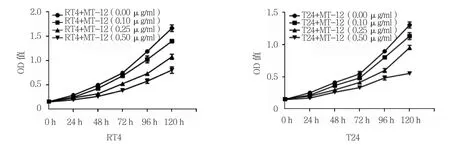
图1 不同浓度的MT-12对膀胱癌细胞增殖的影响(±s)
表1 不同浓度MT-12作用不同时间的膀胱癌RT4细胞增殖情况(±s)
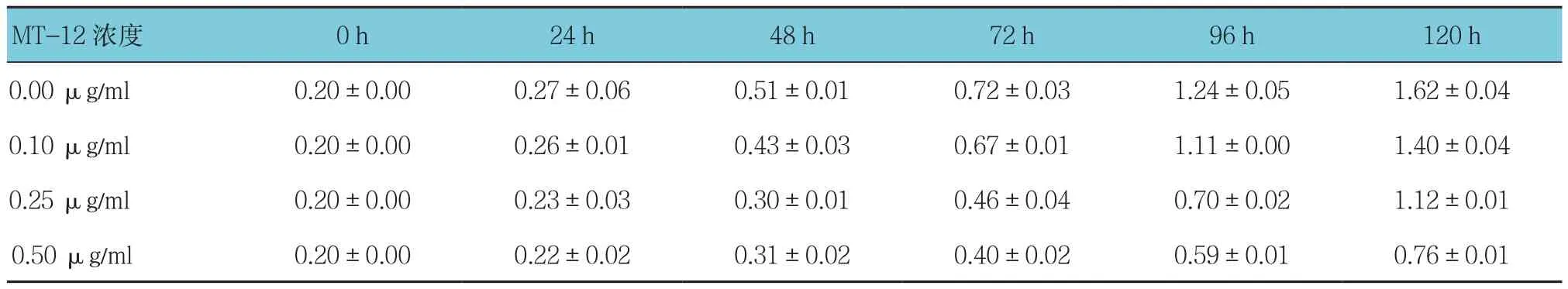
表1 不同浓度MT-12作用不同时间的膀胱癌RT4细胞增殖情况(±s)
images/BZ_10_237_464_2243_535.pngimages/BZ_10_237_748_2243_819.png0.00 μg/ml 0.20±0.00 0.27±0.06 0.51±0.01 0.72±0.03 1.24±0.05 1.62±0.04 0.10 μg/ml 0.20±0.00 0.26±0.01 0.43±0.03 0.67±0.01 1.11±0.00 1.40±0.04 0.25 μg/ml 0.20±0.00 0.23±0.03 0.30±0.01 0.46±0.04 0.70±0.02 1.12±0.01
表2 不同浓度MT-12作用不同时间的膀胱癌T24细胞增殖情况(±s)

表2 不同浓度MT-12作用不同时间的膀胱癌T24细胞增殖情况(±s)
MT-12 浓度 0 h 24 h 48 h 72 h 96 h 120 h 0.00 μg/ml 0.20±0.00 0.26±0.01 0.42±0.03 0.60±0.02 0.83±0.02 1.33±0.03 0.10 μg/ml 0.20±0.00 0.26±0.01 0.39±0.01 0.51±0.02 0.72±0.02 1.17±0.06 0.25 μg/ml 0.20±0.00 0.25±0.01 0.28±0.03 0.47±0.03 0.58±0.02 0.90±0.02 0.50 μg/ml 0.20±0.00 0.23±0.01 0.26±0.02 0.32±0.02 0.48±0.02 0.53±0.03
2.3 V-ZAD-FMK和MT-12对膀胱癌细胞活性的影响
用 0.50 μg/ml MT-12 和 pan-Caspase 抑制剂 VZAD-FMK 50.00 μmol/L处理膀胱癌RT4和T24细胞后,各组的RT4、T24细胞活性率分别为:V-ZAD-FMK组(1.07±0.12)%、(1.09±0.12)%;MT-12组(0.59±0.03)%、(0.31±0.05)%;MT-12+V-ZAD-FMK 组(0.71±0.04)%、(0.55±0.06)%;各组RT4、T24细胞活性率比较,差异有统计学意义(RT4:F =49.505,P =0.000;T24:F =95.447,P =0.000)。RT4、T24细胞对照组与V-ZAD-FMK组间比较差异无统计学意义(t =1.427和 1.696,P =0.179和 0.116);RT4、T24细胞对照组与MT-12组间比较差异有统计学意义(t =8.942 和 12.859, 均P =0.000);RT4、T24 细 胞MT-12组与MT-12+V-ZAD-FMK组间比较差异有统计学意义(t =2.592和 4.452,P =0.024和 0.001)。见图4。
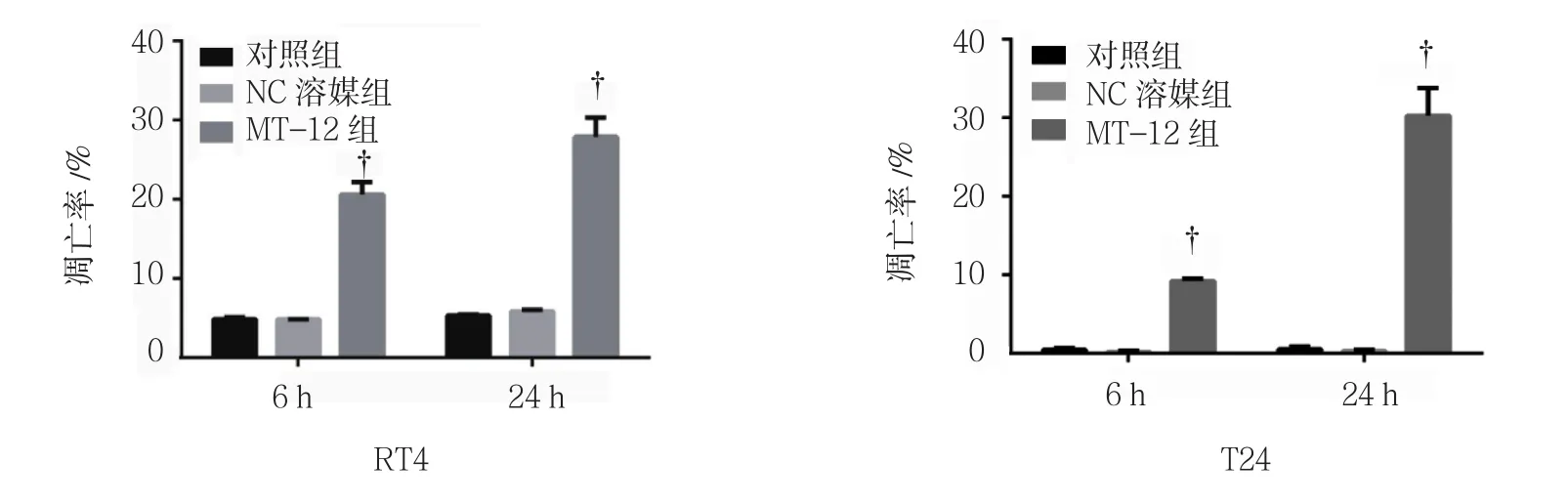
图2 0.50 μg/ml MT-12对膀胱癌细胞凋亡的影响(±s)
表3 各组RT4、T24细胞凋亡情况(%,±s)
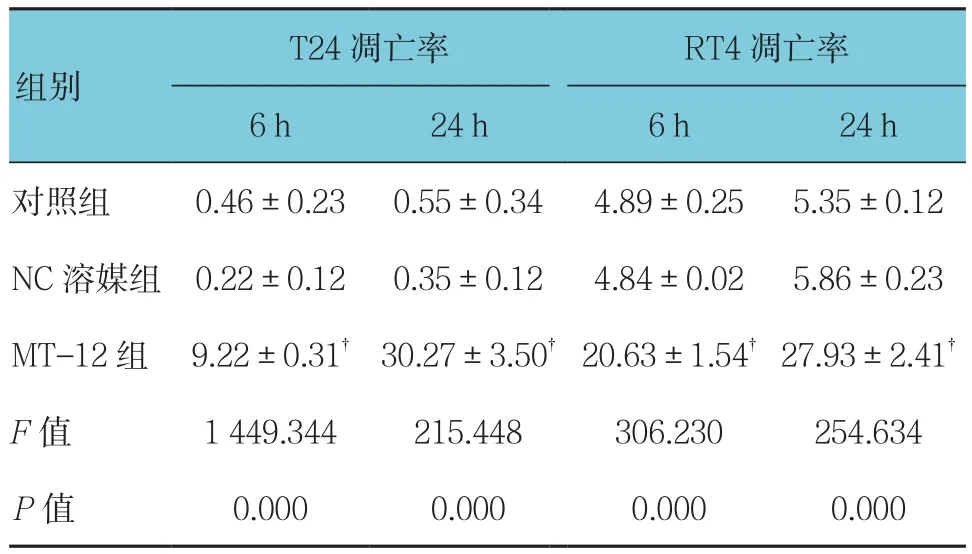
表3 各组RT4、T24细胞凋亡情况(%,±s)
注:†与对照组比较,P<0.05。
T24凋亡率 RT4凋亡率6 h 24 h 6 h 24 h对照组 0.46±0.23 0.55±0.34 4.89±0.25 5.35±0.12 NC溶媒组 0.22±0.12 0.35±0.12 4.84±0.02 5.86±0.23 MT-12组 9.22±0.31† 30.27±3.50† 20.63±1.54† 27.93±2.41†F值 1 449.344 215.448 306.230 254.634 P值 0.000 0.000 0.000 0.000组别
2.4 MT-12对膀胱癌细胞自噬的影响
GFP-LC3转染膀胱癌RT4和T24细胞后表达绿色荧光蛋白GFP,细胞无自噬时GFP-LC3广泛分布在细胞中。与对照组比较,MT-12处理的膀胱癌RT4和T24细胞在荧光显微镜下表现为绿色荧光点聚集现象。见图5。
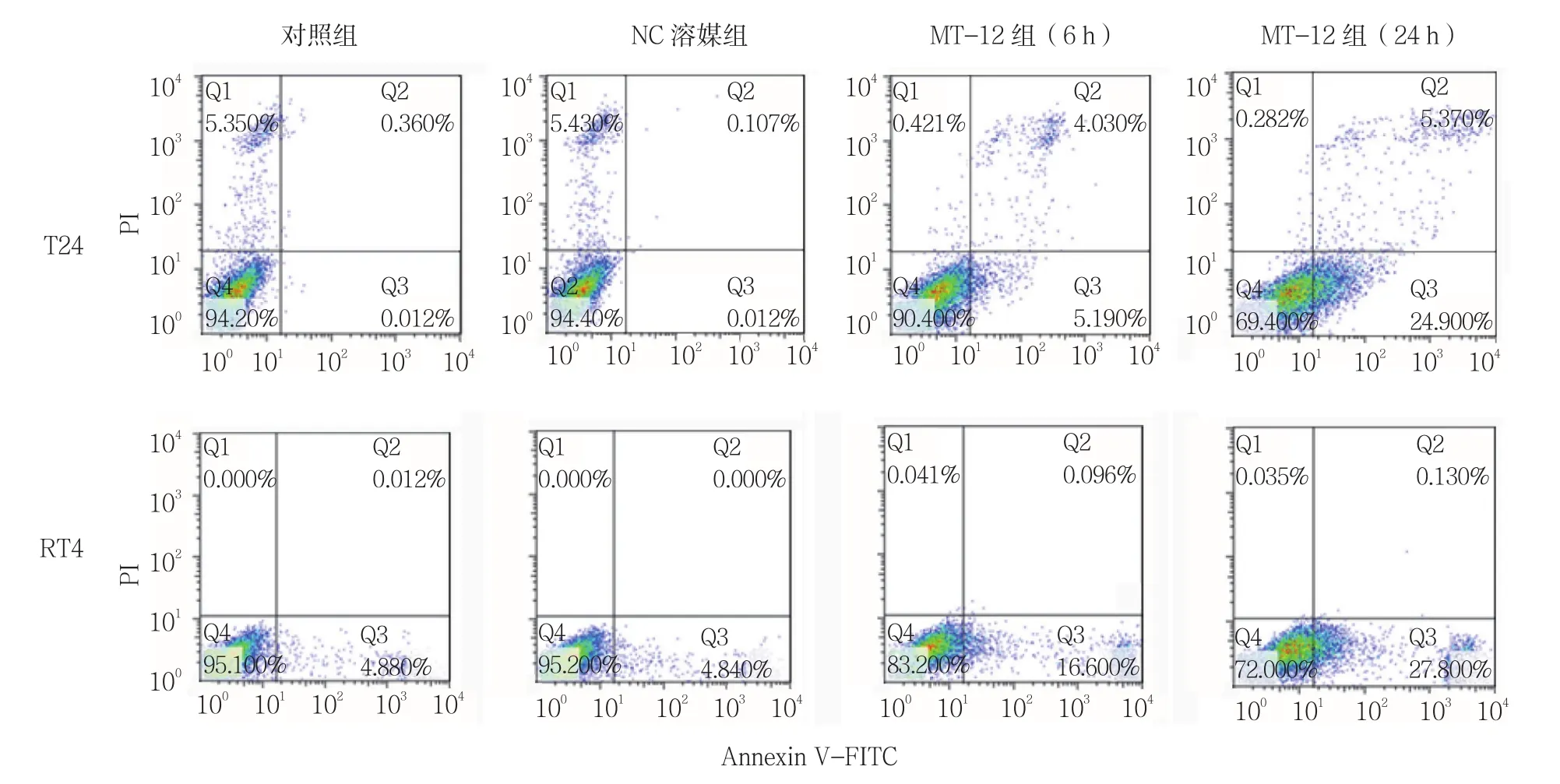
图3 MT-12对膀胱癌T24、RT4细胞凋亡的影响
2.5 MT-12对膀胱癌细胞自噬蛋白LC3-Ⅱ的表达影响
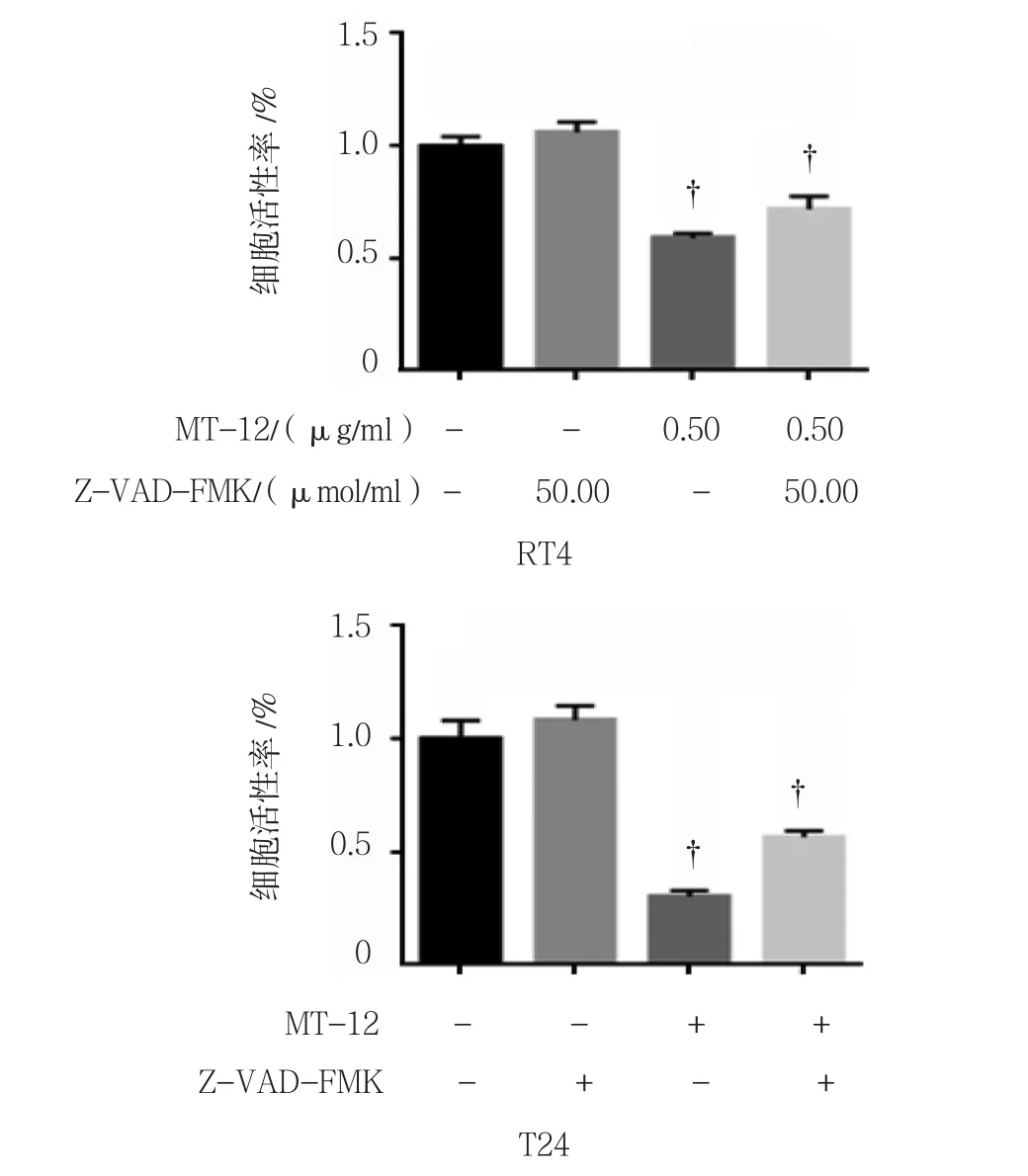
图4 MT-12和Z-VAD-FMK对膀胱癌细胞凋亡的影响(±s)
在自噬过程中,LC3的胞质形式(LC3-Ⅰ)转化为磷脂酰乙醇胺结合形式(LC3-Ⅱ)。因此,LC3通常被用作监测自噬水平的分子标记。0.50 μg/ml MT-12处理膀胱癌细胞RT4和T24后,LC3-Ⅱ/LC3-Ⅰ蛋白表达量分别为:对照组(0.05±0.00)和(0.79±0.04);实验组(0.97±0.08)和(0.29±0.03);实验组RT4和T24均较对照组差异有统计学意义(t =18.847和 16.154,均P =0.000)。见图6。
2.6 氯喹和MT-12对膀胱癌细胞活性的影响
用1.00 μg/ml MT-12和自噬抑制剂氯喹5.00和10.00 μmol/L处理膀胱癌细胞,各组的细胞活性率分别为(0.30±0.02)%、(0.45±0.05)%和(0.62±0.03)%,各组细胞活性率比较,差异有统计学意义(F =403.501,P =0.000)。两两比较发现,1.00 μg/ml MT-12+ 氯喹5.00 和 10.00 μmol/L 组相对单独 1.00 μg/ml MT-12处理组差异有统计学意义(t =7.056和15.174,均P =0.000)。见图7。
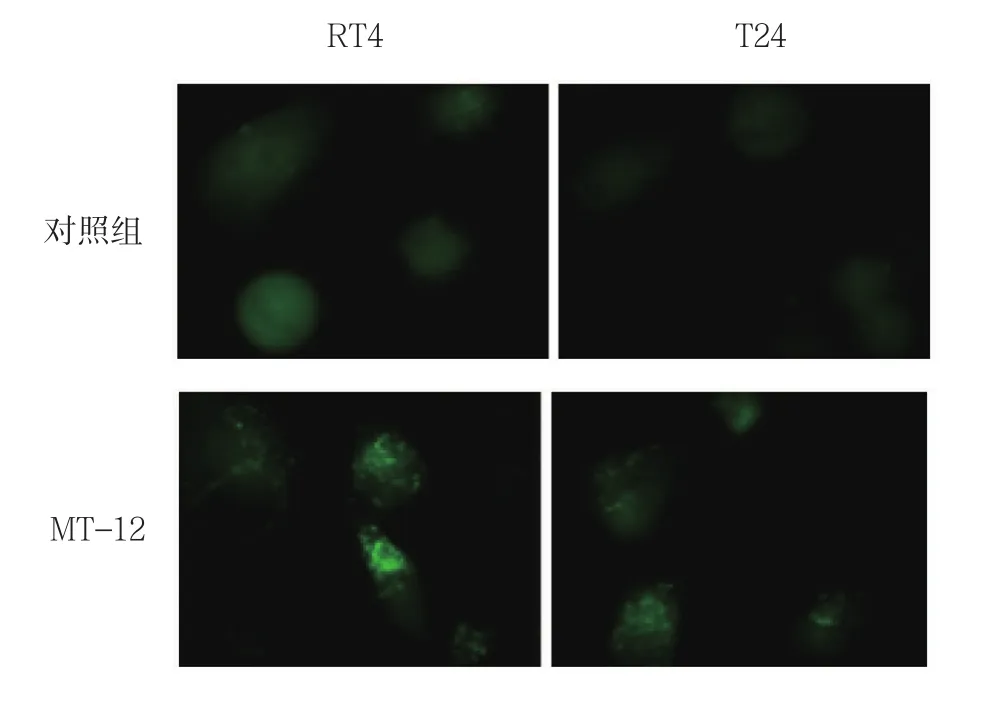
图5 GFP-LC3质粒转染膀胱癌RT4和T24细胞荧光图及斑点(荧光倒置显微镜×400)

图6 MT-12处理膀胱癌细胞RT4和T24后LC3-Ⅱ与LC3-Ⅰ的表达(±s)
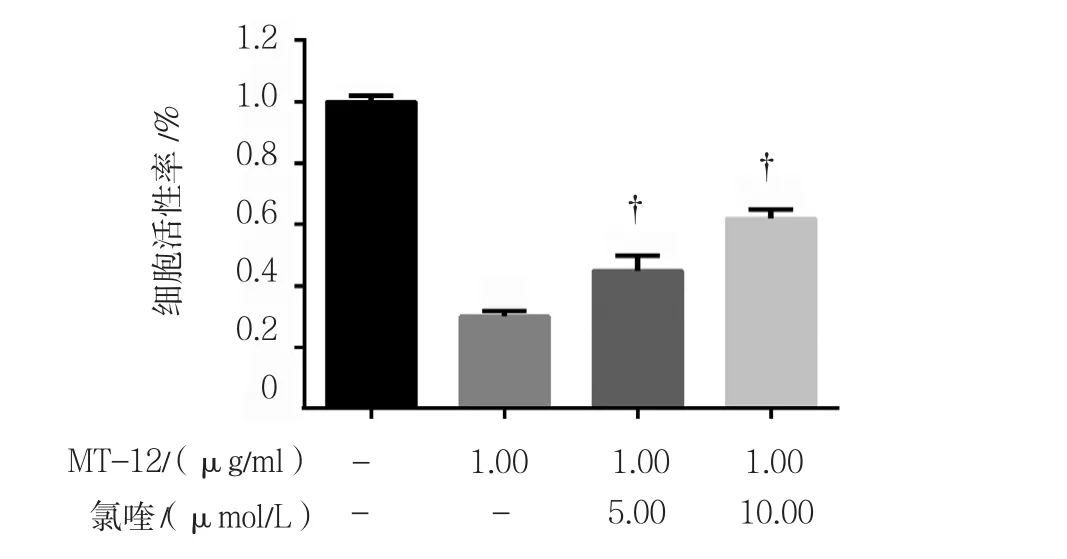
图7 氯喹和MT-12对膀胱癌细胞活性的影响(±s)
3 讨论
膀胱癌是泌尿道最常见的恶性肿瘤,预估2018年,美国将有81 190例新病例和17 240例死亡病例[1]。临床上,膀胱癌被分类为非肌层浸润性膀胱癌和肌肉浸润性膀胱癌。目前,约有75%的病例初诊时局限于黏膜或黏膜下层,然而,大约50%~70%非肌层浸润性膀胱癌的患者有肿瘤复发,大约10%~30%的病例进展为肌肉浸润性膀胱癌[8]。故寻找更加有效的膀胱癌治疗药物,并充分了解其治疗机制成为临床治疗膀胱癌的热点。
自然产物是新型抗肿瘤药物的重要来源,许多物质均被证实有药用价值,对肿瘤的药物治疗有巨大贡献[5]。动物毒液是蛋白质和肽的混合物,主要的毒液成分通常包括神经毒素、真菌毒素、心脏毒素、苏木精及催化酶,毒液成分的药理活性作为潜在治疗剂的来源,一些动物毒素表现出深远的抗癌作用,影响癌细胞增殖、迁移、侵入、凋亡活性及新血管形成[5]。MT是眼镜蛇毒的主要毒性成分之一,既具有心脏毒性,又具有细胞毒性,尤其是对肿瘤细胞有毒性的组分,在蛇毒抗肿瘤作用的研究中占首要地位[9]。MT-12是从蛇毒中分离出的一种膜活性多肽,其毒性是通过破坏细胞膜结构而实现。相对分子质量为6 000 ~ 7 000 kD,对热稳定。MT-12 已被证明对多种体外肿瘤有选择性杀伤作用,对正常细胞的杀伤作用较小[3];在体内能引起肿瘤体积缩小,延长荷瘤小鼠的存活时间,并抑制肿瘤的转移[4]。MT属于三指毒素家族,其4对高度保守的二硫键使得MT的空间结构呈三指状[10]。通过阻断烟碱和毒蕈碱性乙酰胆碱受体的活性,三指折叠毒素干扰与神经肌肉接头运作,为潜在特异性的治疗剂提供突破口[11]。
自噬是细胞体内平衡和适应环境改变的基本功能,如饥饿和细胞内蛋白质的清除和异常细胞器[12]。自噬对肿瘤发生、发展具有双刃剑的作用,在不同的条件和实验体系中存在差异。一方面能够通过降解细胞中非必需的蛋白质或器官,保持细胞内的代谢,为细胞提供必要的能量,维持细胞内平衡,从而促进肿瘤细胞对化疗和放疗的抵抗;另一方面,自噬还能够与细胞凋亡、细胞周期阻滞或相互作用,直接造成肿瘤细胞自噬性死亡,抑制癌症的发展[13]。
本实验首先检测不同浓度的MT-12对两种恶性程度不同的膀胱癌细胞RT4和T24的增殖影响。CCK-8 结果显示 0.10 μg/ml MT-12 对 2株细胞的生长增殖影响小,而0.25和0.50 μg/ml MT-12能抑制RT4和T24细胞的增殖。MT-12能够抑制膀胱癌RT4、T24细胞的增殖,且具有时间-剂量依赖性。随着时间的变化,MT-12能够促进RT4和T24细胞的凋亡。结果与增殖实验的结果趋势一致,MT-12作用于T24、RT4细胞后,细胞凋亡水平呈时间依赖性上升。
研究MT-12在抑制膀胱癌细胞增殖的分子机制时,发现采用Pan-Caspase抑制剂V-ZAD-FMK对2株膀胱癌细胞系进行处理后,MT-12并未完全失去对膀胱癌的抑制效果,暗示细胞死亡可能并不完全依赖于Caspase途径。自噬会大量降解胞内细胞器和大分子,诱导细胞死亡,有学者称其为Ⅱ型程序性死亡[14],其特征是自噬体的出现,不依赖于Caspase途径。实验对可能的自噬性死亡做初步检测发现,通过MT-12作用于膀胱癌细胞株后,LC3-Ⅱ/LC3-Ⅰ比值增大,GFP-LC3转染结果自噬体(绿色荧光点)增多。检测结果表明MT-12能够引起细胞的自噬。氯喹被认为是自噬抑制剂之一,为进一步明确MT-12与自噬关系,实验用氯喹和MT-12同时处理膀胱癌,结果发现氯喹能够消除MT-12对膀胱癌细胞增殖的抑制作用。这说明自噬性的死亡可能发生在MT-12对膀胱癌细胞的抑制作用过程中。
综上所述,MT-12对RT4和T24细胞增殖具有抑制作用,诱导细胞凋亡及自噬,其中具体分子机制及体外研究尚待进一步研究探讨。

