基于卵泡液代谢组学的卵巢低反应生物标志物研究*
徐凯月,孙振高,杨毅,王晓明,王天琪
(1.山东中医药大学,山东 济南,250014;2.山东中医药大学附属医院中西医结合生殖与遗传中心,山东 济南 250014)
卵巢低反应是指在体外受精-胚胎移植/单精子卵泡浆内显微注射-胚胎移植(in vitro fertilizationembro transfer/intracytoplasmic sperm injection-embro transfer,IVF-ET/ICSI-ET)过程中,实施常规促排卵方案时,卵巢对于促性腺激素(Gonadotropen,Gn)反应不良,导致周期取消率高,成熟卵泡少,雌二醇(Estradiol,E2)水平低的一种病理状态。目前卵巢低反应是体外受精-胚胎移植过程中遇到的较严重的问题,随着国家二胎政策的放开,卵巢低反应发病人群不断增加,成为目前生殖领域的挑战。卵巢低反应严重影响体外受精(in vitro fertilization,IVF)患者的获卵率和卵母细胞的质量,进而造成低妊娠率和活产率。其病因复杂多样,包括年龄、遗传、免疫、环境、手术史、心理因素等,诊断至今仍未完全明确。卵泡液是卵母细胞必需的生存环境,其中所含的代谢物将直接体现卵母细胞的发育潜能,而卵泡液代谢组学是对某特定生理时期卵泡液内所有低分子量代谢产物进行定性和定量分析的技术,对于明确卵巢低反应发病机制、诊断以及指导临床用药方面有重大意义。本研究利用卵泡液代谢组学探寻卵巢低反应的生物标志物。
1 资料与方法
1.1 研究对象
1.1.1 病例来源选取 2015年6月—2017年5月山东中医药大学附属医院中西医结合生殖与遗传中心行体外受精/单精子卵泡浆内显微注射(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)的卵巢低反应患者30例(卵巢低反应组)及同期仅因男方因素行IVF/ICSI正常女性49例(对照组)。该研究获该院生殖医学伦理委员会审议批准,所有研究对象知情并签署知情同意书。
1.1.2 卵巢低反应诊断标准卵巢低反应诊断参照2011年根据欧洲人类生殖与胚胎学学会达成的共识——博格尼亚共识,该共识目前是国际上绝大多数有关卵巢低反应研究普遍接受的标准。卵巢低反应诊断标准:①年龄≥40岁或存在卵巢反应不良的其他危险因素;②前次IVF周期卵巢低反应,常规方案获卵数≤3个;③卵巢储备下降(AFC<5~7个或AMH<0.5~1.1 μg/L)。满足以上3条中的2条即可诊断为卵巢低反应。如果年龄<40岁或卵巢储备功能检测正常,患者连续2个周期应用最大化的卵巢刺激方案仍出现卵巢低反应也可诊断为该病。
1.1.3 不孕症诊断标准不孕症诊断标准参照世界卫生组织对不孕症的定义,婚后有正常性生活未避孕,同居1年或1年以上未受孕者诊断为不孕症。
1.1.4 纳入标准①符合博格尼亚共识中前次 IVF 周期发生卵巢低反应,常规方案获卵数≤3个以及卵巢储备下降这2个诊断条件。②对照组不孕因素仅为男方因素;③符合中医以及西医诊断标准;④年龄20~40岁的非妊娠期及哺乳期妇女;⑤同意接受本组治疗并能遵医嘱就诊患者。
1.1.5 排除标准①不符合诊断标准患者 ;②年龄<20岁或>40岁患者;③先天性缺陷或畸形以及染色体、基因异常患者;④合并其他系统疾病患者;⑤不遵医嘱服药到实验结束患者;⑥不能坚持治疗患者;⑦出现严重副作用患者。
1.2 临床方案及用药
收集并记录卵巢低反应组与对照组患者的基本信息,检测并记录方案过程中的血激素、B超等信息。卵巢低反应组与对照组均釆用拮抗剂方案治疗:月经第3天起给予促性腺激素(Gonadotropin,Gn),同时监测卵泡发育情况及血激素水平,当主导卵泡达到12 mm时,添加促性腺激素释放激素拮抗剂(gonadotropin releasing hormone analogues,GnRH-A)(美国百特医疗用品有限公司,0.25 mg/支)至注射用人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)(中国丽珠医药集团股份有限公司,2 000 IU/支)。注射HCG后34~36 h于阴道超声引导下穿刺取卵,留取患者卵泡液。将卵泡液混匀,3 000 r/min,15 min 离心,取第一管上清液于Eppendorf管中,用马克笔做好标记,置入-80℃冰箱冷冻保存。待两组卵泡液收集完毕后,准备实验。
1.3 卵子质量、受精情况以及胚胎评价
通过显微镜观察MⅡ卵子的数目。根据精子质量选用IVF或ICSI,受精后观察原核及第二极体以确定是否受精,见到双原核为正常受精。按本中心实验室操作标准进行常规体外培养,受精后第2天分别观察卵裂情况,第3天观察胚胎发育情况,并进行评分。
1.4 实验方法
采用 Sciex公司 Triple TOF ® 5600+ 系统采集完整的数据,对低反应受试者的卵泡液进行非靶向代谢组学研究,确认潜在的生物标志物。
1.4.1 样品处理精密称取 200 μl受试者卵泡液至玻璃试管,加入600 μl甲醇∶乙腈∶水(4∶4∶2),涡旋 1 min,14 000 r/min,离心 30 min,吸取上清液至EP管内,取5 μl进样分析。
1.4.2 色谱条件分别采用 2 种色谱柱:Kinetex C18,2.1×100 mm,2.6 μm ;Waters BEH Amide,100×2.1 mm,1.7 μm。Kinetex C18 的流动相 A 为水相:0.02%甲酸;流动相B为有机相:乙腈。流速:0.4 ml/min,柱温:40℃。Waters BEH Amide的流动相 A 为水相:10 mmol甲酸胺;流动相B为有机相:乙腈∶水95∶5(V/V),含 10 mmol甲酸胺。流速:0.4 ml/min,柱温:40℃。
1.4.3 质谱条件采用 AB Sciex Triple TOF ® 5600+系统,在正负离子模式下对数据进行采集。扫描方式为经典的数据依赖性扫描(IDA),1次一级质谱扫描(100 ms)触发 10 次二级质谱扫描(50 ms)。动态背景扣除(DBS)功能开启。一级扫描范围为100~1 000 m/z,二级扫描范围为 100 ~ 1 000 m/z,气帘气35 psi,雾化气 55 psi,辅助雾化气 55 psi,离子源温度550℃,去簇电压100 V,碰撞电压(35±15)V。
1.4.4 代谢组学利用代谢组学分析方法将获取的多维色谱数据转化为1个矩阵,采用主成分分析法(PCA)和偏最小二乘法-判别分析法(PLS-DA)从整体上对样本进行直观、可靠和有统计学意义的分析。在得分图中每个点代表一个对应的样本,载荷图中离散点代表得分图分离的变量,离散度越高,对得分图贡献越大。通过t检验对每个变量计算P值,P<0.05为差异有统计学意义。由此可得到组间有差异性的物质质荷比,由获得的精确质量数和同位素丰度比得到匹配的分子式,根据一、二级质谱信息鉴定这些差异物并通过数据库搜索得到相关的代谢通路。
1.5 统计学方法
数据分析采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,符合正态分布者,比较采用t检验;计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组基础情况、促排卵药物用量及卵泡生长情况的比较
卵巢低反应组与对照组的年龄、不孕年限、体重指数(BMI)比较差异无统计学意义(P >0.05),卵巢低反应组基础卵泡刺激素(basic follicle-stimulating hormone,bFSH)及基础窦卵泡数(basic antrol follicle count,bAFC)水平与对照组比较,差异有统计学意义(P<0.05),在卵巢储备方面卵巢低反应组较对照组低(见表1)。两组Gn天数比较,差异无统计学意义(P >0.05)。两组Gn用量比较,差异有统计学意义(P<0.05),卵巢低反应组大于对照组。卵巢低反应组HCG日E2水平及14 mm以上卵泡数与对照组比较,差异有统计学意义(P<0.05),卵巢低反应组低于(少于)对照组的(P<0.05)(见表2)。
2.2 获卵、受精及胚胎情况的比较
卵巢低反应组获卵数、MⅡ卵子数、IVF受精率、2PN卵裂率、可用胚胎数及优胚数与对照组比较,差异有统计学意义(P<0.05),卵巢低反应组低于对照组(P<0.05)。卵巢低反应组获卵率、MⅡ卵率、ICSI受精率、可用胚胎率及优胚率与对照组比较,差异无统计学意义(P >0.05)。见表3、4。
表1 两组患者一般资料的比较(±s)

表1 两组患者一般资料的比较(±s)
组别 n年龄/岁 BMI/(kg/cm2) 不孕年限 bAFC/个 bFSH/(mIU/ml)卵巢低反应组 30 33.130±4.049 22.538±2.938 3.000±2.289 4.867±2.029 13.579±3.609对照组 49 31.220±4.827 22.849±2.253 2.857±1.936 17.449±3.879 6.485±1.204 t值 1.810 -0.530 0.297 -18.876 10.418 P值 0.074 0.598 0.767 0.000 0.000
2.3 主成分分析
利用非靶向代谢组学手段对两组受试者卵泡液样品进行全面分析,经过峰提取、峰匹配及统计分析,4组样品分析的PCA得分图结果见图1(正离子模式)和图2(负离子模式)。由图可知,对照组和卵巢低反应组在PC1维度上得到良好的分离,这说明两组卵泡液样品的物质成分在量上或质上有差异。
2.4 代谢组分析
通过XCMS代谢组学软件热图3(正离子模式)和热图4(负离子模式)分析以及T-test分析找到有差异的化合物,并链接到Metlin数据库,根据一、二级质谱信息,鉴定差异物,并把该差异物通过KEGG聚类分析,指向差异通路。经鉴定共计30种差异化合物,其上调的代谢物有9种,包括L-苯丙氨酸、脯氨酸、色氨酸、1-羟基-2-氧代丙基四氢蝶呤、水杨酸镁、尿苷二磷酸、LysoPC(18∶1)、LysoPC(18∶2)及LysoPC(18∶3);下调的代谢物有21种,包括6-氧代己酸酯、亚油酸酯、油酸、十六烷、花生四烯酸、二十二碳六烯酸、13,14-二氢视黄醇、石胆酸、7-脱氢甾醇、硬脂酰肉碱、25-羟基维生素D3、27-羟基胆固醇、3α,7α,12α-三羟基-5β-胆甾烷、13-羟基-α-生育酚、强啡肽A、LysoPC(16∶1)、LysoPC(16 ∶ 0)、LysoPC(18 ∶ 0)、LysoPC(20 ∶ 5)、LysoPC(20 ∶ 4)、LysoPC(20 ∶ 3)。见表5。
表2 两组促排卵用药以及卵泡生长情况(±s)
表2 两组促排卵用药以及卵泡生长情况(±s)
卵巢低反应组 30 11.133±2.700 3 215.420±1 501.779 1 139.066±689.029 3.200±1.562对照组 49 10.980±1.952 2 461.990±861.624 3 635.837±1 224.774 15.510±7.444 t值 0.271 2.507 -11.586 0.000images/BZ_32_236_1130_2244_1201.pngimages/BZ_32_236_1414_2244_1485.png
表3 两组卵子及胚胎数目情况比较(个,±s)
表3 两组卵子及胚胎数目情况比较(个,±s)
组别 n 获卵数 MⅡ卵子数 可用胚胎数 优胚数卵巢低反应组 30 2.733±1.388 1.767±1.072 1.000±0.788 0.200±0.407对照组 49 12.408±3.999 9.367±3.784 5.000±2.062 1.735±1.411 t值 -15.479 -13.219 -12.204 -7.144 P值 0.000 0.000 0.000 0.014
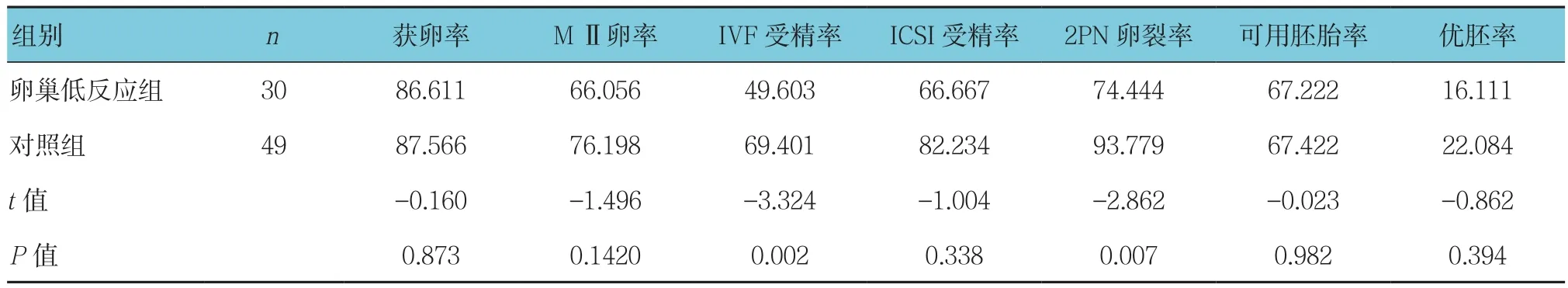
表4 两组获卵、受精及成胚情况比较 %
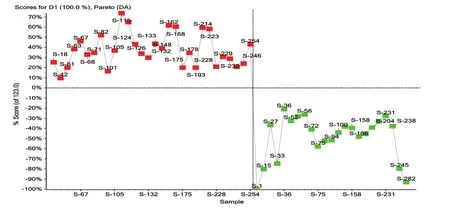
图1 正离子模式下两组患者的得分图
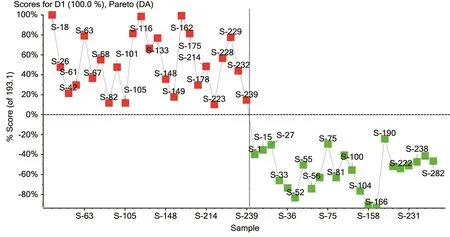
图2 负离子模式下两组患者的得分图
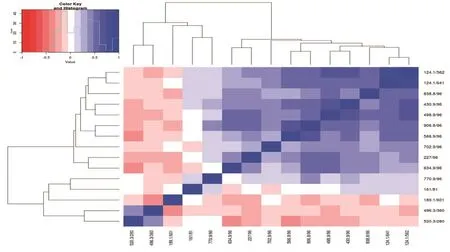
图3 在正离子模式下两组患者卵泡液样品代谢组分析热图

图4 在负离子模式下两组患者卵泡液样品代谢组分析热图
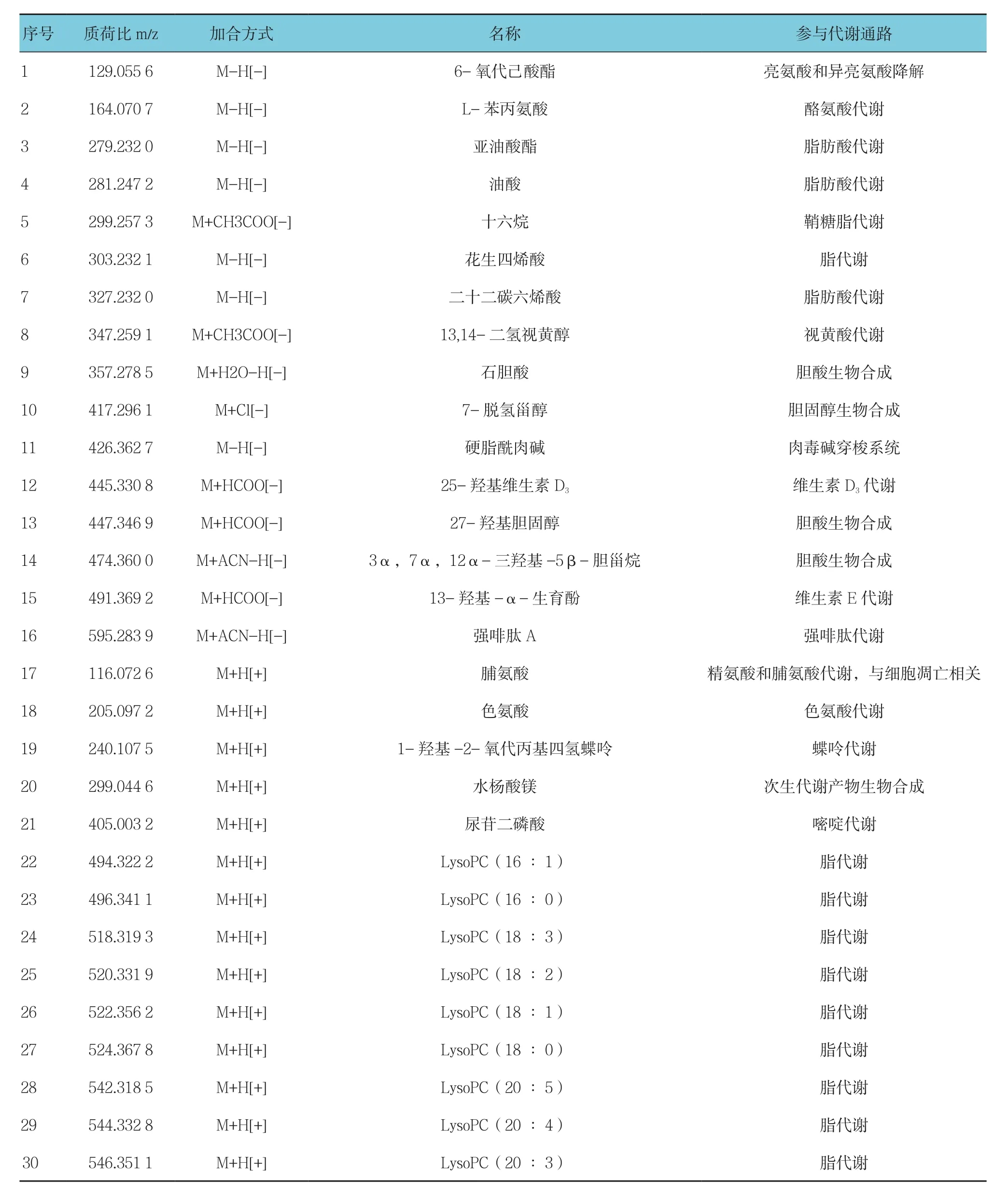
表5 代谢物名称
3 讨论
卵泡液生化成分变化不仅反映卵泡本身的功能状态,还可反映卵母细胞发育潜能、受精能力及形成胚胎的质量,本研究通过非靶向代谢组学技术,找出了卵巢低反应患者与健康女性卵泡液之间的差异代谢物组。这些差异代谢物涉及酪氨酸代谢、胆固醇生物合成、脂肪酸代谢、脂代谢、强啡肽代谢、视黄酸代谢、嘧啶代谢、次生代谢产物生物合成、维生素D3代谢、维生素E代谢等。
3.1 脂类代谢相关代谢物与卵巢低反应
人类卵泡液中最常见的脂肪酸分别是棕榈酸、油酸、亚油酸、花生四烯酸和硬脂酸[1],而本研究中发现与脂肪酸代谢相关的差异代谢物有油酸、亚油酸酯、花生四烯酸以及二十二碳六烯酸,而且均为上调代谢物。由于研究对象跟研究条件的差异,研究结果甚至是自相矛盾的,但脂肪酸和其β-氧化途径对卵母细胞的生长和分化以及胚胎植入至关重要这一点已经被多数研究证明[2-3]。而β-氧化在为卵母细胞成熟提供能量的同时伴有过氧化物及过氧化氢等活性氧的产生,生理水平的活性氧尚且有利于卵母细胞生发、成熟以及胚胎发育,但过量的活性氧会导致氧化应激,可激活线粒体介导的细胞凋亡路径,研究表明与死亡受体比较,线粒体介导的路径在卵母细胞的凋亡中起主要作用[4]。本研究中脂肪酸相关代谢物的上调在一定程度上反映脂肪酸氧化供能的增加,由葡萄糖代谢转化为脂肪酸代谢,可能是卵巢反应不良以及卵母细胞发育不良的机制之一。
7-脱氢甾醇与胆固醇的合成相关,卵泡液中的胆固醇是所有类固醇激素合成的前体,PANDE等[5]通过研究子宫感染对水牛最大卵泡大小和卵泡液成分的影响,发现从受感染水牛的最大卵泡收集的卵泡液中胆固醇和E2浓度比未受感染的组低,并且受感染组最大卵泡小于未受感染组,表明子宫感染对水牛最大卵泡的生长具有抑制作用,胆固醇含量在某种程度上反映了卵母细胞的质量以及发育潜能。本研究中卵巢低反应组7-脱氢甾醇的下调可能是导致胆固醇合成乏源,类固醇激素合成不足,导致卵巢反应不良的原因。
溶血磷脂酰胆碱与十六烷均为与类脂代谢相关的代谢物,溶血磷脂酰胆碱可合成溶血磷脂,是磷脂被磷脂酶水解生成的一种化合物。上调的有LysoPC(18∶ 3)、LysoPC(18∶ 2)、LysoPC(18∶ 1),下调的有LysoPC(16∶1)、LysoPC(16∶0)、LysoPC(18 ∶ 0)、LysoPC(20 ∶ 5)、LysoPC(20 ∶ 4)、LysoPC(20∶3)。LEPAGE等[6]报道LPC在人卵泡液中的浓度几乎与人血浆中的相同,并且检测人类卵泡液中LysoPC(16∶0)的分布,约一半的LPC与白蛋白紧密结合,而剩余的一半处于可溶性游离状态或弱。目前关于LPC对受精方面的研究较多,BAEK等[7]在仓鼠实验中通过使用LPC作为促融合剂来治疗精子,使人精子穿透仓鼠卵母细胞透明带,表明修改卵母细胞的透明带和两个配子的质膜,有利于通过透明带和配子融合的精子穿透。十六烷是与鞘糖脂代谢相关的代谢物,神经节苷脂是指含有一个或多个带负电荷的唾液酸残基的酸性鞘糖脂,分为α-、b-以及c-系列,在免疫学、癌症机制、胚胎发育和受体信号传导发挥重要作用,KIM等[8]通过研究单精子受精猪卵母细胞的过程,加入α-系列的GD1a对保持卵母细胞质量的改善至关重要。有研究显示,b-系列的GT1b降低ROS和DNA损伤,促进卵母细胞的成熟[9]。十六烷在卵巢低反应患者卵泡液中含量较健康女性降低,间接反应出鞘糖脂在卵巢低反应患者卵泡液中降低可能性大,通过以上研究考虑与鞘糖脂改善卵母细胞质量,促进卵母细胞成熟的作用有关。
3.2 硬脂酰肉碱与卵巢低反应
硬脂酰肉碱是肉毒碱穿梭系统中硬脂酸进入线粒体内膜的一种形式,在卵巢低反应组卵泡液中是下调的。肉毒碱通过肉毒碱穿梭系统成为脂肪酸β-氧化代谢途径的主要合作对象,而脂肪酸的β-氧化又涉及卵母细胞能量的获得。硬脂酸的β-氧化过程如下,硬脂酸首先被活化为硬脂酰辅酶A(CoA),与肉毒碱在肉碱脂酰转移酶1(CPT1)的作用下转化为硬脂酰肉碱和CoA,进入线粒体内膜在CPT2的作用下生成肉毒碱、硬脂酰CoA;硬脂酰CoA在线粒体基质通过β-氧化为卵母细胞发育成熟提供ATP[10]。VÁRNAGY等[11]发现IVF患者中肉碱-酯酰途径上调者,可能导致过量的肉毒碱消耗和肉毒碱池相对耗竭,具有更好的生殖潜能,IVF患者可能从肉碱补充中受益。硬脂酰肉碱在卵巢低反应组卵泡液中是下调的,可能与肉毒碱载体的自身不足或者硬脂酸的减少有关,会影响脂肪酸氧化,造成卵母细胞成发育不良。
3.3 胆酸合成相关代谢物与卵巢低反应
石胆酸、27-羟基胆固醇、3α,7α,12α-三羟基-5β-胆甾烷三者均与胆汁酸(BA)的合成相关,BA在卵泡液中的功能现仍属未知领域,而27-HC在女性生殖系统中的作用相对较多。肝X受体(LXR)被认为是胆固醇传感器,被胆固醇或其中间产物如27-HC等活化的LXR通过刺激参与胆固醇逆向转运、胆固醇向胆汁酸转化、胆固醇的胆汁排泄等相关酶和转运蛋白的表达保护细胞避免胆固醇超载[12]。性腺中发现的近端胆固醇前体卵泡液脂肪激活甾醇(FF-MAS)由成熟的卵泡的颗粒细胞大量合成,并触发卵母细胞的停滞数10年的第1次减数分裂的恢复,同时FF-MAS通过抑制卵母细胞的变性提高卵母细胞的存活率,提高受精率,降低多精症的受精率,增加囊胚比率[13]。LXR可以被27-HC活化而抑制羊毛甾醇α-脱甲基酶(lanosterol 14a-demethylase,CYP51)的表达,FF-MAS则是在CYP51作用下产生[14],同时FF-MAS的合成还受到促性腺激素水平的调节。卵巢低反应主要表现为对Gn的不良反应,而卵巢低反应患者中27-羟胆固醇、3α,7α,12α-三羟基-5β-胆甾烷的含量均比正常女性低,考虑可能与LXR通路有关。
3.4 氨基酸代谢与卵巢低反应
氨基酸代谢相关的差异代谢物有6-氧代己酸酯、L-苯丙氨酸、色氨酸、脯氨酸,其中6-氧代己酸酯与亮氨酸、异亮氨酸的降解相关,在卵巢低反应组中为下调代谢物;L-苯丙氨酸与酪氨酸代谢有关,色氨酸则与色氨酸代谢相关,脯氨酸涉及脯氨酸、精氨酸代谢,与细胞凋亡有关,均为上调代谢物。
亮氨酸可促进胚胎发育、分化,提高胚胎发育潜能。HU等[15]通过研究亮氨酸激活猪肠上皮细胞中的雷帕霉素(mTOR)-缺氧诱导因子-1α(HIF-1α)途径,并且补充亮氨酸会诱导能量代谢从氧化磷酸化(OXPHOS)转换为糖酵解,发现亮氨酸诱导的ROS降低实际上取决于通过mTOR-HIF-1α途径的机制从OXPHOS向糖酵解的能量代谢转换,揭示了亮氨酸作为参与哺乳动物能量代谢开关信号分子的调节作用。FORDE等[1]研究生育力不同的奶牛之间卵泡液代谢物的差异发现,泌乳奶牛作为生育力受损的一组与小母牛、非泌乳奶牛相比卵泡液中亮氨酸浓度明显降低,并且蛋氨酸,苯丙氨酸,鸟氨酸,赖氨酸,组氨酸和酪氨酸含量均较低。
色氨酸是重要的神经递质5-羟色胺的前体,也是人体的必需氨基酸之一,免疫方面参与T淋巴细胞的成熟过程。目前研究发现IVF-ET患者血清与卵泡液代谢物,发现色氨酸有希望作为卵母细胞质量的生物标志物,具体机制并未研究[11]。
脯氨酸是精氨酸的代谢产物之一,精氨酸和脯氨酸均与细胞凋亡密切相关,脯氨酸为亚氨基酸,在蛋白质分解合成、机体新陈代谢、伤口愈合以及抗氧化等方面均发挥着重要的调控作用。ZAREBA等[16]发现在MCF-7人乳腺癌细胞中脯氨酸利用减少或者积累增加会导致脯氨酸脱氢酶/脯氨酸氧化酶(PRODH/POX)依赖性细胞凋亡途径,PRODH/POX可将线粒体脯氨酸转化为吡咯啉-5-羧酸会产生超氧阴离子,这可能促成ROS依赖的内源性和外源性凋亡途径,而脯氨酸代谢在细胞凋亡中的机制还需深入研究。WANG等[17]在铜暴露诱导的细胞凋亡以及氧化应激中,发现精氨酸可以预防由于氧化应激所致的蛋白氧化、脂质过氧化以及DNA损伤,体外实验证明培养基中L-精氨酸减少会抑制细胞生长,减少细胞增殖[18]。在本研究中卵巢低反应卵泡液中脯氨酸含量的升高可能与其利用降低或者精氨酸代谢降低,加剧细胞凋亡有关。
L-苯丙氨酸是一种具有生物活性的苯丙氨酸的光学异构体,L-苯丙氨酸可被辅酶四氢生物喋呤不可逆地转化为L-酪氨酸,继分解后经转氨生成少量苯丙酮酸。在IVM培养中发现来自35岁以下患者与≥35岁患者的卵母细胞中谷氨酰胺、精氨酸、蛋氨酸、苯丙氨酸消耗率相比较高[19]。有研究证实卵巢储备低下患者卵泡液中脂肪酸的减少可能与氧化应激相关,导致脂肪酸分子过度消耗,卵泡液微环境中氧化应激增加[20-22]。亮氨酸等氨基酸可以诱导氧化应激的降低,由此,可以猜测脂肪酸的过度氧化应激导致过氧化物的堆积进而引发细胞凋亡,同时也激活了氨基酸降低氧化应激的通路,故卵巢低反应患者卵泡液中会出现脂肪酸相关代谢物降低,氨基酸相关代谢物升高。
3.5 维生素代谢与卵巢低反应
25-羟基维生素D3,是维生素D3的一种活性形式,是维生素D3代谢的中间产物,参与类固醇激素的合成。最近一项前瞻性研究发现,卵泡中较低的25-羟基维生素D3浓度预示卵巢刺激的更好反应,表现为更大的卵泡产生和更高的血清雌二醇浓度[23],该研究与本研究25-羟基维生素D3浓度在卵巢低反应组表现为高含量的结果具有一致性,说明卵巢反应性与25-羟基维生素D3的浓度具有相关性。
视黄酸是维生素A的中间代谢产物,在人体中维生素A的功能以不同的形式实现,其中视黄醛作用于眼部,视黄醇作用于人体的生殖系统。有实验研究维生素A与胚胎质量之间的关系,发现卵泡的大小增加与卵泡液中视黄醇和其生物活性代谢物全反式维甲酸(ATRA)浓度增加(>50%)相关[24]。在本研究中视黄酸含量卵巢低反应组较正常人群是升高的,其原因可能是维生素A保护细胞免受氧化应激导致DNA或其他重要结构如蛋白质和细胞膜的破坏,被过度代谢,从某些方面上讲这体现出卵泡液内部氧化应激的严重程度。
13-羟基-α-生育酚与维生素E代谢相关,维生素E是最主要的抗氧化剂之一,可以提高女性生育能力。研究发现在含有一定水平维生素E的卵泡液中,卵母细胞具有较高的成熟度,且具有一定水平维生素E的血清中,胚胎质量更高[25]。ROS与抗氧化剂防御系统之间的失衡可能是导致卵母细胞发育异常的原因,导致DNA受损,线粒体功能受损,并且会干扰脂质代谢,影响ATP合成,进而导致卵子质量下降[26];PALINI等[27]研究发现在促排卵过程中,在垂体抑制组与取卵后1天组中抗氧化剂β-胡萝卜素、维生素C,以及维生素E的水平均比基线水平显著降低,证实垂体的抑制以及Gn的应用会影响氧化剂与抗氧化剂之间的平衡,导致氧化应激,具体机制尚不明确,并且可能会影响ICSI或IVF结局。
3.6 其他相关代谢物与卵巢低反应
目前关于强啡肽、水杨酸镁、尿苷二磷酸、1-羟基-2-氧代丙基四氢蝶呤这4种化合物在生殖方面发挥的作用以及机制还需要进一步研究。
综上所述,本研究所得到的卵巢低反应组与正常人群之间的差异代谢物组可能是卵巢低反应的生物标志物群,为明确卵巢低反应的临床诊断提供依据。但本研究中纳入的卵巢低反应患者具有明显的符合诊断的低反应症状,且年龄>40岁的卵巢储备低下患者,但年龄<40岁、因手术因素导致的卵巢低反应以及单纯卵巢反应低下而储备正常的卵巢低反应患者并未纳入本研究,该类卵巢低反应的发病人群可能存在与本研究卵巢低反应患者不同的代谢组学改变。在随后的研究中可以将卵巢低反应患者依据年龄、手术史、卵巢储备等做再次分组分析,使结果更具科学性和完整性。

