芪蛭三七汤对心肌梗死大鼠心室重构及内质网应激凋亡的影响*
苏学旭,仲秀艳
(贵州中医药大学第一附属医院 1.心病内科,2.脑病内科,贵州 贵阳 550001)
心血管疾病是威胁我国国民生命健康的最主要的公共卫生安全问题,尤其是冠状动脉粥样硬化性心脏病(以下简称冠心病)的发病率逐年上升,大大增加社会医疗负担。心肌梗死(myocardial infarction,MI)属于冠心病的危急重症之一,在血流动力学、神经体液等因素综合影响下,MI患者的心脏易发生结构重构、功能重构和电重构[1]。其最初表现为左心室几何形状及结构改变,并伴有心肌细胞肥大、心肌代偿性肥厚,最终发生心力衰竭[2]。因此心室重构是MI进展式演变的主要病理机制之一,是患者致死和致残的主要原因[3]。如何改善MI后心室重构、降低心力衰竭的发生率是MI二级预防亟待解决的重大难题。心肌缺血可触发内质网应激(endoplasmic reticulum stress,ERS),适当的ERS可反馈性保护心肌缺血损伤,但是若心肌细胞长期存在严重的ERS,则可能会诱发细胞凋亡[4]。近年来,许多自拟方逐渐用于治疗心力衰竭,并取得良好的临床疗效[5]。但是由于作用机制不明确,限制了中药制剂在临床上的应用。芪蛭三七汤是由贵阳中医学院第一附属医院多个科室成员基于多年临床经验总结共同研制完成,主要成分包括黄芪、桂枝、水蛭、三七和冰片。芪蛭三七汤已应用于临床,前期已有研究证实其疗效显著且安全可靠[6]。笔者通过对该经验方的不断完善,固定药物剂量、精确工艺流程,拟通过本项研究在动物和细胞水平阐述芪蛭三七汤改善MI大鼠心室重构的分子机制,为现代医学治疗MI的研究提供新的思路。现报道如下。
1 材料与方法
1.1 药物、试剂与仪器
芪蛭三七汤由本院药剂科根据中医理论自行配制。配方为:黄芪 30 g,水蛭 10 g,三七 10 g,桂枝10 g,冰片0.1 g。水煎内服,浓缩至相当于原生药材0.63 g/ml。
羟脯氨酸检测试剂盒(南京建成生物工程研究所),葡萄糖调节蛋白 78(glucose regulated protein 78,GRP78)抗体、蛋白激酶R样内质网激酶(PRKR-like endoplasmic reticulum kinase,PERK) 抗 体、p-PERK抗体、真核细胞翻译起始因子2α(eukaryotictranslation initiation factor 2α,eIF2α) 抗 体、p-eIF2α 抗体及活化转录因子 4(activating transcription factor 4,ATF 4)抗体(美国Abcam公司),B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)抗体、Bcl-2 相关 X 蛋白(bcl-2-associated X protein,Bax)抗体及 Caspase-3 抗体(美国 R & D Systems公司),RIPA 加强型细胞裂解液(美国Solarbio公司),3%戊巴比妥钠由本院药剂科提供,PCR引物由苏州Genewiz生物科技有限公司合成并提供,BCA定量试剂盒、TUNEL试剂盒(上海碧云天生物技术有限公司),cDNA合成试剂盒、荧光定量聚合酶链反应试剂盒及Taq DNA聚合酶(美国Omega公司),实验用水为超纯水,其余所用试剂均为分析纯。
小动物呼吸机(DW2000,上海嘉鹏科技有限公司),石蜡切片机(HM 340E,美国Thermo公司),PowerLab数据分析处理系统(澳大利亚AD instruments公司),实时定量PCR仪和iMake全自动酶标仪(美国Bio-Rad公司),CX41光学倒置显微镜、荧光共聚焦显微镜及JEM-1400型透射电子显微镜(日本Olympus公司),Fluor Chem FC3 凝胶成像数码分析系统(美国 Protein Simple公司)。
1.2 模型的复制、分组及干预方式
70只健康雄性SD大鼠,体重220~250 g,无特定病原体(SPF)级,购自上海睿太莫斯生物科技有限公司,许可证号:SCXK(沪)2016-0001,饲以无菌颗粒饲料,自由饮水;动物房温度稳定在(25±1)℃,相对湿度为40%~70%,12 h昼/夜交替照明。所有操作均符合动物伦理学要求。
采用冠状动脉结扎法复制MI大鼠模型[7]。复制模型前,大鼠禁食12 h,腹腔注射3%戊巴比妥40 ml/kg,将大鼠置于自制的实验平台上,固定四肢。纵向剖开气管,插入小动物呼吸机,频率维持70次/min,潮气量为1.5~2.0 ml/100 g。术前描述Ⅱ导联心电图。在胸骨左缘3~4肋骨间开胸,充分暴露心脏。揭开心包膜和脂肪垫,暴露左心耳后,对两组MI模型大鼠,采用7号缝合线在肺动脉圆锥和左心耳之间左冠状动脉前降支处进行结扎,造成心肌缺血;而对假手术组大鼠,并未对冠状动脉进行结扎,直接缝合关胸。采用心电图监测S-T段出现弓背样抬高(>0.2 mV)或T波高耸,肉眼见结扎周围心肌组织呈暗红色或灰白色,则显示进行性心肌梗死模型复制成功。成功后大鼠自由活动和进食。
取模型复制成功大鼠,称重,按照随机数字表法分组,分组及干预方式如下:①空白对照组(n =15):灌胃给予10 ml/(kg·d)无菌生理盐水。②假手术对照组(假手术组)(n =14):灌胃给予 10 ml/(kg·d)无菌生理盐水。③MI模型对照组(MI组)(n =11):灌胃给予10 ml/(kg·d)无菌生理盐水。④芪蛭三七汤干预模型组(QZ组)(n =13):灌胃给予22.68 g/(kg·d)(相当于2倍临床等效剂量)芪蛭三七汤溶液。于模型复制后次日开始给药,1次/d,连续给药4周。
1.3 超声心动图
术后4周,称量大鼠体重,大鼠吸入乙醚麻醉后,置于自制的实验平台上,固定四肢。采用小动物超声仪获取乳头肌水平短轴切面,每组数据测量3次,取平均值。检测左室舒张末径(left ventricular enddiastolic dimension,LVEDd)、 左 室 收 缩 末 径(left ventricular end-systolic dimension,LVESd)、左室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(fractional shortening,FS)。
1.4 血流动力学指标
心功能检测完毕后,分离大鼠右侧颈总动脉,插入PE-50聚乙烯导管,连接PowerLab数据分析处理系统,记录平均动脉压(mean arterial pressure,MAP),进一步插入左心室,记录左室压上升最大速率(+dp/dtmax)和左室压下降最大速率(-dp/dtmax)。每组数据测量3次,取平均值。
1.5 心肌梗死面积
将大鼠颈椎脱臼处死后,迅速取出心脏,放入预冷的生理盐水中,灌洗心脏,从主动脉逆行注射伊文斯兰,分离心房和心室,将心室置于含有2%琼脂糖的培养皿中固定,切片后,避光置于复温的、含有2%TTC磷酸缓冲液的棕色小瓶中孵育30 min。此时梗死区为灰白色,可判断梗死心肌面积(area of necrosis,AN);砖红色为缺血非梗死区;而缺血区面积(area at risk,AAR)为灰白色和砖红色之间的颜色区域;正常区域为蓝色。将心脏组织置于4%多聚甲醛,采用Sigma Scan软件计算梗死区域面积。梗死范围以AN/AAR表示。每组数据测量3次,取平均值。
1.6 标本采集及处理
1.6.1 标本采集取出大鼠心脏后,取出心房和右心室,于结扎点下横切2~3 mm,置于4%多聚甲醛溶液中固定5~7 d。然后生理盐水清洗固定液,分别在60%、75%和90%的乙醇溶液中浸泡30 min,然后在100%乙醇Ⅰ中浸泡10 min,后在100%乙醇Ⅱ中浸泡20 min。采用石蜡包埋,保存备用。
1.6.2 HE染色 取心肌组织石蜡包埋块,组织切片(3~4 μm),进行HE染色。首先将组织切片脱蜡,采用100%、90%、75%乙醇梯度脱水,滴加苏木精染色5 min,冲洗3 s,滴加1%盐酸乙醇分化,冲洗,滴加0.5%伊红染色液染色3 min,冲洗,采用75%、90%、100%乙醇脱水,滴加松节油透明,中性树胶封片。置于光学显微镜下观察。
1.6.3 心肌细胞凋亡实验取石蜡包埋块,切片(3~4 μm)。采用TUNEL法,按照试剂盒说明书进行操作。每张切片于非梗死区域随机选择10个高倍镜视野(×40),计数阳性染色细胞比例,比(%)表示凋亡指数(apoptosis index,AI)。每组数据测量 3 次,取平均值。
1.7 Western blotting检测蛋白表达
①蛋白提取:取结扎线下左室后壁心肌组织约100 mg,加入预冷PBS,清洗3次;将组织剪碎后,加入1 ml预冷的蛋白裂解液,冰浴30 min,匀浆;离心,取上清液;采用BCA蛋白测定试剂盒说明书进行下一步操作。②蛋白变性:加入SDS上样缓冲液充分混匀,置于95℃水浴中10 min,使蛋白变性,分装,置于-20℃冰箱冷冻保存备用。③Western blotting:将10%的SDS-聚丙烯酰胺凝胶电泳,分离蛋白转移到聚偏二氟乙烯膜(PVDF)上。将PVDF浸入密封液中,室温密闭1 h。取出PVDF,采用TBST冲洗3次,分别加入GRP-78、PERK、p-PERK、eIF2α、p-eIF2α、ATF4抗体(1∶500稀释)或者凋亡相关蛋白抗体Bcl-2、Bax、Caspase-3、Cytochrome C(1 ∶ 1 000 稀释),置于4℃摇床上过夜。采用TBST冲洗3次,加入二抗,37℃孵育1 h,采用TBST冲洗3次;取适量的ECL试剂显影5 min,采用凝胶成像分析系统分析凝胶光密度值。每组数据测量3次,取平均值。
1.8 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较采用单因素方差分析,进一步两两比较采用SNK-q检验,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 动物存活状态
由于麻醉、操作失误、气胸以及术后24 h内因死亡15只,术后24 h存活率为72.73%。假手术大鼠死亡1只,MI大鼠死亡14只,因此给药前,假手术组有14只大鼠,MI组和QZ组各13只大鼠。给药期间,QZ组、空白对照组和假手术组大鼠无死亡,而MI组于术后第10天和16天各死亡1只。
2.2 大鼠MI后心脏结构和功能变化
2.2.1 超声心动图评价术后4周,各组大鼠 LVEDd、LVESd、LVEF、FS水平比较,采用单因素方差分析,差异均有统计学意义(P<0.05)。与空白对照组和假手术组大鼠比较,MI组大鼠LVEF和FS降低(P<0.05),而 LVEDd、LVESd增加(P<0.05),左室前壁变薄(P<0.05);但是与MI组大鼠比较,QZ组大鼠LVEF和FS均升高(P<0.05),而LVEDd和LVESd均降低(P<0.05)。见表1和图1。
2.2.2 血流动力学指标术后4周,各组大鼠 +dp/dtmax和-dp/dtmax比较,采用单因素方差分析,差异有统计学意义(P<0.05)。与空白对照组和假手术组大鼠比较,MI组大鼠 +dp/dtmax和 -dp/dtmax绝对值降低(P<0.05)。但是与MI组大鼠比较,QZ组大鼠+dp/dtmax和-dp/dtmax绝对值升高(P<0.05)。见表2。
2.2.3 梗死范围比较术后4周,空白对照组和假手术组大鼠无梗死区域。MI组大鼠梗死范围为(76.85±12.36)%,QZ组大鼠梗死范围为(28.13±10.06)%,QZ组大鼠梗死范围少于MI组大鼠,差异有统计学意义(t =10.652,P =0.000)。
表1 各组大鼠心功能情况(±s)
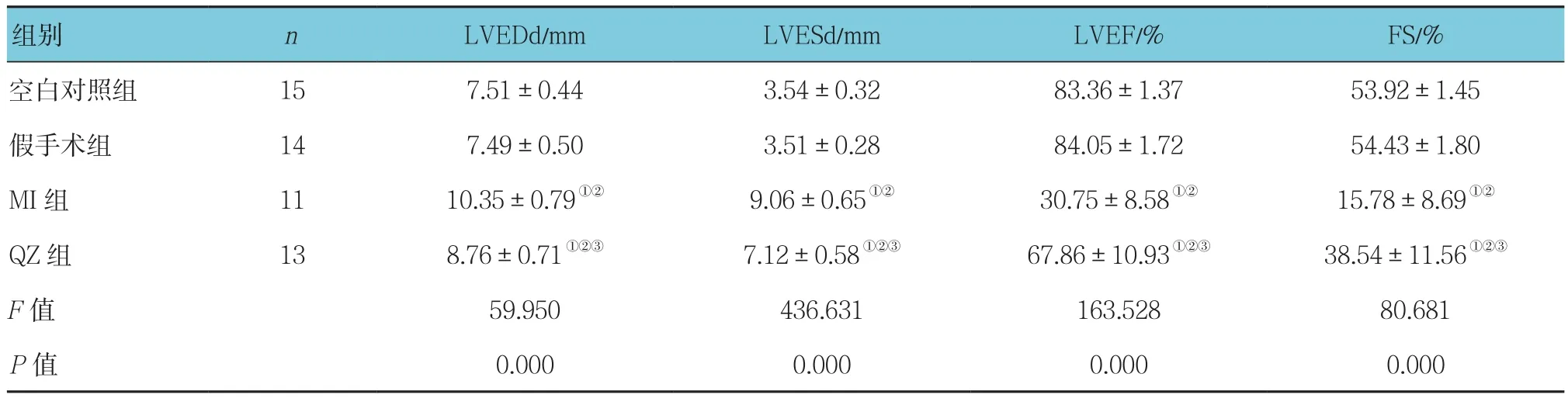
表1 各组大鼠心功能情况(±s)
注:①与空白对照组比较,P<0.05;②与假手术组比较,P<0.05;③与MI组比较,P<0.05。
组别 n LVEDd/mm LVESd/mm LVEF/% FS/%空白对照组 15 7.51±0.44 3.54±0.32 83.36±1.37 53.92±1.45假手术组 14 7.49±0.50 3.51±0.28 84.05±1.72 54.43±1.80 MI组 11 10.35±0.79①② 9.06±0.65①② 30.75±8.58①② 15.78±8.69①②QZ组 13 8.76±0.71①②③ 7.12±0.58①②③ 67.86±10.93①②③ 38.54±11.56①②③F值 59.950 436.631 163.528 80.681 P值 0.000 0.000 0.000 0.000
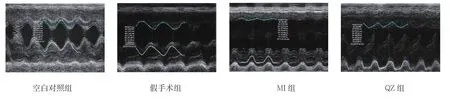
图1 各组超声心动图
表2 各组大鼠血流动力学指标比较(mmHg/s,±s)
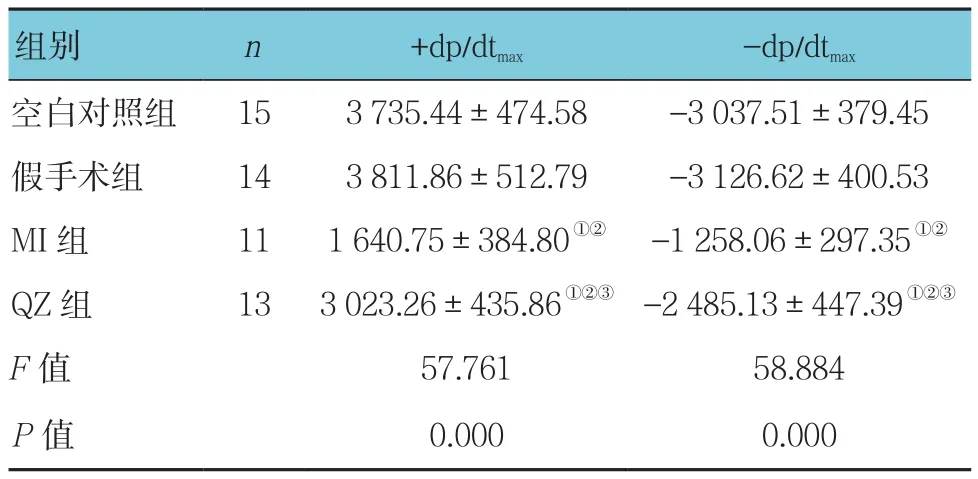
表2 各组大鼠血流动力学指标比较(mmHg/s,±s)
注:①与空白对照组比较,P<0.05;②与假手术组比较,P<0.05;③与 MI组比较,P<0.05。
组别 n +dp/dtmax -dp/dtmax空白对照组 15 3 735.44±474.58 -3 037.51±379.45假手术组 14 3 811.86±512.79 -3 126.62±400.53 MI组 11 1 640.75±384.80①② -1 258.06±297.35①②QZ 组 13 3 023.26±435.86①②③ -2 485.13±447.39①②③F值 57.761 58.884 P值 0.000 0.000
2.2.4 心肌组织形态结构变化解剖各组大鼠心脏,空白对照组和假手术组大鼠心脏几何形状规整,心脏体积和心腔大小正常,颜色呈鲜红色,弹性和韧性良好。与空白对照组和假手术组大鼠比较,MI组大鼠心肌组织失去原有的几何形状,体积增大,呈普大型;心腔扩大,呈暗红色;弹性和韧性降低。另外,QZ组大鼠心脏也出现增大情况,颜色较假手术组偏深偏暗,但是与MI组大鼠比较,情况好转。几何形状相对规整,弹性和韧性尚可。见图2。
经HE染色后,光镜下观察可见空白对照组和假手术组心肌细胞呈多层整齐紧密排列,无水肿、坏死情况,心肌纤维排列紧密,呈束状,横纹肌清晰可见,无炎症细胞浸润。MI组可见心肌纤维肿胀、排列紊乱,甚至部分断裂、溶解、消失,胞浆疏松,有大量炎症细胞浸润。而QZ组大鼠心肌组织虽然也出现肌纤维肿胀、炎症细胞浸润情况,但是较MI组减轻。见图2。
2.2.5 心肌组织超微结构变化经透射电镜观察左室梗死周边区心肌超微结构发现,与空白对照组和假手术组比较,MI组和QZ组MI周边区有明显的肌节长短不齐、肌丝断裂溶解,线粒体的肿胀、空泡化,线粒体嵴减少改变。而QZ组未见肌丝断裂,线粒体略肿胀,但结构基本正常,线粒体嵴可见,并能见到线粒体堆积和代偿性增多现象。见图3。
2.3 大鼠心肌细胞凋亡情况
2.3.1 各组大鼠非梗死区心肌AI情况 各组大鼠非梗死区心肌AI比较,采用单因素方差分析,差异有统计学意义(P<0.05)。与空白对照组和假手术组比较,MI组大鼠非梗死区心肌AI较高(P<0.05)。QZ组大鼠非梗死区心肌AI低于MI组大鼠(P<0.05)。见表3。
2.3.2 各组大鼠Caspase-3、Bax、Bcl-2 蛋白表达情况各组大鼠Caspase-3、Bax、Bcl-2蛋白表达量比较,采用单因素方差分析,差异有统计学意义(P<0.05)。空白对照组和假手术组大鼠心肌组织Bcl-2、Caspase-3、Bax蛋白表达量比较,差异无统计学意义(P >0.05)。与空白对照组和假手术组比较,MI组大鼠心肌组织Caspase-3、Bax蛋白表达量升高,而Bcl-2蛋白表达量降低(P<0.05)。与MI组大鼠比较,QZ组大鼠心肌组织Caspase-3、Bax蛋白表达量降低,Bcl-2蛋白表达量升高(P<0.05)。见表3和图4。
2.4 大鼠心肌组织内质网应激PERK-eIF2α信号通路相关蛋白表达情况
2.4.1 各组大鼠心肌组织GRP78 蛋白表达情况 各组大鼠GRP78蛋白表达量比较,采用单因素方差分析,差异有统计学意义(P<0.05)。与空白对照组和假手术组比较,MI组大鼠心肌组织GRP78蛋白表达量升高(P<0.05)。与MI组大鼠比较,QZ组大鼠心肌组织GRP78蛋白表达量降低(P<0.05)。见表4和图5。
2.4.2 各组大鼠心肌组织PERK、eIF2α蛋白表达及磷酸化水平 各组大鼠心肌组织PERK和eIF2α蛋白表达量基本一致,采用单因素方差分析,差异无统计学意义(P >0.05),但p-PERK 和p-eIF2α 蛋白表达量差异有统计学意义(P<0.05)。与空白对照组和假手术组比较,MI组大鼠心肌组织p-PERK和p-eIF2α蛋白表达量升高(P<0.05)。与MI组大鼠比较,QZ组大鼠心肌组织p-PERK和p-eIF2α蛋白表达量降低(P<0.05)。见表4和图5。
2.4.3 各组大鼠心肌组织ATF4 蛋白表达情况 各组大鼠ATF4蛋白表达量比较,采用单因素方差分析,差异有统计学意义(P<0.05)。与空白对照组和假手术组比较,MI组大鼠心肌组织ATF4蛋白表达量较高(P<0.05)。与MI组大鼠比较,QZ组大鼠心肌组织ATF4蛋白表达量降低(P<0.05)。见表4和图5。

图2 各组大鼠心肌组织的形态结构
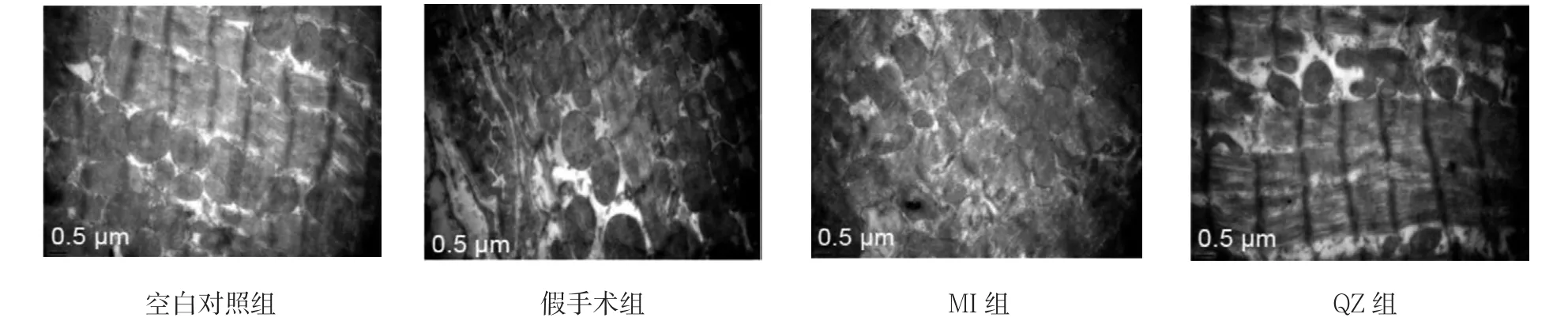
图3 各组大鼠心肌组织的超微结构(×20 000)
表3 各组大鼠心肌细胞凋亡情况(±s)
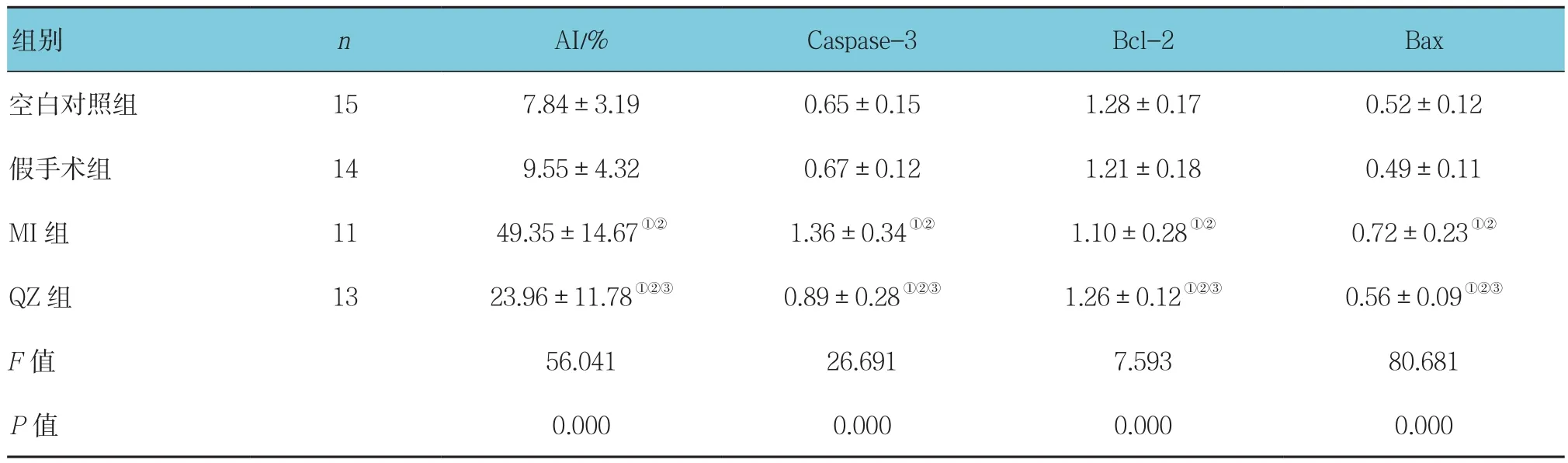
表3 各组大鼠心肌细胞凋亡情况(±s)
注:①与空白对照组比较,P<0.05;②与假手术组比较,P<0.05;③与MI组比较,P<0.05。
组别 n AI/% Caspase-3 Bcl-2 Bax空白对照组 15 7.84±3.19 0.65±0.15 1.28±0.17 0.52±0.12假手术组 14 9.55±4.32 0.67±0.12 1.21±0.18 0.49±0.11 MI组 11 49.35±14.67①② 1.36±0.34①② 1.10±0.28①② 0.72±0.23①②QZ组 13 23.96±11.78①②③ 0.89±0.28①②③ 1.26±0.12①②③ 0.56±0.09①②③F值 56.041 26.691 7.593 80.681 P值 0.000 0.000 0.000 0.000

图4 各组心肌细胞凋亡情况
表4 各组大鼠GRP78、p-PERK、PERK、p-eIF2α、eIF2α、ATF4蛋白表达量的比较(±s)
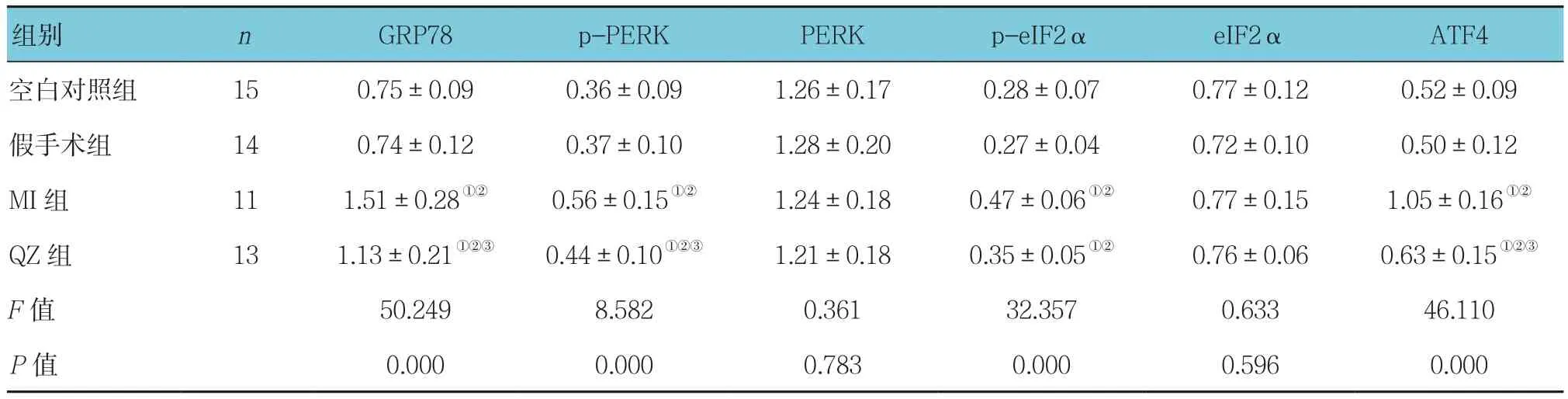
表4 各组大鼠GRP78、p-PERK、PERK、p-eIF2α、eIF2α、ATF4蛋白表达量的比较(±s)
注:①与空白对照组比较,P<0.05;②与假手术组比较,P<0.05;③与MI组比较,P<0.05。
组别 n GRP78 p-PERK PERK p-eIF2α eIF2α ATF4空白对照组 15 0.75±0.09 0.36±0.09 1.26±0.17 0.28±0.07 0.77±0.12 0.52±0.09假手术组 14 0.74±0.12 0.37±0.10 1.28±0.20 0.27±0.04 0.72±0.10 0.50±0.12 MI组 11 1.51±0.28①② 0.56±0.15①② 1.24±0.18 0.47±0.06①② 0.77±0.15 1.05±0.16①②QZ组 13 1.13±0.21①②③ 0.44±0.10①②③ 1.21±0.18 0.35±0.05①② 0.76±0.06 0.63±0.15①②③F值 50.249 8.582 0.361 32.357 0.633 46.110 P值 0.000 0.000 0.783 0.000 0.596 0.000

图5 各组内质网应激PERK-eIF2α信号通路相关蛋白的表达水平
3 讨论
心室重构是MI发展为心力衰竭的基本病理过程。MI患者心脏因血流动力学改变、神经体液因素影响等,易发生结构和功能重构。临床多表现为梗死区形成胶原瘢痕伴膨胀,肺梗死区域出现心肌肥厚、心室扩张以及心功能损伤等,是患者致死和致残的主要原因[8]。在我国,MI后心室重构的发生率约为30%~50%[9],进入本世纪以来,随着再灌注治疗的大力推广和普及,大大降低MI患者的病死率,但是促使更多的MI患者进入心肌梗死后心室重构的阶段。因此,如何减缓或逆转MI后心室重构,降低心力衰竭的发生率,一直是心血管领域亟待解决的难题。
MI后心室重构在细胞水平的病理变化包括心肌细胞病理性肥大、心肌细胞凋亡或坏死、细胞外基质大量沉积等[10]。本项研究中,笔者通过结扎大鼠左冠状动脉前降支造成心肌缺血性坏死,通过显微镜下组织形态观察,MI模型组大鼠心肌组织失去原有的几何形状,体积增大,呈普大型;心腔扩大,呈暗红色;弹性和韧性降低;心功能下降。经HE染色后,MI组大鼠心肌纤维肿胀、排列紊乱,甚至部分断裂、溶解、消失,胞浆疏松,有大量炎症细胞浸润。除此以外,经伊文思蓝和TTC双染法证实MI大鼠心肌组织出现大面积梗死,且持续心肌缺血导致心肌细胞坏死和凋亡,心肌结构和心室构型同时发生相应变化,损伤心肌收缩-舒张功能,造成血流动力学障碍。主要表现为+dp/dtmax降低,-dp/dtmax升高,室壁顺应性下降。从而从组织、细胞、分子水平多方面证实MI模型大鼠复制成功。而上述MI组大鼠心脏结构和功能发生的一系列变化经芪蛭三七汤干预4周后均有所改善。
近几年本院在MI的病因病机、治则治法及复方组成研制等方面均取得突破性进展。其中芪蛭三七汤是本科室基于多年临床经验、结合中西医理论总结的经验方,且已用于临床,并得到患者的普遍认可。该汤药是由黄芪、桂枝、水蛭、三七、冰片组成。该方以黄芪和三七为君药,可益气以助血行,贯心脉而养五脏[11]。桂枝、水蛭为臣药,既能够益气养阴,又可解毒化瘀,水蛭破瘀通络臣,桂枝温阳通脉,冰片开通心窍,引药入络为佐使,诸药合参,共收益气活血、破瘀通络之功效,体现了以补为通,以通为补,通补兼施的特点。因此,在本项研究中,芪蛭三七汤可改善MI大鼠模型的心脏功能,但是其具体的作用成分和作用机制尚不明确。近几年笔者通过对该方剂的不断完善,固定药物剂量、精准生产流程,最终获得本实验所用的芪蛭三七汤剂,笔者拟通过动物、细胞、分子水平探讨中药复方制剂芪蛭三七汤用于心肌梗死后心室重构的干预作用以及作用机制,为现代医学阐释MI后心室重构发生机制的研究以及药物研发提供新的思路。
内质网是真核细胞储存钙离子、折叠修饰蛋白或脂质类物质的重要场所[12]。心肌梗死患者因心肌细胞发生缺血、缺氧性坏死,易导致内质网腔内未折叠蛋白及错误折叠蛋白大量聚集以及钙离子失衡,从而启动细胞凋亡途径[13]。在本研究中,经TUNEL法显示,空白对照组和假手术组大鼠非梗死区心肌AI基本一致,MI组大鼠非梗死区心肌AI较空白对照组和假手术组有所升高,而经芪蛭三七汤干预后,大鼠非梗死区心肌AI低于MI组大鼠。笔者又进一步采用Western blotting法检测各组大鼠心肌组织凋亡蛋白和促凋亡蛋白的表达,结果显示,芪蛭三七汤可有效抑制MI大鼠周边梗死区域细胞凋亡指数,同时降低心肌组织中促凋亡蛋白Bax和Caspase-3的表达,提高抗细胞凋亡蛋白Bcl-2的表达量,可见芪蛭三七汤干预MI后心室重构的机制与抑制心肌细胞凋亡有关。
未折叠蛋白反应是内质网应激介导的一系列自我保护级联反应,对修复细胞损伤、清理坏死细胞、维持机体内环境的稳定性十分重要[14]。静息状态下,内质网腔内未折叠蛋白通过与分子伴侣GRP78蛋白相结合而长期处于未激活状态。GRP78蛋白属于热休克蛋白70家族成员之一,与蛋白的转运、折叠、降解密切相关,其基因启动子上含有特异性的内质网应激反应原件,正常情况下,可与PERK、ATF6、IRE1 3种跨膜蛋白相结合[15]。若内质网腔内蛋白折叠失败而大量滞留,GRP78与这3种跨膜蛋白相解离,使其激活并触发未折叠蛋白反应。因此GRP78激活通常被认为是内质网应激反应发生的标志[16]。在本项研究中,空白对照组和假手术组大鼠心肌组织内质网分子伴侣GRP78蛋白表达量基本一致,MI组大鼠心肌组织GRP78蛋白表达量高于空白对照组和假手术组;QZ组大鼠心肌组织GRP78蛋白表达量较MI组大鼠有所降低。提示芪蛭三七汤保护心肌细胞的分子机制可能与内质网应激反应有关。静息状态下,细胞中GRP78与PERK、ATF6、IRE1 3种蛋白结合处于未激活状态,若内质网上聚集大量未折叠或错误折叠的蛋白,发生内质网应激反应,则可能引起PERK-eIF2α信号通路的激活[17]。PERK的主要作用是抑制错误折叠蛋白的合成和翻译,发生内质网应激反应时,PERK脱离GRP78,促使eIF2α发生磷酸化,从而抑制其蛋白功能[18]。而磷酸化的eIF2α可促使ATF4发生转录翻译,最终导致细胞凋亡[19]。在本项研究中,4组大鼠心肌组织PERK和eIF2α蛋白表达量基本一致,但与空白对照组和假手术组比较,MI组大鼠心肌组织p-PERK和p-eIF2α蛋白表达量有所升高,而经芪蛭三七汤干预后,大鼠心肌组织p-PERK和p-eIF2α蛋白表达量有所降低。说明MI后,大鼠心肌细胞内PERK含量并未增加,但是具有活性的p-PERK水平升高,p-PERK可促使eIF2α蛋白发生磷酸化。PERK-eIF2α通路进一步激活下游因子ATF-4促凋亡蛋白的表达,诱导细胞凋亡。由此推测在MI伴心室重构过程中,内质网应激尤其是PERK-eIF2α信号通路的高度活化,对心肌细胞具有严重损伤作用[20]。而芪蛭三七汤通过降低具有活性作用的p-PERK和p-eIF2α的表达水平,抑制心肌细胞凋亡,从而发挥心肌保护作用。
综上所述,芪蛭三七汤经验方可有效改善MI后大鼠的心功能,减轻不利的心室重塑。而其核心机制可能与抑制PERK-eIF2α信号通路诱导的内质网应激凋亡有关。

