电转方法用于modRNA转染细胞的初步研究
陈茂林 王会景 艾雪峰 颜冰倩 宫艺奇 谭瑶 付炜 王伟
中心法则是现代生物学的基础,DNA 和RNA均可作为遗传物质,均可指导蛋白质的合成。目前的研究多集中于DNA,而mRNA 相较于DNA 有以下优势:①mRNA 具有脉冲式表达的特性;②mRNA 安全性高,因其无需整合到宿主基因组中,故可排除插入诱变的风险[1-2];③mRNA 具有快速表达的特性[3],相较于DNA,mRNA 省略了转录步骤,因此可以更快地合成蛋白质。
自1961 年发现mRNA[4]至1992 年AVP mRNA[5]用于治疗大鼠尿崩症,关于mRNA 的应用十分有限。这是由于mRNA 自身存在两个限制因素:①不稳定性和翻译效率低。mRNA 在生理条件下不稳定,易被细胞和细胞外核糖核酸酶(RNase)迅速降解,从而导致翻译效率低下;②免疫原性高,mRNA 具有高度的免疫原性,进入细胞后可激活细胞Toll 样受体(TLRs)导致炎症和抑制蛋白质翻译[6-9]。直到2005年,Karik'o 等通过在体外化学修饰mRNA 的核苷酸,产生了更稳定及更小免疫原性的modRNA[10-12],从而解决了mRNA 作为表达载体易被降解和高度免疫原性的问题,开启了modRNA 应用的大门。modRNA(Modified messenger ribonucleic acid,合成修饰的信使核糖核酸)是一项在体外对mRNA 的核苷酸进行化学修饰,以逃避机体固有免疫并表达目标蛋白的技术。2011 年有文献报道modRNA 在体内成功表达目标蛋白[13],并有报道利用modRNA 技术研发出对抗寨卡病毒的疫苗。此外,modRNA 目前已被应用于心、肝、胰、肺等器官的修复治疗和去分化诱导产生iPS 细胞[14-18]。
目前,modRNA 应用主要为体内转染,而体内转染具有两个局限性:①转染试剂多为脂质体,有一定的生物毒性;②体内转染效率低下导致表达效率受限[19]。鉴于体内转染的缺点,本研究设想在体外利用modRNA 转染细胞,再结合细胞治疗的方法,将修饰过的细胞重新输回体内。电转染是通过高强度的电场作用,瞬时提高细胞膜的通透性,从而吸收周围介质中的外源分子。电转法操作简单,可重复性高,无毒,对于各种类型细胞均可转染,但对于不同种类的细胞,电转染参数各不相同,包括电压、脉冲时间、温度、细胞状态和数量等均会影响电转染的效率[20]。故本研究拟探讨电转方法用于modRNA 转染细胞的可行性,并筛选出人成纤维细胞、Hela 细胞、293T 细胞和3T3 细胞电转所需的最适电压和脉冲时间。
1 材料与方法
1.1 主要试剂与材料
人成纤维细胞来源于儿童包皮环切术后废弃的包皮组织,由上海交通大学附属上海儿童医学中心泌尿外科提供,家长对治疗及实验均知情同意。本实验经医院医学伦理委员会批准。
DMEM 高糖培养基、0.25%胰蛋白酶、胎牛血清(Hyclone,美国)。
Leica 生物倒置显微镜DMI3000 B(成贯仪器有限公司);BD FACS Canto Ⅱ流式细胞仪、Lonza 电转仪(上海普迪生物技术有限公司);Celetrix 电转仪(深圳市达科为生物技术股份有限公司)。
1.2 方法
1.2.1 modRNA 的设计、制备
参照文献[21]查找到相应的EGFP(Enhanced green fluorescent protein,增强型绿色荧光蛋白)、nGFP(Nuclear GFP,核绿色荧光蛋白)、mCherry 的CDS(Codig sequence,编码序列)序列;在CDS 序列前后添加5' 和3' 非翻译区等序列,之后插入到PUC57 质粒载体;将上述质粒转化到DH5α 大肠杆菌中扩增;提取质粒并使用限制性内切酶将质粒线性化,对所需片段进行PCR 扩增;PCR 的产物体外转录后纯化并通过Nanodrop 和生物分析仪进行RNA 浓度和质量控制。
1.2.2 人成纤维细胞的原代培养
收取包皮组织3~5 块,超净台中用含5%青-链霉素的PBS 缓冲液冲洗3~5 遍。剪去除包皮皮下附着的脂肪、毛细血管等,将组织剪成2 mm×1 cm 的长条形组织块,0.3%的中性蛋白酶浸没,4 ℃冰箱过夜消化;次日取出,将包皮的表皮层用镊子分离,只留下真皮组织,将其剪成约1 mm×1 mm×1 mm 大小,0.3%Ⅳ型胶原酶浸没,37 ℃摇床200 r/min 消化2~3 h。待组织完全消化,用40 μm 孔径的细胞滤网过滤,收集滤液,离心弃上清,PBS 重悬,离心再弃上清。加入2 mL 配制好的完全培养基(10%FBS+DMEM 高糖溶液+双抗)制成细胞悬液,按每块包皮2~3 个10 cm 皿的密度接种于配制好的完全培养基中,于37 ℃、5%CO2下培养,隔天换液,细胞融合达80%~90%时传代,第2~4 代用于实验。
1.2.3 人成纤维细胞电转EGFP modRNA 条件筛选
每6×105个人成纤维细胞加入20 μL 电转液和2 μg EGFP modRNA。取20 μL 混合液加入电转杯中,保持脉冲时间30 ms 不变,分别于435 V、440 V、445 V 电压下电转,将电转后的细胞转入24 孔中,加入完全培养基,于37℃、5%CO2下培养,24 h后荧光显微镜下观察拍照,并通过流式检测仪检测EGFP 荧光强度和表达效率。SPSS 分析结果,确定最适电压。保持电压不变,分别于20 ms、30 ms、40 ms脉冲时间下电转,将电转后的细胞转入24 孔中,加入完全培养基,于37℃、5%CO2下培养,24 h 后荧光显微镜下观察拍照,并通过流式检测仪检测EGFP荧光强度和表达效率。SPSS 分析结果,确定最适脉冲时间。
为了观察EGFP 蛋白表达随时间变化的关系,使用最适电压和脉冲时间向人成纤维细胞电转EGFP modRNA,连续7 d 进行荧光拍照及流式检测。
1.2.4 人成纤维细胞电转nGFP/EGFP+mCherry modRNA
每6×105个人成纤维细胞加入20 μL 电转液和2μg nGFP modRNA;每6×105个人成纤维细胞加入1 μg EGFP、1 μg mCherry modRNA 和20 μL 电转液;最适电压和脉冲时间下电转,将电转后的细胞转入24 孔中,加入完全培养基,于37℃、5%CO2下培养,24 h 后荧光显微镜下观察拍照。
1.2.5 Hela/293T/3T3 细胞电转EGFP modRNA 条件的筛选
对于Hela 细胞,保持脉冲时间30 ms 不变,分别在415 V、425 V、435 V 电压下电转,确定最适电压后,保持最适电压不变,分别于20 ms、30 ms、40 ms脉冲时间下电转。293T 细胞保持脉冲时间30 ms 不变,分别于390 V、400 V、410 V 电压下电转,确定最适电压后,保持最适电压不变,分别于20 ms、30 ms、40 ms 脉冲时间下电转。3T3 细胞保持脉冲时间30 ms 不变,分别于430 V、440 V、450 V 电压下电转,确定最适电压后,保持最适电压不变,在20 ms、30 ms、40 ms 脉冲时间下电转。
1.2.6 统计学处理
每组实验在相同情况下重复3 次,所得数据通过SPSS 20 软件进行分析。数据以()表示,采用t检验进行比较。P<0.05 表示差异有统计学意义。
2 结果
2.1 人成纤维细胞电转EGFP modRNA 条件筛选
为了筛选电转EGFP modRNA 入人成纤维细胞最佳的电压和脉冲时间参数,首先固定脉冲时间,使用不同电压电转;再固定电压,使用不同脉冲时间电转,电转后24 h,通过对不同电转参数的人成纤维细胞进行荧光拍照,肉眼观察。结果显示,使用不同电压和脉冲时间电转后,人成纤维细胞均有荧光蛋白表达(图1A-F),但电压440 V,脉冲时间30 ms时荧光强度最高(图1B、E)。
流式结果显示,2 μg EGFP modRNA 在不同电压下转染人成纤维细胞,435 V、30 ms 时转染效率为93.7%±0.7%;440 V、30 ms 时转染效率为97.3%±0.4%;445 V、30 ms 时转染效率为94.6%±0.5%。三者差异显著(P<0.05),选择440 V 作为最适电压(图2A-C)。
2 μg EGFP modRNA 选择不同脉冲时间转染人成纤维细胞,440 V、20 ms 时转染效率为93.2%±3.2%;440 V、30 ms 时转染效率为97.3%±0.4%;440 V、40 ms时转染效率为81.1%±1.1%,三者差异显著(P<0.05)。选择30 ms 作为最适脉冲时间(图2D-F)。
2.2 EGFP modRNA 表达随时间变化关系
为了观察EGFP modRNA 表达随时间的变化,使用最适电压和脉冲时间向人成纤维细胞电转EGFP modRNA 后,对人成纤维细胞进行连续7 d 的荧光拍照和流式分析。在440 V、30 ms 条件下电转,连续7 d 荧光可观察到荧光强度呈现脉冲式表达,自电转后12 h 到电转后2 d,荧光强度逐渐增强,电转后2 d 荧光强度逐渐减弱。EGFP 表达高峰时间为电转后24~48 h,持续时间约6 d(图3)。
连续7 天流式检测表明:前六天EGFP 表达效率基本持续在90%以上(图4A-G、I),电转后3 天效率最高,为(99±0.17)%(图4D);EGFP modRNA的表达呈现为脉冲式,EGFP 荧光强度高峰时间为电转后24~48 小时,电转后1 天和电转后2 天荧光强度分别为6860.3±1264.6 和5896.7±163.8(图4J)。
2.3 人成纤维细胞电转nGFP/EGFP+mCherry modRNA
nGFP 与EGFP 作用场所不同,EGFP 在细胞质中发挥作用,而nGFP 具有核定位序列,特异性进入核内表达。在细胞实验中,许多转录因子需进入核内发挥作用,若nGFP 可进入核内表达,则许多在核内发挥作用的转录因子也可制作成modRNA 形式。在440 V、30 ms 条件下电转nGFP modRNA 入人成纤维细胞,24 h 后荧光显微镜下可见细胞呈长梭形贴壁生长(图5A),荧光下细胞核发出绿色荧光,荧光图与DAPI 图高度重叠(图5B-D),说明nGFP 可高效进入人成纤维细胞核内表达。
许多基因的调控或者疾病的治疗需要多因子的协同作用。因此,本研究尝试对一种细胞转染两种modRNA,评价电转法的转染效果,观察单个细胞是否可电转入两种modRNA 并同时表达。440 V、30 ms条件下向人成纤维细胞电转1 μg EGFP+1 μg mCherry modRNA,24 h 后荧光显微镜下可见人成纤维细胞发出绿色荧光和红色荧光(图6A、B),且红色荧光和绿色荧光高度重合,红/绿荧光与DAPI 大部分重合(图6C、D),说明EGFP 和mCherry 可共存于同一细胞内并同时表达。
2.4 Hela 细胞、293T 细胞和3T3 细胞电转EGFP modRNA 条件的筛选
为了验证电转法对于不同贴壁细胞导入mod-RNA 的效果,使用Hela 细胞、293T 细胞和3T3 细胞导入EGFP modRNA,筛选最适电压和脉冲时间的方法同前。在电压425 V、脉冲时间30 ms 的条件下,向Hela 细胞电转2 μg EGFP modRNA,24 h 后对细胞进行染色和荧光拍照,可见细胞呈不规则梭形贴壁生长,荧光下可见细胞发出绿色荧光,荧光图与DAPI 图高度重叠(图7A-C),说明EGFP 可在Hela 细胞中高效表达。流式检测EGFP 表达效率高达90.8%(图7D)。
在电压400 V、脉冲时间30 ms 条件下,向293T细胞电转2 μg EGFP modRNA,24 h 后进行细胞染色和荧光拍照,可见细胞呈梭形贴壁生长,荧光下细胞发出绿色荧光,荧光图与DAPI 图高度重叠(图8A-C),说明EGFP 可在293T 细胞中高效表达。流式检测EGFP 表达效率高达90.4%(图8D)。
在电压440 V、脉冲时间30 ms 条件下,向3T3细胞电转2 μg EGFP modRNA,24 h 后进行细胞染色和荧光拍照,可见细胞呈梭形贴壁生长,荧光下细胞发出绿色荧光,荧光图与DAPI 图高度重叠(图9A-C),说明EGFP 可在3T3 细胞中高效表达。流式检测EGFP 表达效率高达96%(图9D)。

图1 不同参数电转EGFP modRNA 后荧光强度Fig.1 Fluorescence intensity after electrotransfer of EGFP modRNA with different parameters

图2 不同参数电转EGFP modRNA 后表达效率Fig.2 Expression efficiency after electrotransfer of EGFP modRNA with different parameter

图3 不同时间EGFP modRNA 的表达Fig.3 Expression of EGFP modRNA at different times

图4 流式检测表达效率和荧光强度Fig.4 Detection of expression efficiency and fluorescence intensity by flow cytometry

图5 电转nGFP modRNA 后荧光图Fig.5 Fluorescence diagram after electroporation of nGFP modRNA

图6 电转EGFP+mCherry modRNA 后荧光图Fig.6 Fluorescence diagram after electroporation of EGFP+mCherry modRNA
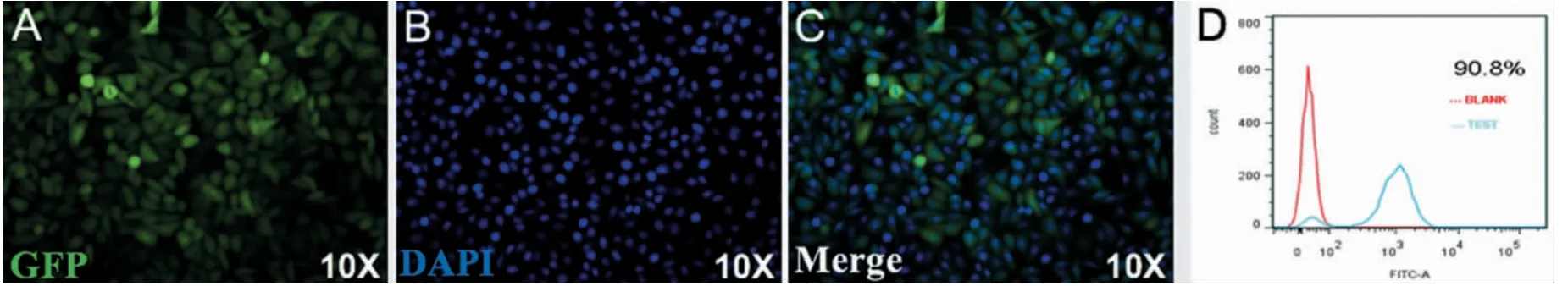
图7 Hela 细胞电转EGFP modRNA 后荧光图Fig.7 Fluorescence of Hela cells after electroporation with EGFP modRNA

图8 293T 细胞电转EGFP modRNA 后荧光图Fig.8 Fluorescence of 293T cells after electroporation with EGFP modRNA
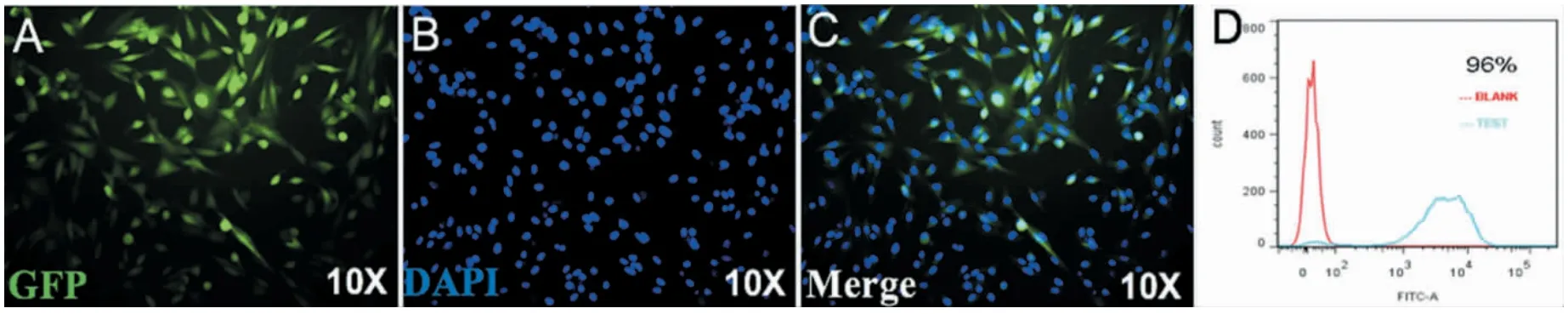
图9 3T3 细胞电转EGFP modRNA 后荧光图Fig.9 Fluorescence of 3T3 cells after electroporation with EGFP modRNA
3 讨论
modRNA 是一项新兴技术,目前实验中多为体内注射[14,22],转染效率有限,故暂未获得广泛应用。本研究尝试在体外利用modRNA 转染细胞,再通过细胞治疗的方法回输细胞到体内。贴壁细胞作为动物体内最常见的细胞种类,取材方便,培养简单,因此被作为实验首选材料。目前导入外源性基因的方法主要有葡聚糖法、病毒法、基因枪、电转染法等。某些真核动物细胞,如原代的T 细胞、神经细胞和干细胞等,其特性决定了葡聚糖等化学试剂法转染效果不佳。病毒转染的繁琐程序,并有潜在的危害性,因此无法大规模应用病毒来完成这些细胞的转染实验。基因枪法导入的基因往往是多拷贝随机整合到受体基因组中,可能发生多种方式的重排。电转染法又名电穿孔法,是通过高压脉冲在细胞膜表面产生一个短暂的开放通道,从而吸收周围介质中的外源分子。该技术可将DNA、RNA、蛋白质等导入各种类型细胞中[23-25]。由于电转法操作简单,可重复性高,无毒,对于各种类型细胞均可转染,故本实验使用电转法尝试将modRNA 导入贴壁细胞。
对于贴壁细胞,首先利用成纤维细胞转染多种不同类型modRNA,转染EGFP modRNA 是为了验证modRNA 表达产物可在胞质中表达;许多转录因子/蛋白需在细胞核内发挥作用,由于nGFP 蛋白有一段核定位序列,需进入细胞核内表达,因此转染nGFP modRNA 是为了验证modRNA 表达产物可进入胞核中表达;许多基因的调控或者疾病的治疗需要多因子的协同作用,因此本研究尝试对一种细胞进行两种modRNA 的电转,以观察单个细胞是否可以电转入两种modRNA 并同时表达。最后利用同一类型modRNA 转染三种不同贴壁细胞,证实modRNA 转染的普遍性。
对于不同种类贴壁细胞,modRNA 电转效率存在差别,目前暂无相关的原理解释,但电转不同种类贴壁细胞modRNA 的表达效率均在90%以上,已达到表达目的基因的要求。
未来的临床应用中,modRNA 技术或可与细胞治疗相结合,例如选取人皮肤成纤维细胞,体外扩增后作为modRNA 载体,体外导入目标modRNA 后,再局部注射到组织中,细胞即表达目标蛋白,从而达到治疗的目的。

