18号染色体短臂缺失1例的实验室诊断
巫 杰,王建玲,汪新蕾,秦婉婷,王玉萍
(皖南医学院 检验学院,安徽 芜湖 241002)
由于社会压力增加、环境污染加重、孕妇自身年龄增大等因素的影响,可导致胎儿染色体数目异常和结构畸变[1],最终导致胎儿智力低下,多发畸形,生长发育落后等出生缺陷[2]及Klinefelter综合征、Turner综合征等。>5~10 Mb的平衡易位、重复、缺失、倒位、插入等的结构异常,技术人员可以给出明确的结果判断[3],对于产前诊断于孕16~20周取羊水细胞培养及染色体检查是预防胎儿染色体数目异常和结构的畸变的经典诊断方法,但少数罕见的结构异常如复杂易位、异常的未知来源的染色体片段、肉眼无法分辨的微重复或者微缺失(通常<5 Mb),存在着定位困难、无法判断来源及这些微重复或者微缺失是否有致病性改变、是否会引起表型异常的困惑。对这些复杂易位、未知来源的染色体片段、微重复或者微缺失进行进一步的准确鉴定,显得尤为重要。
高通量测序[4](high-throughput sequencing,HTS)或称新一代测序(next-generation sequencing,NGS)技术,可一次并行几十万到几百万条DNA分子序列测定,能最小检测到 10 kb 的微缺失及微重复,具有分辨率高、敏感性高和准确性高等优点[5],使出生缺陷的产前遗传学诊断迎来了一个新的技术时代。本文对1例羊水疑似18号染色体断臂缺少的患儿进一步运用全基因组拷贝数变异分析(copy number variations,CNVs)进行检测,验证了之前的判断,现报道如下。
1 对象和方法
1.1 研究对象 孕妇艾某某,女,24岁,孕21周,第一胎,无遗传家族史,因无创产前检测提示18号染色体单体或断臂部分缺失,要求染色体羊水细胞培养染色体核型分析。
1.2 方法 B超定位后,无菌条件下行羊膜腔穿刺抽取25 mL羊水,注入2个 10 mL无菌离心管内离心后吸弃上清液,加入羊水培养基进行培养,10 d左右收获、制片、烤片、染色、核型分析,留 5 mL羊水离心,羊水细胞提取 DNA,对 DNA 消化、连接、扩增、纯化、片段化、标记信号、芯片杂交与洗涤、扫描,实验,基因测序结果与NCBI的SNP数据库、千人基因组数据库等国际权威数据库比对,最终确定是否为突变基因。
2 结果
2.1 羊水染色体结果 46,XY,del(18)(p11.32)见图1。
2.2 染色体畸变分析结果 18 号染色体 p11.32-p11.31 处缺失 5.16 Mb 区域,覆盖了 Chromosome 18p deletion syndrome 约 30%的区域,该综合征患者主要的临床表征为身材矮小,特殊面容,发育迟缓,精神发育迟滞,肌张力障碍,性腺发育不全等,见图2。
2.3 超声结果 宫内单胎,BPD 89 mm,FL 70 mm,胎心率137次/分钟,胎盘位于子宫后壁,厚35 mm,羊水量最大径线68 mm,羊水指数约222 mm,清晰,见图3。
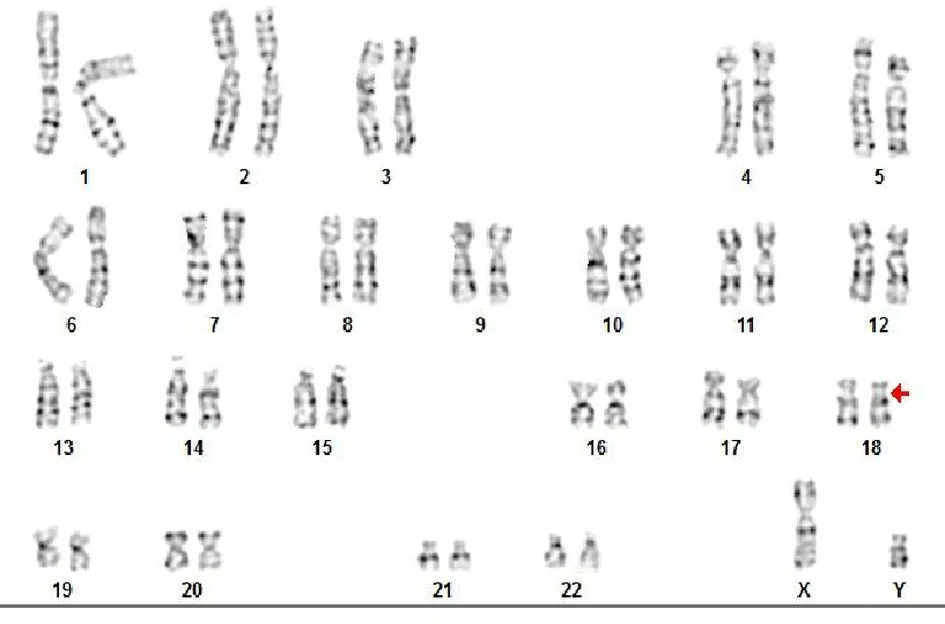
图1 羊水染色体核型结果

图2 染色体畸变分析结果

图3 超声检查结果
2.4 该孕妇于孕42周时,因胎儿宫内窘迫,急诊腰麻麻醉下行子宫下段剖宫手术,术中以LOA位取出一男婴,体质量2580 g,Apgar评分9~10分,羊水量中,色清,胎盘胎膜娩出完整,脐带扭转约25周,探查双附件外观无异常,手术顺利,术中出血约250 mL,术后病人安返病房,予抗炎补液促宫缩支持对症处理,密观产妇生命体征及阴道流血宫缩情况。6 d后新生儿随母出院。
3 讨论
羊水染色体核型分析是检测胎儿染色体的标准方法,目前羊水细胞培养的成功率及诊断准确率约为90%~95%,但仍存在以下局限性:染色体核型分析只能检查染色体数目及结构异常,染色体异常复杂多样,受现有检测方法的限制,有时难以分辨染色体的某些微小结构异常,也不能检出基因的改变;羊穿时间、母血细胞污染、病原体污染、个体差异、标本含羊水细胞太少或活力不足、培养基污染等多种因素影响均可导致细胞培养失败。而HTS技术利用芯片进行测序,可以在数百万个点上同时阅读测序、有完美的定量功能,利用少量(或微量)细胞DNA样本,不但能实现以目标基因组合,甚至个体基因组背景下的疾病表型相关基因微小突变的全面分析,可以最小检测到10 kb 的微缺失及微重复,还可完成受检者染色体、DNA片段拷贝数变异的高效、敏感和特异性检测[6]。 HTS技术的出现使常规产前诊断技术在材料收集、核酸测序过程中具有高效、敏感和特异性高等优点,并在产前诊断中快速拓展应用[7]。
本例胎儿染色体核型分析,46,XY,进一步HTS技术对其验证为46,XN,del(18)(p11.32)。有文献报道,1 例 18p11.32-p11.31 缺失患者主要的临床表征为整体发育迟缓,癫痫,特殊面容,手指异常,运动及语言发育迟缓等;另1 例 18p11.32-p11.31 缺失患者主要的临床表征为前脑无裂畸形,先天性心脏缺陷,特殊面容等[PMID:24091065][8]。同时该区域包含了 SMCHD1 基因[OMIM:614982]的全部,SMCHD1 基因的突变与 facioscapulohumeral muscular dystrophy-2 (FSHD2)[OMIM:603457]相关,FSHD2 患者主要表现为肌无力(最初影响面部肌肉和上肢,后来发展到影响下肢),这种肌无力通常是不对称的[9];有文献报道,SMCHD1基因的缺失会增加患面肩肱型肌营养不良症(facioscapulohumeral muscular dystrophy,FSHD)的风险[PMID:25820463][9]。本文报道患儿已出生数月,经电话回访,目前基本正常,后续情况有待进一步观察。染色体畸变检测作为对传统细胞遗传学的补充,对产前诊断具有重要的临床价值。

